
- •Молекулярная физика
- •II.Температура.
- •Уравнения (4) и (5) представляют собой систему из двух уравнений для нахождения тк и то. Решая их, имеем: к.
- •III. Уравнение состояния идеального газа.
- •Масса 1моля вещества называется молярной массой:
- •Подставив полученное выражение в (2а) имеем
- •IV. Смеси газов. Закон Дальтона.
- •V. Методика определения молярной массы газа.
- •VI. Приборы и принадлежности.
- •Молекулярная физика практикум по молекулярной физике определение молярной массы воздуха
- •625003, Г. Тюмень, ул. Семакова, д. 10
V. Методика определения молярной массы газа.
Учитывая
важность понятия молярной массы в курсе
молекулярной физики, в данной лабораторной
работе предлагается определить
эффективную молярную массу воздуха.
Для этой цели возьмем стеклянный сосуд
с известным объемом V,
заполненный воздухом при атмосферном
давлении
![]() и температуре Т.
Состояние воздуха в сосуде близко к
состоянию идеального газа и для него
можно записать уравнение Клапейрона-Менделеева
в виде:
и температуре Т.
Состояние воздуха в сосуде близко к
состоянию идеального газа и для него
можно записать уравнение Клапейрона-Менделеева
в виде:
![]() (19)
(19)
После
откачки воздуха из сосуда до некоторого
остаточного давления
![]() для оставшегося в сосуде воздуха можно
записать:
для оставшегося в сосуде воздуха можно
записать:
![]() (20)
(20)
После вычитания из уравнения (19) уравнение (20), находим эффективную молярную массу воздуха:
 (21)
(21)
Легко сообразить, что изменение массы воздуха в сосуде равно изменению массы сосуда до и после его откачивания.
Уравнение
(19) можно также использовать для нахождения
плотности воздуха в комнате. Так как
плотность вещества равна отношению его
массы к объему, т.е.
![]() ,
то из (19) получаем:
,
то из (19) получаем:
![]() (22)
(22)
VI. Приборы и принадлежности.
Для
выполнения работы используется:![]()
Барометр для измерения атмосферного давления
 и термометр для измерения температуры
воздуха T.
и термометр для измерения температуры
воздуха T.Весы для измерения массы
 откаченного из сосуда воздуха.
откаченного из сосуда воздуха.
3.Установка
для откачивания воздуха из сосуда и
измерения остаточного давления в нем![]() .
.
VII. Ход работы.
Провести необходимые измерения 5 раз и найти среднее значение молярной массы воздуха по формуле (21).
Рассчитать величину
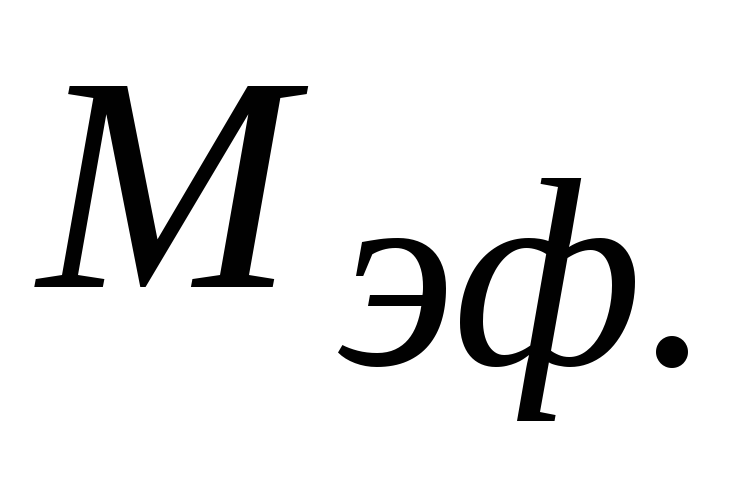 воздуха, считая его смесью газов.
Принять молярную концентрацию азота
в воздухе равной 78%, кислорода-21%,
аргона-1%, долей остальных газов
пренебречь. Сопоставить расчетное и
экспериментальное значение
воздуха, считая его смесью газов.
Принять молярную концентрацию азота
в воздухе равной 78%, кислорода-21%,
аргона-1%, долей остальных газов
пренебречь. Сопоставить расчетное и
экспериментальное значение

Используя найденные значения
 ,
рассчитать плотность воздуха в
лаборатории.
,
рассчитать плотность воздуха в
лаборатории.
VIII. Контрольные вопросы:
Вывести уравнение Клапейрона-Менделеева.
Что является основным достижением молекулярно-кинетической теории идеального газа? Физический смысл постоянной Больцмана? Газовые процессы.
Что такое молярная масса? Чему равен 1 моль газа? Как найти молярную массу смеси газов?
IX. Литература
Сивухин Д.В. Общий курс физики Т 2 . М: Наука,1979.
Матвеев А.Н. Молекулярная физика. М: Высшая школа, 1986.
Савельев И.В. Курс общей физики.Т2 Молекулярная физика. М: Наука 1982.
Стрелков С.П.Т2 Молекулярная физика. М: Наука 1975
Кикоин А.К., Кикоин И.К. Молекулярная физика. М: Наука. 1976.
СОДЕРЖАНИЕ
I.Основы молекулярно - кинетической теории газов………………..3
II.Температура……………………………………………………………...6
III.Уравнение состояния идеального газа………………………………9
IV. Смеси газов. Закон Дальтона………………………………………11
V. Методика определения молярной массы газа……………………13
VI. Приборы и принадлежности………………………………………...14
VII. Ход работы……………………………………………………………14.
VIII.Контрольные вопросы………………………………………………15
Литература………………………………………………………….15
Кандидат ф.м.наук., доцент
Семихина Людмила Петровна
Кандидат ф.м.наук., доцент
Ширшова Альбина Вольфовна
