
Лабораторная работа №1
Исследование электролиза воды – как разделяется вода?
При электролизе происходит переход электрической энергии внешнего источника тока в химическую энергию окислительно-восстановительных процессов. Этот процесс может произойти только в среде электролита: солевых растворах, кислотах, щелочах или в расплавах солей. Проводимость чистой воды очень мала и поэтому её электролиз невозможен при использовании обычных лабораторных приборов. В работе используется электролизер, где в качестве электролита используется специальная ионопроводящая полимерная мембрана. Получаемый на катоде водород используется далее для питания топливного элемента. Реакции на электродах будут проходить с участием мелкодисперсных частиц благородных металлов (катализаторов), облегчающих прохождение реакций.
Цель работы
Разобраться в сути процесса электролиза воды.
задание
Получить водород и кислород разложением воды в электролизере.
Установить объемное соотношение выделенных на электродах газов.
Провести химический анализ газов и сипользовать их в топливном элементе.
Ионы образуются, когда атомы отдают или присоединяют электроны.
Поток ионов при электролизе соответствует электрическому току.
Комплектующие, необходимые для проведения эксперимента:
Солнечный модуль
Электролизер
Топливный элемент
Измерительный модуль-нагрузка
4 кабеля
2 длинных газоподводящих шланга
2 коротких газоподводящих шланга
2 зажима на шланги
схема эксперимента
Дополнительные компоненты:
Лампа 100 – 150 Вт
Дистиллированная вода
2 маленьких химических стакана
2 деревянных зажима
горелка Бунзена
Указания по безопасности:
Во время экспериментов надевайте защитные очки и держите подальше источники возгорания! Солнечный модуль нагревается.
Методические указания
С помощью проведенного опыта на электролизере можно продемонстрировать разложение воды на 2 части водорода и 1 часть кислорода:
2H2O(l) → 2H2(г) + O2 (г)
В топливном элементе протекает обратная электролизу реакция, т.е. накопленные в результате электролиза газы снова превращаются в воду:
2H2(г) + O2(г) → 2H2O(ж)
ем самым подтверждается, что реакция обратима. При первой реакции (электролизе) электрическая энергия должна расходоваться, при второй реакции (в топливном элементе) электрическая энергия высвобождается. В общей сложности такой цикл связан с потерями. Преобразование энергии из одной формы в другую никогда не происходит со 100%-ным коэффициентом полезного действия. Но, тем не менее, топливный элемент в два раза эффективней двигателя внутреннего сгорания в автомобилях.
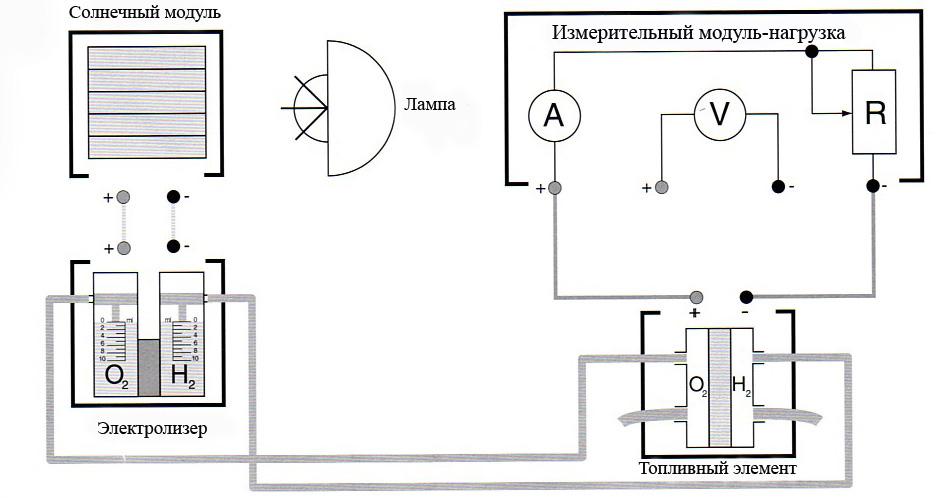
рис.
Порядок выполнения работы
1. Соберите схему согласно рис. Соблюдайте полярность на электролизере!
2. Проверьте, чтобы шланги подведения газа на электролизере и топливном элементе были надежно подключены.
Установите переключатель на измерительном модуле в положение «разомкнуто».
3. Проверьте, чтобы оба приемника газа электролизера были заполнены дистиллированной водой до отметки 0 мл. Установите с помощью освещенного солнечного модуля на электролизере постоянный ток в пределах 200 - 300 мA. Вы должны установить солнечный модуль в сторону лампы таким образом, чтобы можно было наблюдать в электролизере заметное выделение газа.
4. Пропустите через всю систему в течение 5 минут образовавшиеся газы. Установите переключатель измерительного модуля-потребителя на 3 минуты в положении 3 Ома. Измерьте с помощью амперметра ток. Установите переключатель модуля-потребителя в положение «разомкнуто».
5. Отключите солнечный модуль от электролизера. Закройте с помощью зажимов оба коротких шланга на выпускных отверстиях топливного элемента (см. рис 6).
6. Подключите солнечный модуль к электролизеру и накопите образующийся газ в электролизере. Отключите солнечный модуль от электролизера, когда количество водорода в электролизере достигнет отметки 10 мл. Одновременно определите объем произведенного кислорода.
7. Установите переключатель модуля-потребителя в положении 1 Ом. Потечет ток, топливный элемент потребляет накопленный водород.
8. Прервите электрическое соединение при достижении нулевой отметки на водородной стороне, установив при этом переключатель в положение «разомкнуто». Топливный элемент израсходовал весь водород (10 мл). Определите расход кислорода.
9. Снимите зажимы со шлангов топливного элемента.
10. Удалите длинные соединительные шланги между электролизером и топливным элементом, подключите короткие шланги к электролизеру и закройте их заглушками. Повторите п.6 и заполните резервуар водородом до отметки 10 мл.
11.Зажгите горелку Бунзена, причем она должна находиться на расстоянии не менее 1 метра от электролизера.
12. Держите маленький химический стакан открытой частью вниз, возьмите короткий шланг со стороны поступления водорода и откройте его. Опустите быстро и как можно глубже шланг в химический стакан. По окончании удалите шланг, возьмите деревянную палочку, зажженную предварительно от горелки Бунзена, и введите ее в стакан (лучше, если данный опыт проводят двое учащихся).
13. Оставьте шланг на электролизере со стороны поступления водорода открытым, а со стороны кислорода закрытым. Подайте ток на электролизер до тех пор, пока количество кислорода не достигнет отметки 10 мл.
14. Повторите п.12, но возьмите шланг со стороны поступления кислорода. Держите химический стакан вертикально и введите тлеющую (не горящую) деревянную палочку в стакан.
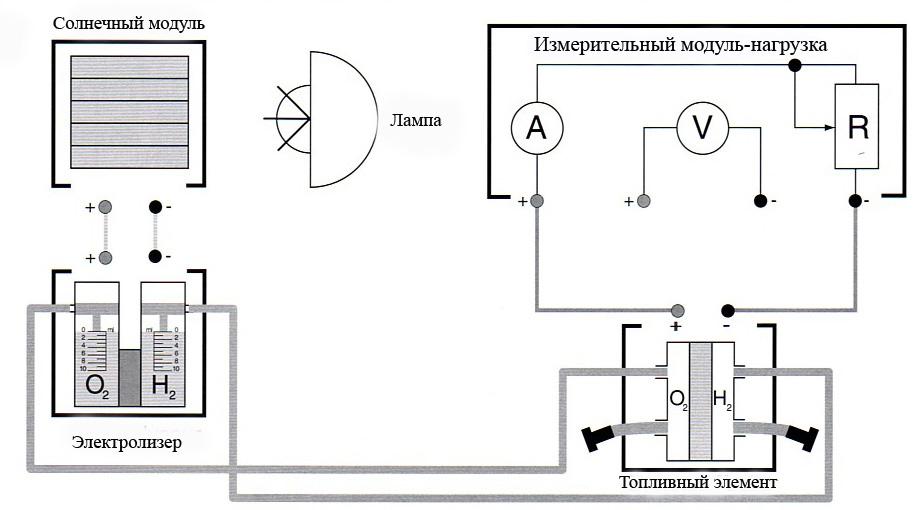
Рис
Таблица измерений
|
|
Разложение воды в электролизере |
Потребление в топливном элементе |
|
Объем водорода =
|
10см3 (=10 мл) |
Водород = см3 |
|
Объем кислорода =
|
см3 |
Кислород = см3 |
Подведение итогов
Определите действительные объемы газов
Определите соотношение выделенных при электролизе газов
Определите соотношение потребленных топливным элементом газов.
Объясните, как вы установили, какой газ на каком электроде выделился.
