
подгруппа марганца
.pdf
Элементы 7й группы
Подгруппа марганца
Лекция 10
Элементы 7 группы
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
|
|
|
|
|
|
|
|
|
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
|
|
|
|
|
|
|
|
|
|
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Ag |
Hg |
|
|
|
|
|
|
|
|
|
|
25Mn марганец |
43Tc технеций |
75Re рений |
Свойства элементов 7 группы
|
Электронная |
Радиус, |
I , эВ |
I , эВ |
χ (A-R) |
С.О. |
|
|
конфигурация |
пм |
1 |
2 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Mn |
[Ar]3d54s2 |
|
|
|
|
0, +2, |
|
130 |
7.44 |
15.64 |
1.60 |
+3, +4, |
|||
|
|
|
|
|
|
+5, +6, +7 |
|
Tc |
[Kr]4d55s2 |
136 |
7.28 |
15.26 |
1.36 |
0, +2, +3, |
|
+4, +6, +7 |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Re |
[Xe]4f145d56s2 |
|
|
|
|
0, +2, +3, |
|
137 |
7.88 |
16.71 |
1.46 |
+4, +5, |
|||
|
|
|
|
|
|
+6, +7 |
Стабильные изотопы: |
55Mn, 185Re (187Re: T ≈ 1014 |
лет) |
|
1/2 |
|
Свойства металлов 7 группы
|
Т.пл., оС |
Т.кип., оС d, г/см3 |
кристаллическая |
E0 (Mn+/M0), |
||
|
|
|
|
структура |
В |
|
Mn |
1245 |
2080 |
7.43 |
α-Mn |
–1.18 |
|
(n = 2) |
||||||
|
|
|
|
|
||
Tc |
2200 |
4600 |
11.49 |
ГПУ |
+0.4 |
|
(n = 2) |
||||||
|
|
|
|
|
||
Re |
3180 |
5900 |
21.03 |
ГПУ |
+0.3 |
|
(n = 3) |
||||||
|
|
|
|
|
||
α-Mn |
1000 К |
α-Mn |
|
|
|
|
β-Mn |
КПУ |
|
|
|
||
1352 К |
|
|
|
|||
γ-Mn |
КПУ/т |
|
α-Mn |
|||
|
|
|||||
1416 К |
|
|
||||
δ-Mn |
ОЦК |
|
|
|
||
|
|
|
|
|||

Свойства металлов 7 группы
1. Мn имеет высокую реакционную способность
Mn + 2HCl = MnCl2 + H2
2Mn + 2NH4Cl + 2H2O = 2MnCl2 + 2NH3·H2O + H2
2. Mn не реагирует с щелочами, пассивируется HNO3 (конц)
3. Mn реагирует со многими неметаллами
Mn + Cl2 = MnCl2 |
|
|
(200 oC) |
|||
3Mn + 2O = Mn O |
4 |
(600 oC) |
||||
|
|
2 |
3 |
|
|
|
3Mn + N |
2 |
= Mn N |
2 |
|
(1100 oC) |
|
|
3 |
|
|
|
||
4. Mn не реагирует с H2, не образует гидридов
Mn3O4
Свойства металлов 7 группы
5.Tc, Re не растворяются в кислотах и щелочах
6.Tc, Re растворяются в кислотах-окислителях и H2O2
3Re + 7HNO3 = HReO4 + 7NO2 + 3H2O 2Re + 7H2O2 (30%) = 2HReO4 + 6H2O
7. Tc, Re реагируют со многими неметаллами
4Re + 7O2 = 2Re2O7 2Re + 5Cl2 = 2ReCl5
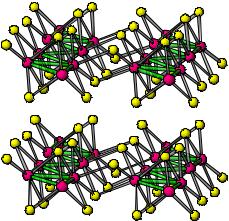
Re + S = ReS2
ReS2

Нахождение в природе
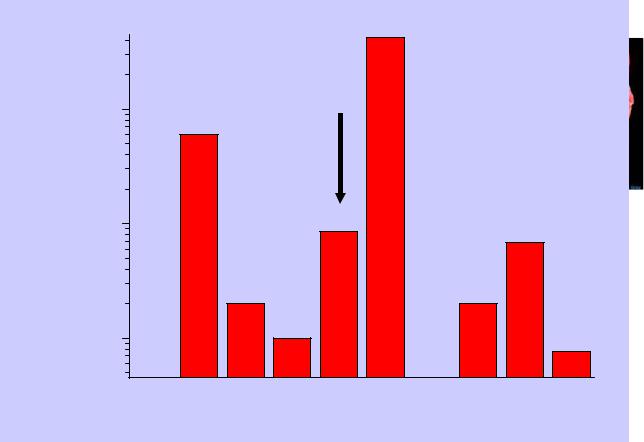
Марганец – распространенный элемент, основные минералы:
пиролюзит |
β-MnO2·nH2O |
|
родохрозит |
MnCO3 |
|
браунит |
Mn2O3 |
|
манганит |
Mn2O3·nH2O |
родохрозит |
гаусманит |
Mn3O4 |
|
Технеций – нет стабильных изотопов
Т1/2 (98Тс) = 4·106 лет
Рений – редкий и рассеянный элемент, извлекается из молибденовых или медных руд при содержании металла
> 0.2 %
|
Нахождение в природе |
|||||
Марганец – распространенный элемент, основные |
||||||
минералы: |
|
|
|
|
|
|
.% |
|
|
|
|
O), |
|
пиролюзит (β-MnO ·nH |
|
|||||
, |
|
1 |
2 |
2 |
|
|
родохрозит (MnCO3), |
|
|
|
|||
браунит (Mnкоремасс |
O ), |
|
|
|
|
|
2 |
3 |
|
|
|
|
|
манганит (Mn2O3·nH2O), |
родохрозит |
|||||
|
0,1 |
|
|
|
||
гаусманит (земнойMn3O4) |
|
|
|
|
||
в |
|
|
|
|
|
|
Технеций – нет стабильных изотопов |
|
|||||
|
0,01 |
Т |
(98Тс) = 4·106 лет |
|
||
Рений – редкийСодержание |
|
1/2 |
|
|
|
|
|
Sc Ti |
V Cr Mn Fe Co Ni |
Cu Zn |
|||
и рассеянный элемент, извлекается из |
||||||
молибденовых или медных руд при содержании металла |
||||||
|
|
|
|
|
> 0.2 % |
|
Получение металлов 7 группы
Основные процессы получения Mn:
MnO2 + Fe2O3 + 5C = Mn + 2Fe + 5CO
MnO2 = Mn3O4 + O2
3Mn3O4 + 8Al = 9Mn + 4Al2O3
2MnSO4 + 2H2O = 2H2SO4 + 2Mn + O2
(электролиз раствора)
Основные процессы получения Re:
Re2O7 + 2NH3 + H2O = 2NH4ReO4
2NH4ReO4 + 4H2 = 2Re + N2 + 8H2O
(ферромарганец)
(алюмотермия)
(1000 oC)

Применение металлов 7 группы
1.Mn – для инструментальных и конструкционных сталей высокой ударной стойкости
2.MnO2 – в электрохимических элементах
3.KMnO4 – промышленный окислитель
4. |
Mn2+ |
– микродобавки к удобрениям |
Ферромарганец с |
|
большим содержанием |
||||
|
|
|
||
5. |
99Tc – в медицине для диагностики |
Mn (12%) |
||
|
||||
6.Re – катализаторы в нефтехимической промышленности
7.Re – в электротехнике и измерительных приборах
