
- •1. Степени окисления элементов, их связь с положением элементов в Периодической системе. Классы неорганических соединений, номенклатура неорганических соединений.
- •2. Планетарная модель атома водорода Резерфорда; постулаты Бора.
- •3. Уравнение Де-Бройля, корпускулярно-волновые свойства микрообъектов (дуализм), принцип неопределенности Гейзенберга
- •4. Квантовые характеристики состояний электрона в атоме водорода (квантовые числа).
- •5. Электронное строение многоэлектронных атомов. Порядок заполнения орбиталей многоэлектронных атомов: принцип Паули, правило Хунда; s-, p-, d-элементы. Полные и неполные электронные аналоги.
- •6. Форма и пространственное расположение s-, p- и d- орбиталей в атоме.
- •7. Радиусы атомов, их изменение в периодах и группах Периодической системы. Зависимость кислотно-основных свойств соединения от радиуса центрального атома.
- •8.Энергия ионизации; сродство к электрону. Изменение в периодах и группах Периодической системы.
- •9. Электроотрицательность атомов элементов. Относительная электроотрицательность. Изменение в периодах и группах Периодической системы. Полярность химической связи,полярность молекул и ионов.
- •11. Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость (приведите примеры).
- •12. Понятие о гибридизации атомных орбиталей и его применение для описания конфигурации молекул и ионов. Приведите примеры соединений.
- •2 Вариант:
- •13. Теория отталкивания σ-связывающих и неподелённых электронных пар и её применение для описания геометрической конфигурации молекул и ионов.
- •14. Структура Периодической системы элементов: периоды, группы, подгруппы, вставные декады. Взаимосвязь между электронной структурой атомов элементов и их положением в Периодической системе.
- •Стандартная энергия Гиббса образования δGо298 некоторых веществ
- •22. Динамический характер химического равновесия. Расчет констант химического равновесия, исходные и равновесные концентрации
- •23. Смещение химического равновесия при изменении концентраций реагентов, давления, температуры. Принцип Ле-Шателье.
- •24. Растворы как гомогенные системы. Гидраты, сольваты. Ненасыщенные, насыщенные и пересыщенные растворы
- •25. Электролитическая диссоциация веществ в растворах. Кислоты, основания, амфотерные гидроксиды, соли. Сильные и слабые электролиты.
- •26. Роль молекул растворителя в процессах электролитической диссоциации. Аквакомплексы металлов, их кислотные свойства.
- •27. Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
- •28. Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель.
- •29. Основные положения теорий кислот и оснований Аррениуса и Бренстеда-Лоури. Зависимость кислотно-основных свойств соединений от степени окисления центрального иона.
- •30. Амфотерность гидроксидов с точки зрения теории электролитической диссоциации (приведите примеры).
- •31. Равновесия в насыщенных растворах малорастворимых солей. Расчёт растворимости малорастворимой соли. Способы увеличения растворимости малорастворимых солей.
- •32. Гидролиз солей, образованных: а) сильным основанием и слабой кислотой; б) слабым основанием и сильной кислотой. Качественная оценка рН растворов гидролизующихся солей.
- •35. Стандартный ( нормальный) окислительно-восстановительный потенциал, определение напрвления о.-в. Реакции
- •36.Реакции самоокисления - самовосстановления (диспропорционирования). Внутримолекулярные окислительно – восстановительные процессы.
- •37. Уравнение Нерста. Влияние кислотности раствора на величину окислительно - восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
- •38. Координационные соединения. Центральный атом и лиганды, внутренняя и внешняя сферы комплексных соединений, координационное число.
- •39. Строение координационных соединений , гибридизация орбиталей центрального атома.
- •40. Изомерия комплексных соединений.
- •41. Равновесия в растворах комплексных соединений.
11. Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость (приведите примеры).
Ковалентная связь — химическая связь, образованная перекрытием (обобществлением) парывалентныхэлектронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
12. Понятие о гибридизации атомных орбиталей и его применение для описания конфигурации молекул и ионов. Приведите примеры соединений.
Сущность
гибридизации атомных орбиталей состоит
в том, что электронмолекулы
вблизи выделенногибридная орбиталь
атомногибридная орбиталь ядра
характеризуется не отдельной атомной
орбиталью, а линейной комбинацией
атомных орбиталей с различным значениями
азимутальногибридная орбиталь и
магнитногибридная орбиталь квантовых
чисел. Такая линейная комбинация
называется гибридной (гибридизированной)
орбиталью. Как правило, гибридизация
затрагивает лишь высшие и близкие по
энергии занятые атомные орбитали
свободногибридная орбиталь атома.
Например, для атомов элементов
второгибридная орбиталь периода
периодической системы типичная форма
гибридной орбитали![]() -
линейная комбинация 2s-орбитали
-
линейная комбинация 2s-орбитали![]() и
2р-орбиталей
и
2р-орбиталей![]()
![]() ,
,![]()
![]() ,
,![]() с
численными коэффициентами.
с
численными коэффициентами.
Гибридные
орбитали обладают более низкой симметрией,
чем составляющие их атомные орбитали.
Так, распределение электронной плотности,
отвечающее указанной гибридной
орбитали ![]() ,
смещено отатомного
ядрав направлении векторап
с координатами
,
смещено отатомного
ядрав направлении векторап
с координатами ![]() ;
векторп является
осью симметрии гибридной орбитали (рис.
1). При изменении ориентации в пространстве
осей координат коэффициенты линейной
комбинации могут изменяться, однако
остается постоянным отношение сумм
квадратов коэффициентов для данного
значения азимутального квантового
числа. Это отношение определяет тип
гибридной орбитали.
;
векторп является
осью симметрии гибридной орбитали (рис.
1). При изменении ориентации в пространстве
осей координат коэффициенты линейной
комбинации могут изменяться, однако
остается постоянным отношение сумм
квадратов коэффициентов для данного
значения азимутального квантового
числа. Это отношение определяет тип
гибридной орбитали.
Например,
орбиталь ![]() относится
к типуsapb, где а и
b- числа,
подобранные так, чтобы
относится
к типуsapb, где а и
b- числа,
подобранные так, чтобы ![]() .
Обычно принимаюта
— 1, b =
1, 2 или 3.
.
Обычно принимаюта
— 1, b =
1, 2 или 3.
Как правило, гибридные орбитали данного атомавмолекуле относятся к одному типу, который называют типом гибридизации атома. Так, атом N в молекуле аммиака имеет гибридизацию атомных орбиталей типа sp3, атом С вмолекулеэтилена - sp2-гибридизацию, атом С в молекулеацетилена - sp-гибридизацию. Это дает основание отождествлять тип гибридизацииатомавмолекулес символом его некоей гипотетической электронной конфигурации.
Обычно система гибридных орбиталей строится таким образом, чтобы для разных орбиталей одногибридная орбитальатомаинтегралы перекрывания были равны нулю. Кроме того, каждая орбиталь вмолекулелибо остается негибридизированной атомной орбиталью, либо выбирается гибридизированной по определенному типу. Этим требованиям удовлетворяют несколько наборов орбиталей. Например, атом О вмолекулеН2О можно считать как sp2-, так и 5р3-гибридизированным.
Оси симметрии всех орбиталейобычно образуют симметричную фигуру (см. рис. 2). Операции симметрии этой фигуры переводят гибридные орбитали одногоатомадруг в друга. Такие гибридные орбитали называют эквивалентными. Например, линейная комбинация четырех валентных атомных орбиталейатомаС приводит к четырем 5р3-гибридным орбиталям, оси симметрии которых по отношению друг к другу расположены под углом 109,5°, т.е. направлены по углам тетраэдра (рис. 2, в).
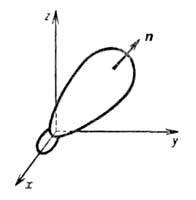 Рис.
1. Гибридная орбиталь, образованная из
2s- и 2р-атомных орбиталей; х, у, z- координатные
оси, п-ось симметрии.
Рис.
1. Гибридная орбиталь, образованная из
2s- и 2р-атомных орбиталей; х, у, z- координатные
оси, п-ось симметрии.
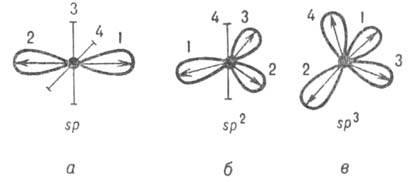 Рис.
2. Система гибридных орбиталей5р"-типа
(1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси
симметрии негибридизированных атомных
орбиталей изображены отрезками. Стрелками
указано направление смещения электронной
плотности.
Рис.
2. Система гибридных орбиталей5р"-типа
(1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси
симметрии негибридизированных атомных
орбиталей изображены отрезками. Стрелками
указано направление смещения электронной
плотности.
Представление о гибридизации атомных орбиталей используется для изучения закономерностей изменения электронной плотности молекулы вблизи какого-либо атомного ядрав зависимости от его окружения, то есть позволяет установить связь между электронным строением молекулы и ее структурой. При этом возможны различные подходы к анализу этой связи. Если известно геометрическое расположение атомных ядер, расчет волновой функции молекулы можно свести к изучению парных взаимодействий соседних атомов.
Отклонение конфигурации молекулы от симметричной связывают с взаимодействием химических связей (напр., с отталкиванием пар электронов, образующих связь). В такой форме представления о гибридизации атомных орбиталей используются в стереохимии.
Понятие о гибридизации атомных орбиталей введено в химию Л. Полингом в 1931.
