
- •6 Нуклеофильное замещение у насыщенного атома углерода
- •6.1 Кинетика
- •6.2 Стереохимия процесса (пространственный ход реакции)
- •6.3 Влияние структуры реагирующих соединений
- •6.3.1 Влияние структуры субстрата
- •6.3.2 Влияние уходящей группы
- •6.4 Влияние нуклеофила
- •6.4.1 Амбидентные нуклеофилы
- •6.5 Влияние растворителей
- •6.5.1 Межфазный катализ
6.2 Стереохимия процесса (пространственный ход реакции)
В случае оптически активных хиральных18субстратов в реакциях нуклеофильного замещения, как правило, происходит:
- в механизме SN1 утрата оптической активности и образование рацематов;
- в механизме SN2 сохранение оптической активности с обращением конфигурации.
В механизме SN1 атом углерода в исходном состоянии находится в тетраэдрическом состоянии sp3-гибридизации.
На первой стадии после отщепления уходящей группы (Х) образуется карбкатион, в котором центральный атом углерода находится в состоянии sp2-гибридизации. Все заместители (R, R’, R’’) при этом располагаются в одной плоскости (копланарно).
На второй стадии нуклеофильный реагент (Y) с равной вероятностью может атаковать эту плоскость с любой стороны. В результате чего образуется примерно равное количество продукта с сохраненной и обращенной конфигурациями (рацемат не обладающий оптической активностью).
На
рис.5 показана стереохимия реакций SN1.
+
Х – +


Y –
Y –

cохранение конфигурации
обращение конфигурации
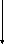

рацематная смесь


+
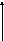

Рис.5 Стереохимия реакций SN1(рацемизация)
Исключением из данной схемы являются случаи стабилизации образующегося карбкатиона за счет участия соседних групп. Такое участие соседних групп называется анхимерным содействием (от греческих слов анхи – близкий и мерос – часть). В результате анхимерного содействия соседняя группа, имеющая неподеленную пару, взаимодействует с предполагаемым карбкатионным центром («выталкивает» уходящую группу). А нуклеофил может атаковать субстрат только со стороны уходящей группы. В результате анхимерного содействия, как правило, образуются продукты с сохранением конфигурации (см.рис.6).
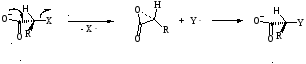
Рис.6
Схема анхимерного содействия
На рис.6 анхимерное содействия оказывает групп -СОО–. Другими группами способными к анхимерному содействию являются: -OCOR, -COOR, -COAr, -OR, -OH, -O–, -NH2, -NHR, -NHCOR, -SH, -S–, -I, Br, Cl.
В
механизме SN2
нуклеофил
из-за электростатических и пространственных
препятствий атакует центральный атом
углерода «с тыла» - со стороны
противоположной уходящей группе. В
переходном состоянии реагент Y,
центральный атом углерода C
и уходящая группа Х располагаются на
одной прямой, а заместители R,
R’
и R’’
лежат в одной плоскости. По мере того
как уходящая группа покидает переходное
состояние связи С–R
поворачиваются в ту же сторону, подобно
зонтику, выворачиваемому ветром. На
рисунке 7 показана стереохимия реакции
SN2.
Yδ– Xδ–
Y–


X –

Рис.7 Стереохимия реакций SN2 (обращение конфигурации)
В результате образуется оптически активный продукт с обращенной конфигурацией.
Исключением из этого правила является превращение спирта в алкилгалогенид под действием хлористого тионила. При этом, как правило, образуется продукт с сохранением конфигурации. Это объясняется тем, что реакция спирта с тионилхлоридом протекает через промежуточное образование хлорсульфита, который превращается в конечный продукт путем внутримолекулярного нуклеофильного замещения. Исходная конфигурация при этом сохраняется. На рисунке 8 показан механизм взаимодействие спирта с хлористым тионилом. Такой механизм получил обозначение SNi. (Substitution Nucleophilic internal – внутримолекулярное нуклеофильное замещение).
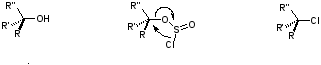
+ SOCl2
– HCl – SO2


Рис.8 Взаимодействие спирта с тионилхлоридом (сохранение кофигурации)
Таким образом, и в механизме SN2 для оптически активных субстратов возможно сохранение конфигурации.
