
Р Условия
проведения эксперимен-та: масса навески
NaNO3
– 5 г; время работы нагревателя – 3 мин; сопротивление
нагревателя –
6 Ом; сила тока – 1 а.
4. Все последующие измерения температуры проводить через каждые 30 с.
5. На пятой минуте (одиннадцатое измерение) включить нагреватель, на восьмой минуте выключить нагреватель, продолжая измерять температуру через 30 с.
6. На тринадцатой минуте быстро засыпать соль в воду через отверстие в калориметре и продолжить измерение температуры через интервалы времени 30 с до установления равномерного хода температуры во времени в течение 10 мин.
7. Полученные данные зависимости температуры от времени свести в таблицу 12, а затем построить график зависимости температуры от времени
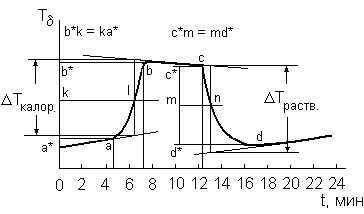
Т = f (t). Примерный вид этого графика показан на рис. 8.
8. Из полученного графика найти изменение температуры воды в калориметре Тк до начала процесса растворения соли.
9. По правому участку полученного графика найти изменение температуры воды в калориметре Тр в результате растворения соли.
Таблица 12.
|
№№ изм. |
t, мин |
T |
№№ изм.
|
t, мин |
T |
№№ изм. |
t, мин |
T |
|
1 |
0 |
0,58 |
13 |
6 |
0,72 |
25 |
12 |
1,03 |
|
2 |
0,5 |
0,58 |
14 |
6,5 |
0,8 |
26 |
12,5 |
1,03 |
|
3 |
1 |
0,58 |
15 |
7 |
0,87 |
всыпать соль в калориметр | ||
|
4 |
1,5 |
0,58 |
16 |
7,5 |
0,95 |
27 |
13 |
0,73 |
|
5 |
2 |
0,58 |
выключить Нагреватель |
28 |
13,5 |
0,68 | ||
|
6 |
2,5 |
0,58 |
17 |
8 |
1,01 |
29 |
14 |
0,65 |
|
7 |
3 |
0,58 |
18 |
8,5 |
1,02 |
30 |
14,5 |
0,62 |
|
8 |
3,5 |
0,58 |
19 |
9 |
1,03 |
31 |
15 |
0,59 |
|
9 |
4 |
0,58 |
20 |
9,5 |
1,03 |
32 |
15,5 |
0,56 |
|
10 |
4,5 |
0,58 |
21 |
10 |
1,03 |
33 |
16 |
0,54 |
|
включить Нагреватель |
22 |
10,5 |
1,03 |
34 |
16,5 |
0,52 | ||
|
11 |
5 |
0,6 |
23 |
11 |
1,03 |
35 |
17 |
0,50 |
|
12 |
5.5 |
0,64 |
24 |
11,5 |
1,03 |
36 |
17,5 |
0,49 |
|
№№ изм. |
t, мин |
T |
|
37 |
18 |
0,48 |
|
38 |
18,5 |
0,47 |
|
39 |
19 |
0,46 |
|
40 |
19,5 |
0,45 |
|
41 |
20 |
0,44 |
|
42 |
20,5 |
0,44 |
|
43 |
21 |
0,43 |
|
44 |
21,5 |
0,43 |
|
45 |
22 |
0,43 |
Определение теплоты нейтрализации.
Для определения теплоты нейтрализации используется 500 мл раствора гидроксида калия KОН и 10 мл серной кислотыH2SO4 с определенными концентрациями (см. п.7).
1. Раствор щелочи залить в калориметрический стакан, раствор кислоты в пробирку.
2. С помощью термометра Бекмана измерять изменение температуры в опыте каждые 30 с.
3. Провести калибровку калориметра, как было показано выше.
4. На тринадцатой минуте в объем раствора щелочи влить серную кислоту из пробирки.
5. Полученные данные свести в таблицу (см. табл.13.) и построить график зависимости Т =f(t). Примерный вид его показан на рис.9.
6. Определить ТкиТнейтр.
7. Условия проведения эксперимента: 10 мл 2н. раствора Н2SO4, 500 мл 0,2 % раствора КОН, время работы нагревателяt= 3 мин, сопротивление спирали нагревателяR= 6 Ом, сила токаI= 1 А.
Таблица 13.
|
№№ изм. |
t, мин |
T |
№№ изм.
|
t, мин |
T |
№№ изм. |
t, мин |
T |
|
1 |
0 |
2,23 |
13 |
6 |
2,32 |
25 |
12 |
2,56 |
|
2 |
0,5 |
2,23 |
14 |
6,5 |
2,38 |
26 |
12,5 |
2,55 |
|
3 |
1 |
2,23 |
15 |
7 |
2,45 |
влить кислоту в калориметр | ||
|
4 |
1,5 |
2,22 |
16 |
7,5 |
2,52 |
27 |
13 |
3,09 |
|
5 |
2 |
2,21 |
выключить Нагреватель |
28 |
13,5 |
3,1 | ||
|
6 |
2,5 |
2,21 |
17 |
8 |
2,58 |
29 |
14 |
3,09 |
|
7 |
3 |
2,2 |
18 |
8,5 |
2,59 |
30 |
14,5 |
3,08 |
|
8 |
3,5 |
2,2 |
19 |
9 |
2,58 |
31 |
15 |
3,08 |
|
9 |
4 |
2,19 |
20 |
9,5 |
2,58 |
32 |
15,5 |
3,07 |
|
10 |
4,5 |
2,19 |
21 |
10 |
2,57 |
33 |
16 |
3,07 |
|
включить нагреватель |
22 |
10,5 |
2,57 |
34 |
16,5 |
3,06 | ||
|
11 |
5 |
2,2 |
23 |
11 |
2,57 |
35 |
17 |
3,04 |
|
12 |
5.5 |
2,25 |
24 |
11,5 |
2,56 |
36 |
17,5 |
3,04 |
|
№№ изм. |
t, мин |
T |
|
37 |
18 |
3,04 |
|
38 |
18,5 |
3,03 |
|
39 |
19 |
3,03 |
|
40 |
19,5 |
3,02 |
|
41 |
20 |
3,01 |
|
42 |
20,5 |
3,01 |
|
43 |
21 |
3 |
|
44 |
21,5 |
3 |
|
45 |
22 |
3 |
|
46 |
22,5 |
3 |
Р ис.9.
Примерный график при реакции нейтрализации.
ис.9.
Примерный график при реакции нейтрализации.
Обработка результатов.
1. Провести калибровку калориметра по теплоте, выделяемой при пропускании тока по спирали нагревателя.
Изменение температуры Тксвязано с теплотойQ=I2 ·R·t, выделяемой в системе при прохождении электрического тока по спирали нагревателя, известным соотношением:Q= Ср ·m·Тк , или, вводя константу для данного калориметра Ск,
Ск= Ср·m=Q/Тк. (22)
Для нахождения величины Ткиз графика необходимо (см. рис.8 и 9.):
- продолжить участки равномерного хода температуры до включения и после выключения нагревателя;
- посередине периода изменения температуры провести вертикаль до пересечения с линиями продолжения участков равномерного хода;
- спроектировать точки пересечения вертикали с этими линиями на ось ординат, полученный отрезок соответствует изменению температуры в калориметрическом опыте с учетом поправки на теплообмен.
2. Определив Тк, рассчитать постоянную калориметра, наполненного водой, Скпо уравнению:
I2 ·R·t
Ск=, Дж/К, (23)
Тк
где I - сила тока в цепи, A;R - сопротивление спирали нагревателя, Ом;t- время нагрева, с.
По своему физическому смыслу, Скпредставляет собой количество теплоты необходимое для нагревания жидкости и всех частей калориметра, участвующих в теплообмене, на один градус.
3. Из графика, соответствующего процессу растворения соли, найти Трастваналогично тому, как это указано в п.1 для нахожденияТк.
4. Рассчитать тепловой эффект растворения соли по уравнению:
Ск·Траств·М
Нраств=, Дж/моль, (24)
m
где m масса растворяемой соли, г; М – мольная масса соли, г/моль.
5. Провести расчет теоретического теплового эффекта реакции растворения соли по энтальпиям образования гидратированных ионов (см. табл.10.). Поскольку в ходе этой реакции теплота поглощается, то следует принять положительный знак энтальпии Нраств .
6. Полученную экспериментально энтальпию растворения сравнить с полученным теоретическим значением, вычислить погрешность измерений.
7. Записать уравнение реакции растворения в ионной форме.
8. Из графика, соответствующего изменению температуры щелочи в калориметре, найти Т к'.
9. Рассчитать постоянную калориметра со щелочью С 'кпо уравнению:
I2 ·R·t
С 'к=, Дж/К. (25)
Т к'
10. Найти Тнейтризменение температуры раствора в процессе нейтрализации.
11. Теплота нейтрализации, соответствующая образованию моля воды из гидратированных ионов водорода и гидроксида, рассчитывается по уравнению:
Ск Тнейтр
Ннейтр.=, Дж/моль, (26)
2Vкисл сконц
где Vкисл – объем кислоты, л; сконц– концентрация кислоты, моль/л. Поскольку в ходе этой реакции теплота выделяется, то следует принять отрицательный знак энтальпииНнейтр .
12. Сравнить теплоту нейтрализации реакции, полученной экспериментально, с теоретическим значением, рассчитанным по уравнению (22), найти погрешность.
13. Записать уравнение реакции нейтрализации в ионной форме.
