
6M
.pdf
Из рисунка видно, что адиабата идет круче, чем изотерма.
При помощи адиабатического процесса с той или иной степенью приближения можно рассматривать широкий круг практических задач.
Ких числу относятся следующие задачи:
–нахождение скорости распространения звука в газах;
–течение газа по входным устройствам компрессоров, турбинах и соплах реактивных двигателей и т. д.
В табл. 1.1 приведены сводные данные о характеристиках изопроцессов в газах.
Таблица 1.1
Сводные данные о характеристиках изопроцессов в газах
|
Условия |
Связь |
|
|
|
|
|
|
Кол-во |
|
|
|
|
|
|
|
|
|
|
|
проте- |
между |
|
|
|
|
|
|
Изменение |
|
|
|
|
|
|
|
|
||
Название |
Работа в |
теплоты, |
Теплоем- |
||||||||||||||||
кания |
парамет- |
внутренней |
|||||||||||||||||
процесса |
процессе |
сообщенное |
кость |
||||||||||||||||
про- |
рами в |
энергии |
|||||||||||||||||
|
|
|
|
|
|
|
в процессе |
|
|
|
|
|
|
|
|
||||
|
цесса |
процессе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Изохори- |
|
P/T= |
|
dA=0; |
|
|
dQ=CvdT; |
dU=dQ; |
|
m |
R |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
ческий |
V = const |
|
|
|
Cv |
1 |
|
||||||||||||
=const |
|
|
A=0 |
|
|
Q=Cv(T2 – T1) |
U =Q |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зобари- |
|
V/T= |
|
dA=pdV; |
dQ=CpdT; |
dU=CVdT; |
Cp |
m |
R |
||||||||||
ческий |
р = const |
|
Q=Cp(T2 – T1) |
||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||
=const |
A=p(V2 – v1) |
U=CV(T2 –T1) |
|
|
|
1 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изотер- |
|
|
|
dA=pdV; |
|
|
|
|
|
|
|
|
|
|
|||||
мический |
|
|
|
dQ=dA; |
dU=0; |
|
|
|
|
|
|
|
|
||||||
Т = const |
pV=const |
|
|
m |
|
V2 |
CТ= |
|
|
|
|||||||||
A |
|
RT ln |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
Q=A |
U=0 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Адиаба- |
|
pV = |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тический |
|
=const. |
dA=pdV=-dU; |
|
dU=-dA= |
|
|
|
|
|
|
|
|
||||||
|
|
pT / -1= |
dQ=0; |
=CvdT; |
|
|
|
|
|
|
|
|
|||||||
|
dQ = 0 |
|
A=- U= |
САД=0 |
|||||||||||||||
|
=const. |
|
Q=0 |
U=-A= |
|||||||||||||||
|
|
=Cv(T1 – T2) |
|
|
|
|
|
|
|
|
|||||||||
|
|
VT1/ -1= |
|
=CV(T2 –T1) |
|
|
|
|
|
|
|
|
|||||||
|
|
=const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. МЕТОД РАБОТЫ
2.1. Лабораторная установка
Экспериментальная установка (рис. 2.1) состоит из стеклянного баллона достаточно большой емкости, соединенного с жидкостным U-об- разным манометром. Верхняя часть баллона закрыта пробкой и снабжена краном, с помощью которого баллон сообщается с атмосферой и источником давления (в данном случае микрокомпрессором).
11

атмосфера
к микро-ком- прессору
h
Рис. 2.1. Общий вид установки для определения величины отношения 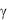 =СP/CV
=СP/CV
2.2. Метод измерения
Пусть в баллоне первоначально было атмосферное давление Pа. Если быстро повысить давление в баллоне и закрыть кран, то окончательная разность уровней в манометре h1 установится не сразу (при быстром сжатии температура газа в баллоне повысится и пройдет некоторое время, пока температура воздуха в баллоне не сравняется, за счет теплопроводности, с температурой окружающего воздуха).
При всех дальнейших наблюдениях надо мысленно выделить в сосуде некоторую массу воздуха объемом V и рассматривать изменения, происходящие только с этим количеством воздуха.
Предположим, что происходящие с газом изменения изображены на графике, выражающем зависимость P от V (рис. 2.2).
1 P1, V1, To
P
 3 P2, V2, To
3 P2, V2, To
2 Pа, V2, T2
 V
V
Рис. 2.2. К выводу расчетной формулы для определения отношения СP/CV
Обозначим температуру окружающего воздуха То, а через Р1 – давление газа внутри баллона.
12

Это давление равно сумме атмосферного (барометрического) давления Ра и давления, определяемого по манометру Р’, т. е. Р1 = Ра + Р’.
Состояние газа характеризуемого параметрами Р1, То, V1, назовем первым состоянием газа.
Если теперь быстро открыть кран, то воздух будет адиабатически расширяться, в результате чего давление внутри баллона достигнет атмосферного Ра; выделенная нами масса газа займет новый объем V2, а температура станет ниже комнатной, т. е. газ охладится до температуры Т2.
Новое состояние газа на рис. 2.2 отмечено точкой 2 с параметрами Ро, Т2, V2. Если после открывания крана и выравнивания давления его снова закрыть, то воздух в баллоне, охладившийся при адиабатическом расширении, вновь нагреется до температуры окружающей среды То. Поскольку при этом нагревании объем воздуха V2 не изменяется, то давление в баллоне несколько повысится и станет равным Р2. О повышении давления воздуха в баллоне можно судить по повышению жидкости в левом колене манометра. Разность уровней при этом станет h2.
Новое состояние на графике изображается точкой 3 с параметрами Р2, То, V2. Таким образом, из состояния 1 в состояние 3 газ пришел, пройдя состояние 2 (сплошная линия). Из состояния 1 в состояние 3 газ мог прийти в результате изотермического расширения, так как в обоих состояниях температура газа одинакова (пунктирная линия).
Итак, мы имеем три состояния газа, которые характеризуются следующими параметрами:
1 состояние – То, Ра + Р’, V1; 2 состояние – Ра, Т2, V2; 3 состояние – То,
Ра + Р’’, V2.
Рассматривая газ как идеальный, с помощью уравнений адиабатического (1.20) и изохорического процессов запишем выражения, связывающие параметры газов в трех состояниях.
Адиабатический процесс (переход из состояния 1 в состояние 2):
|
1 |
|
|
|
|
|
P P' |
|
|
T |
|
||
|
|
|
||||
a |
|
2 |
. |
(2.1) |
||
|
|
|||||
Pa |
|
|
To |
|
||
Изохорический процесс (переход из состояния 2 в состояние 3):
Pa |
|
T2 |
. |
(2.2) |
|
|
|||
Pa P' ' |
To |
|
||
Разделив уравнение (2.1) на (2.2), после преобразований получим
|
|
|
|
1 |
|
||
|
P' ' |
|
P' |
|
|
|
|
1 |
1 |
1. |
|||||
Pa |
Pa |
||||||
|
|
|
|
|
|||
13

Прологарифмируем это выражение:
ln 1 |
P' ' 1 |
|
|
ln 1 |
P ' |
0 . |
|
|
(2.3) |
||||
|
|
|
|
|
|
|
|||||||
Pa |
|
|
Pa |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Так как по условию проведения опытов |
P' |
1 |
и |
P' ' |
, то можно |
||||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
Pa |
|
Pa |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
упростить выражение (2.3). |
|
|
|
|
|
|
|
|
|
|
|
|
|
Учитывая, что ln(1+x) x, при x <<1 |
|
|
|
|
|
||||||||
|
P' |
1 |
|
P' |
0 |
|
|
|
(2.4) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Pa |
|
|
|
Pa |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||
Выразив из уравнения (2.4), получим формулу |
|
|
|
||||||||||
|
|
|
|
|
|
P' |
|
|
|
|
|
||
|
|
|
|
|
|
. |
|
|
|
|
|
||
|
|
|
|
P' |
P' ' |
|
|
|
|
|
|||
Так как P’ соответствует установившемуся показанию манометра в состоянии 1 и измеряется высотой столба жидкости h1, а P’’ соответствуют показанию манометра в состоянии 3 и измеряется высотой h2, то расчетная формула данного метода будет иметь вид
h1 |
(2.5) |
|
h1 h2 |
||
|
3.ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1.Убедиться, что уровни жидкости в обоих коленах манометра установлены на одной высоте.
2.Микропроцессором накачать в баллон некоторое количество воздуха. Когда разность уровней в манометре достигнет 150…200 мм, закрыть кран и выключить компрессор.
3.Выждать 3–5 мин, пока не прекратится изменение уровней жидкости в манометре, и отсчитать разность уровней в манометре h1.
4.Открыть кран и снова быстро закрыть его в тот момент, когда уровни жидкости в манометре будут одинаковыми. После этого уровни жидкости начнут изменяться.
5.Выждать 2–3 мин, пока установятся уровни жидкости в манометре,
иотсчитать их разность h2. Опыт повторить не менее 8–10 раз. Результаты измерений записать в табл. 3.1.
 и
и  – среднее значение показателя адиабаты и абсолютной по-
– среднее значение показателя адиабаты и абсолютной по-
грешности.
Полученные значения следует обрабатывать как результаты прямых измерений, так как косвенные измерения проводятся в невоспроизводимых условиях. В данном случае в разных опытах были разные значения
14

h1 и h2. Кроме того, невозможно в каждом опыте одинаково быстро открывать и закрывать кран и т. д. Поэтому для каждого измерения найди-
те свое значение , а затем рассчитайте  и
и  (табл. 3.1).
(табл. 3.1).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3.1 |
|||||
|
|
|
Результаты измерений |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
h1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
2 |
|
|||||
№ |
h1 |
h2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|||||
п/п |
мм |
мм |
|
h1 |
h2 |
|
|
|
|
|
|
i 1 |
|
|
i |
i |
|
|
|
|
|
i 1 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n n 1 |
||||||||||||
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Окончательный результат запишите в виде |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
6. Полученное из результатов опытов значение |
, следует сравнить с |
|||||||||||||||||||||||||
числовым значением его, которое рассчитайте по формуле (1.18). При вычислении  считать воздух двухатомным газом.
считать воздух двухатомным газом.
4.ЗАДАНИЕ ПО УИРС
1.Используя данные работы, определить работу, совершенную газом за цикл, изображенный на рис. 2.2. Необходимые указания получить у преподавателя.
2.Оценить изменение температуры при адиабатическом расширении
вданной работе.
5.КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Запишите уравнение состояния идеального газа. Каков физический смысл универсальной газовой постоянной?
2.Сформулируйте и запишите первое начало термодинамики. Запишите уравнение изопроцессов и примените к ним первое начало термодинамики.
3.Что называется удельной и молярной теплоемкостью газа? Как выражаются теплоемкости газов при постоянном объеме и постоянном давлении. Почему Сp всегда больше?
4.Выведите соотношение, связывающее Сp и Cv (уравнение Майера).
5.Какой процесс называется адиабатическим и как записывается уравнение адиабаты в переменных P-V и P-T?
6.Почему при адиабатическом сжатии газ нагревается, а при расширении охлаждается?
15
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Савельев, И.В. Курс общей физики / И.В. Савельев. – М. : Наука, 1990, Т.1.
2.Яворский, Б.М. Курс физики / Б.М. Яворский [и др.]. – М. : Высшая школа, 1978, Т.1.
3.Трофимова, Т.И. Курс физики / Т.И. Трофимова. – М. : Высшая школа.1997.
|
ОГЛАВЛЕНИЕ |
|
ВВЕДЕНИЕ ................................................................................................... |
3 |
|
1. |
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ....................................................................... |
4 |
|
1.1. Основные положения термодинамики ............................................. |
4 |
|
1.2. Теплоёмкость газов........................................................................... |
5 |
|
1.3. Адиабатный процесс ......................................................................... |
9 |
2. |
Метод работы......................................................................................... |
11 |
|
2.1. Лабораторная установка................................................................. |
11 |
|
2.2. Метод измерения ............................................................................ |
12 |
3. |
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ .................................................... |
14 |
4. ЗАДАНИЕ ПО УИРС............................................................................... |
15 |
|
5. |
КОНТРОЛЬНЫЕ ВОПРОСЫ.................................................................. |
15 |
БИБЛИОГРАФИЧЕСКИЙ СПИСОК ........................................................... |
16 |
|
Учебное издание
Антонычева Елена Альбертовна Рекунова Наталья Николаевна
ИЗУЧЕНИЕ НЕКОТОРЫХ ТЕРМОДИНАМИЧЕСКИХ СОСТОЯНИЙ ГАЗА
Методические указания на выполнение лабораторной работы
Отпечатано методом прямого репродуцирования
————————————————————————————
План 2013 г. Поз. 9.33. Подписано в печать 28.06.2013. Уч.-изд. л. 1,0. Усл. печ. л. 0,93. Зак. 233. Тираж 75 экз. Цена 48 руб.
————————————————————————————
Издательство ДВГУПС 680021, г. Хабаровск, ул. Серышева, 47.
16

Е.А. Антонычева, Н.Н. Рекунова
ИЗУЧЕНИЕ НЕКОТОРЫХ ТЕРМОДИНАМИЧЕСКИХ СОСТОЯНИЙ ГАЗА
Методические указания
Хабаровск
2013
17
