
6M
.pdfМинистерство транспорта Российской Федерации Федеральное агентство железнодорожного транспорта
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Дальневосточный государственный университет путей сообщения»
Кафедра «Физика»
Е.А. Антонычева, Н.Н. Рекунова
ИЗУЧЕНИЕ НЕКОТОРЫХ ТЕРМОДИНАМИЧЕСКИХ СОСТОЯНИЙ ГАЗА
Методические указания на выполнение лабораторной работы
Хабаровск Издательство ДВГУПС
2013
УДК 536.7(075.8) ББК В 317.1я73
А 725
Рецензент:
Профессор кафедры «Физика» Дальневосточного государственного университета путей сообщения
А.В.Сюй
Антонычева Е.А.
Изучение некоторых термодинамических состояний газа. Ме-
А725 тодические указания на выполнение лабораторной работы. – Хабаровск : Изд-во ДВГУПС, 2013. – 16 с. : ил.
Методические указания составлены в соответствии с учебной программой дисциплины «Физика».
Даны законы термодинамики и их применение к изопроцессам, понятия удельной и молярной теплоемкостей и связь между ними, адиабатный процесс. Содержат описание рабочей установки и метода лабораторного исследования. В заключительной части предусмотрено дополнительное задание для студентов, которые успешно справляются с основной задачей. Для защиты лабораторной работы по разделу «Основы термодинамики». приведены контрольные вопросы.
Указания предназначены для студентов первого курса всех технических специальностей дневной и заочной форм обучения.
УДК 536.7(075.8) ББК В 317.1
© ДВГУПС, 2013
2
ВВЕДЕНИЕ
Метод молекулярно-кинетической теории является одним из способов изучения свойств вещества в газообразном, жидком и твердом состояниях, а также взаимных переходов из одного состояния в другое. Этот метод, применяемый для объяснения макроскопических свойств тел с точки зрения их молекулярного строения, есть по существу статистический.
Однако возможен и другой способ описания явлений, без детального рассмотрения тех микроскопических процессов, которые при этом происходят. Такое описание можно сделать, исходя из понятий об энергии, ее превращениях и способах передачи.
Метод, рассматривающий процессы с энергетической точки зрения, называется термодинамическим. С его помощью можно изучать свойства идеального и реального газов, упругость и сжимаемость, адсорбцию и диффузию, поведение вещества под действием давления и температуры, испарение и конденсацию, плавление, кристаллизацию и другие явления. С помощью термодинамического метода решается множество вопросов в учении об электричестве, магнетизме, излучении и т. п. Он, кроме физики и химии, используется в ряде технических наук.
Среди многочисленных разделов современной физики термодинамика занимает особое положение. Это связано с тем, что любая форма энергии при ее изменениях в конце концов переходит в теплоту. В теплоту переходит механическая энергия, энергия электрического тока, энергия света, энергия химической реакции и т. д.
Наибольший практический интерес представляет превращение механической энергии в теплоту и обратный процесс получения механической работы за счет теплоты.
При выполнении лабораторной работы студент изучает некоторые термодинамические состояния газа.
В рассматриваемой лабораторной работе даются основные положения термодинамики, подробно рассматривается теплоемкость газов при различных условиях, применяется первое начало термодинамики к различным изопроцессам, и изучается адиабатный процесс. Конечной целью работы является определение показателя адиабаты.
3
ЦЕЛЬ РАБОТЫ
Определить отношение удельных теплоемкостей воздуха при постоянном давлении и постоянном объеме.
Приборы и принадлежности: стеклянный баллон с краном; жидкостный манометр; микрокомпрессор.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1. Основные положения термодинамики
Термодинамикой называется раздел физики, в котором изучаются условия превращения энергии из одного вида в другой, и качественные соотношения при таких превращениях. В основе термодинамики лежат экспериментально установленные законы (начала) термодинамики. С помощью этих законов можно, не принимая во внимание молекулярное строение веществ, получить много сведений о свойствах тел и закономерностях процессов, происходящих с телами в различных условиях. Для описания состояния термодинамической системы вводятся физические величины, называемые термодинамическими параметрами или параметрами состояния системы. Основными параметрами состояния системы являются: давление Р, удельный объем Vуд, занимаемый единицей массы вещества, и температура Т.
Для однородного тела удельный объем равен отношению его объема к массе:
Vуд= V/m.
Два состояния системы считаются различными, если для них неодинаковы значения хотя бы одного из термодинамических параметров.
Состояние системы называется стационарным, если оно не изменяется со временем. Это означает, что ни один из термодинамических параметров, определяющих состояние, не изменяется с течением времени.
Равновесное состояние устанавливается в системе при постоянных внешних условиях и сохраняется в системе произвольно долго. Во всех частях системы, находящейся в состоянии термодинамического равновесия, температура одинакова. Температура равновесной системы является мерой интенсивности теплового движения ее молекул, то есть средней кинетической энергии.
Между тремя параметрами состояния системы существует связь, называемая уравнением состояния. Оно записывается в форме функциональной зависимости давления в системе от объема и температуры.
P = f(V, T). |
(1.1) |
4

Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют малые собственные объемы. У реальных газов молекулы испытывают силы межмолекулярного взаимодействия притяжения и отталкивания. Уравнение состояния идеального газа для произвольной массы имеет вид:
pV |
m |
RT , |
(1.2) |
|
|||
|
μ |
|
|
где p, V и T – давление, объем и абсолютная температура газа; R – универсальная газовая постоянная, численно равная работе, совершенной одним молем идеального газа при изобарном повышении температуры на один градус:
R |
p V2 |
V1 |
, |
(1.3) |
|
T |
|||
|
|
|
|
|
где V2 и V1 – конечный и |
начальный объем моля газа |
R = |
||
= 8,31 Дж/моль К = 8,31 103 Дж/кмоль К. |
|
|
||
Другой вид уравнения состояния идеального газа |
|
|||
|
p = nkT, |
|
(1.4) |
|
где n – концентрация молекул газа, то есть число молекул в единице объема газа; k – постоянная Больцмана, k = 1, 38 10-23 Дж/К.
1.2. Теплоёмкость газов
Одной из важнейших физических характеристик газов является теплоемкость. Различают удельную и молярную теплоемкость.
Удельной теплоемкостью газов с называется величина, численно равная количеству теплоты, которое необходимо сообщить единице массы газа, чтобы увеличить его температуру на один градус.
Молярной (мольной) теплоемкостью С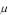 называется величина, численно равная количеству теплоты, которое необходимо сообщить одному молю газа, чтобы увеличить его температуру на один градус:
называется величина, численно равная количеству теплоты, которое необходимо сообщить одному молю газа, чтобы увеличить его температуру на один градус:
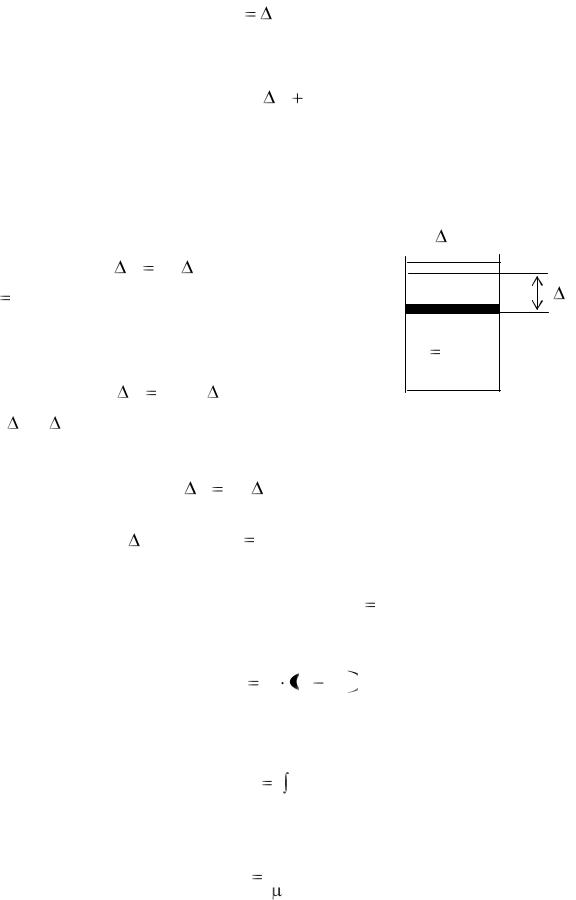
C c , |
(1.5) |
где – молярная масса газа.
Удельная и молярная теплоемкости газа зависят от условий, при которых проводится нагревание, то есть от характера термодинамического процесса. Например, можно проводить нагревание при постоянном объеме или при постоянном давлении. Тогда получим соответственно теплоемкость при постоянном объеме Сv или при постоянном давлении Сp. При этом всегда Сp > Сv.
5

Эта зависимость теплоемкости газов от условий нагревания может быть выяснена при использовании уравнения состояния идеального газа и первого начала термодинамики.
Внутренняя энергия может изменяться при осуществлении различных процессов:
1)в результате совершения над телом работы A' ;
2)при сообщении системе количества тепла Q .
Работа A' совершается в результате воздействия на систему внеш-
них сил. Работа A, совершаемая самой системой, равна A  A' . Сообщение газу тепла связано с изменением внутренней энергии
A' . Сообщение газу тепла связано с изменением внутренней энергии
системы. Микроскопические процессы, приводящие к передаче энергии от тела к телу, носят название теплопередачи. Количество энергии, переданной одним телом другому путем теплопередачи, определяется количеством тепла Q , отданного одним телом другому. Таким образом, приращение внутренней энергии системы должно быть равно сумме совершенной над системой работы и количества сообщенной системе тепла:
U U2 U1 Q A' ,
где U1 и U2 – начальное и конечное значение внутренней энергии системы. Подставим A вместо A' , выразим Q , получим
Q U2 U1 A, Q U A . |
(1.6) |
Уравнение (1.18) выражает закон сохранения энергии и представляет содержание первого закона (начала) термодинамики: количество тепла, сообщенное системе, идет на совершение системой работы над внешними телами и изменение внутренней энергии этой системы.
При сообщении тепла внутренняя энергия системы не обязательно возрастает. Если внутренняя энергия системы убывает (U2 U1.), то
A Q , т. е. система совершает работу за счет получаемого тепла Q и убыли внутренней энергии. Если Q 0, то система не получает тепло, а отдает.
Если система остается при постоянной температуре внутренняя энергия системы не изменяется: U2 U1, U 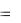
A Q .
В этом случае количество теплоты, сообщенное системе, идет на совершение системой работы.
При нагревании системы при постоянном объеме система не совершает работы над внешними телами, следовательно, согласно первому началу термодинамики, все тепло идет на приращение внутренней энергии тела:
6
Q U . |
(1.8) |
При нагревании системы при постоянном давлении газ будет расширяться, совершая над внешними телами положительную работу:
Q  U A .
U A .
Молекулы при движении передают друг другу импульс, что сопровождается изменением объема газа.
Заключим газ в сосуд, закрытый плотно пригнанным легко скользящим поршнем (рис. 1.1). Если газ будет расширяться, то он будет перемещать поршень совершать над ним работу. Элементарная работа, совершаемая газом при перемещении поршня на отрезок h равна:
A F  h ,
h ,
где F P 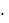 S - сила, с которой газ действует на поршень; P – давление, производимое газом на поршень; S – площадь поршня.
S - сила, с которой газ действует на поршень; P – давление, производимое газом на поршень; S – площадь поршня.
Заменив выражение силы, получим:
A P  S
S 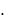 h ,
h ,
где S 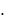 h
h 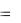 V – приращение объема газа. Поэтому элементарную работу можно записать в виде:
V – приращение объема газа. Поэтому элементарную работу можно записать в виде:
A P  V
V
h
P const
Рис. 1.1. Работа газа при изобарном процессе
(1.9)
Величина работы является алгебраической. При сжатии газа направления перемещения h и силы F P  S , действующие на поршень, противоположны, вследствие чего работа отрицательна; при расширении газа работа положительна.
S , действующие на поршень, противоположны, вследствие чего работа отрицательна; при расширении газа работа положительна.
Если давление газа остается постоянным P const , то должна изменяться температура газа, а работа, совершаемая газом при изменении объема от значения V1 до значения V2 , будет равна:
A12 P V1 V2 . |
(1.10) |
Если при изменении объема давление изменяется, то работа вычисляется путем интегрирования:
V2 |
|
A12 PdV . |
(1.11) |
V1 |
|
Изменение внутренней энергии идеального газа равно:
dU |
m i |
RdT |
(1.12) |
|||
|
|
2 |
||||
|
|
|
||||
7

где i – число степеней свободы молекулы газа, то есть наименьшее число координат, которое необходимо задать, чтобы определить положение молекулы в пространстве.
Элементарная работа
dA = pdV. |
(1.13) |
По определению теплоемкость равна
C |
dQ . |
(1.14) |
|
dT |
|
Разделив выражение на dT, получим
C |
dQ |
|
dU |
|
dA |
. |
(1.15) |
|
|
|
|
||||
|
dT |
|
dT |
|
dT |
|
|
Если при изменении температуры объем газа не меняется (V = const), процесс называется изохорическим: V = const, dV = 0, dA =
= pdV = 0.
Все подводимое к газу тепло идет на увеличение его внутренней энергии. Тогда из уравнения (1.15) следует, что молярная теплоемкость при постоянном объеме газа равна:
dU
Cv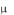 dT . (1.16)
dT . (1.16)
Процесс, протекающий при постоянном давлении (р = const) назы-
вается изобарическим. В этом случае уравнение (1.15) будет иметь вид:
Cp |
dU |
p |
dV |
. |
(1.17) |
|
|
||||
|
dT |
|
dT |
|
|
Из уравнения состояния для одного моля газа pV |
RT , получаем |
||||
pdV Vdp RdT .
Но р = const, dp = 0, следовательно,
pdV RdT .
Подставив это выражение в (1.17), получим
dU
Cp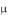 dT R ,
dT R ,
но dU Cv , следовательно, dT
Cp Cv R |
(1.18) |
Формула (1.18) носит название уравнения Майера. Смысл уравнения Майера заключается в том, что при изобарическом нагревании газа на один градус к газу должно быть подведено большее количество тепло-
8

ты, чем для такого же изохорического нагревания. Разность количеств теплот должна быть равна работе совершаемой газом при изобарическом расширении.
Теплоемкость вещества (при Т = const) в изотермическом процессе из определения, равна бесконечности, так как dT 0 , а dQ 0, то С = . При изотермическом процессе первое начало термодинамики имеет вид
dQ dA. |
(1.19) |
так как при Т = const, dT = 0 и dU = 0, U = const. С точки зрения производства работы газом, этот изопроцесс наивыгоднейший. Работа совершаемая газом при Т = const:
v2 |
m |
v2 dV m |
|
V |
|
|
|||
Q A pdV |
|
RT |
|
|
|
RT ln |
2 |
, |
(1.20) |
|
V |
V1 |
|||||||
v1 |
|
v1 |
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
|
где m/ – количество молей газа, содержащихся в массе m; Т – постоянная температура газа, V1 и V2 – начальный и конечный объем газа.
Из молекулярно-кинетической теории следует, что Сp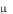 и Сv
и Сv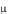 зависят от числа степеней свободы i молекул, из которых состоит газ:
зависят от числа степеней свободы i молекул, из которых состоит газ:
Cp |
i 2 |
R . |
(1.21) |
||
2 |
|
||||
|
|
|
|
||
C |
|
i |
R . |
(1.22) |
|
|
|
||||
v |
2 |
|
|
|
|
|
|
|
|
||
Молекула одноатомного газа имеет три степени свободы (i = 3), жесткая молекула двухатомного газа – пять (i = 5), трехатомного и многоатомного – шесть (i = 6). Отсюда следует, что молекулярная теплоемкость целиком определяется природой газа. Отношение теплоемкости газа Сp к Сv называется показателем адиабаты.
Для идеального газа
Cp |
|
i 2 |
. |
(1.23) |
Cv |
|
i |
||
|
|
|
Величина 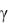 играет очень большую роль в проведении термодинамических и газодинамических расчетов, в особенности таких, которые связаны с адиабатическими процессами.
играет очень большую роль в проведении термодинамических и газодинамических расчетов, в особенности таких, которые связаны с адиабатическими процессами.
1.3. Адиабатный процесс
Если быстро сжимать газ или предоставить ему возможность быстро расширяться, причем изменение объема газа осуществлять без теплообмена с окружающей его средой, то такой процесс изменения состоя-
ния газа называется адиабатическим (адиабата).
9
При адиабатическом сжатии изменяется не только объем и давление газа, как при изотермическом процессе, но также изменяется и температура. Это изменение температуры газа происходит вследствие того, что за счет работы, затрачиваемой на сжатие газа, увеличивается его внутренняя энергия. Следовательно, уменьшение объема газа при адиабатическом сжатии должно повлечь за собой большее, чем при изотермическом сжатии, увеличение давления.
Примером адиабатного процесса может служить весьма быстрое расширение в атмосферу газа, помещенного в теплоизолированный сосуд, при быстром открывании крана. Адиабатный процесс должен происходить на столько быстро, чтобы не успел произойти теплообмен газа с атмосферы при открывании крана.
Согласно первому началу термодинамики, теплота сообщаемая расходуется на увеличение ее внутренней энергии и на совершение системой работы против внешних сил, то есть
dQ = dU +dA.
При адиабатическом процессе dQ = 0, следовательно, dA = -dU, то есть работа, совершаемая газом при расширении, осуществляется за счет уменьшения внутренней энергии вещества.
Адиабатический процесс подчиняется закону Пуассона
pV |
const . |
(1.24) |
|
1 |
|
|
|
|
|
const . |
(1.25) |
Tp |
|||
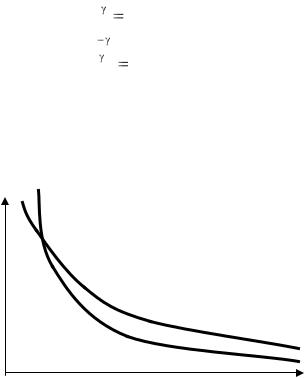
На рис. 1.2, на P – V диаграмме, сплошной линией изображена кривая, описывающая адиабатическое сжатие. На этом же рисунке пунктиром показана изотерма, соответствующая температуре газа в начальном состоянии.
P
V
Рис. 1.2. Сравнение графиков изотермического и адиабатического процессов
10
