
2. Синтез та властивості 3-гетарил(арил)ізокумаринів
Сплавленням ГФК з 4-кратним надлишком відповідних хлорангідридів при 200оС були отримані 3-гетарилізокумарини 9 (цей метод синтезу 3-заміщених ізокумаринів дозволяє використання лише таких хлорангідридів, що стійкі за даної температури). Підтвердженням будови отриманих сполук є наявність у спектрах 1Н ЯМР сигналів 4-ого протону ізокумаринової системи – синглету при 7-7.5 м.ч., – та 8-ого протону – дублету, що знаходиться у слабкому полі (8.1-8.2 м.ч.) завдяки дезекрануючому впливу сусідньої карбонільної групи.
 Вихід
ізокумарину з фурановим замісником у
цій реакції близько 50%, а вихід сполук
з тіофеновим та піридиновим залишками
значно менший (10-25%). Підвищення температури
реакції з метою поліпшення виходу
піридилізокумаринів не привело до
бажаного результату; але внаслідок
сплавлення ГФК з тієнілкарбонілхлоридом
при 220оС
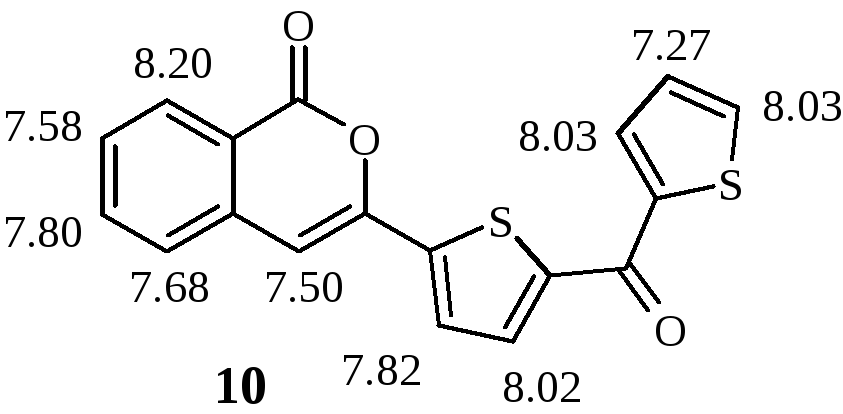
була отримана сполука, спектри ЯМР якої
не відповідали очікуваному
3-(2-тієніл)ізокумарину. У спектрі 1Н
ЯМР порівняно зі спектром
3-(2-тієніл)ізокумарину спостерігаємо
сигнали 2-ох додаткових протонів. У
спектрі 13С
ЯМР присутні сигнали 2-ох карбонів
карбонільної групи (178 та 161 м.ч.). Це дає
можливість запропонувати для синтезованої
сполуки формулу 10 (вказано хімічні зсуви
протонів, м.ч., віднесення сигналів
протонів здійснено за допомогою
двовимірних спектрів COSY). Таким чином,
при 220оС
відбувається ацилювання тієнільного
фрагменту у складі тієнілізокумарину
надлишком хлорангідриду тіофенкарбонової
кислоти.
Вихід
ізокумарину з фурановим замісником у
цій реакції близько 50%, а вихід сполук
з тіофеновим та піридиновим залишками
значно менший (10-25%). Підвищення температури
реакції з метою поліпшення виходу
піридилізокумаринів не привело до
бажаного результату; але внаслідок
сплавлення ГФК з тієнілкарбонілхлоридом
при 220оС
була отримана сполука, спектри ЯМР якої
не відповідали очікуваному
3-(2-тієніл)ізокумарину. У спектрі 1Н
ЯМР порівняно зі спектром
3-(2-тієніл)ізокумарину спостерігаємо
сигнали 2-ох додаткових протонів. У
спектрі 13С
ЯМР присутні сигнали 2-ох карбонів
карбонільної групи (178 та 161 м.ч.). Це дає
можливість запропонувати для синтезованої
сполуки формулу 10 (вказано хімічні зсуви
протонів, м.ч., віднесення сигналів
протонів здійснено за допомогою
двовимірних спектрів COSY). Таким чином,
при 220оС
відбувається ацилювання тієнільного
фрагменту у складі тієнілізокумарину
надлишком хлорангідриду тіофенкарбонової
кислоти.
В літературному огляді наведена реакція ГФК з фталевим ангідридом при 200-220оС в присутності каталітичних кількостей ацетату натрію. За цією реакцією нами був синтезований 7-нітро-3-(2-карбоксифеніл)ізокумарин 11.
Порівняно з незаміщеною ГФК, реакція між нітрогомофталевою кислотою та фталевим ангідридом відбувається при нижчій темпетатурі, а вміст спіросполуки 12, встановлений за аналізом 1Н ЯМР спектрів суміші продуктів реакції, – вищий. На основі речовин з карбоксильною групою – 3-(2-карбоксифеніл)ізокумарину та 11 синтезовані похідні – естери та аміди.
Оскільки застосування високотемпературної конденсації ГФК з хлорангідридами карбонових кислот обмежується стійкістю та активністю хлорангідридів (наприклад, хлорангідриди піридинкарбонових кислот в умовах реакції знаходяться у формі неактивних гідрохлоридів), ряд 3-гетарил(арил)ізокумаринів був синтезований шляхом конденсації ангідриду ГФК з хлорангідридами гетероароматичних кислот в присутності основи.
Як правило, під час синтезу ізокумаринів за даною методикою проміжні сполуки – 4-ацилгомофталеві ангідриди - не можуть бути вилучені. Але при взаємодії у вказаних умовах гомофталевого ангідриду та хлорангідриду 2-нітро-4-хлорбензойної кислоти утворюється 4-(2-нітро-4-хлорбензоїл)-3-гідроксиізокумарин 13 (енольна форма підтверджується відсутністю в спектрі сигналу протону у 4-ому положенні), який вдалося перевести у відповідний 3-арилізокумарин 14 лише обробкою лугом та наступним замиканням дезоксибензоїнкарбонової кислоти в кислому середовищі:
Піридилізокумарини при високотемпературній конденсації з ГФК були отримані з низьким виходом (близько 10%). Спроба синтезувати їх на основі ангідриду ГФК також виявилась невдалою, тому для одержання таких сполук нами був запропонований новий метод, а саме конденсація хлорангідридів з моноетиловим естером ГФК в присутності основи. В результаті конденсації отримані 4-карбетокси-3-піридилізокумарини 15, що шляхом кислого гідролізу та декарбоксилювання перетворені на 3-піридилізокумарини. Застосувавши наведену послідовність реакцій, вдалося значно збільшити вихід таких сполук. Також був отриманий 4-карбетокси-3-(2-бромфурил-5)ізокумарин. Оскільки гідроліз останнього як у кислому, так і в лужному середовищі протікає повільно, відповідний 3-(2-бромфурил-5)ізокумарин доцільніше синтезувати виходячи з гомофталевого ангідриду, як це наведено вище.
Побічний процес в процесі синтезу 3-гетарил-4-карбетоксиізокумаринів – внутрішньомолекулярна циклізація моноестеру з утворенням 3-етоксиізокумарину.
Утворення 3-арил-4-карбетоксиізокумаринів також відбувається і при взаємодії моноетилового естеру 7-нітрогомофталевої кислоти з хлорангідридами ароматичних кислот. Оскільки синтетичні можливості нітрогомофталевої кислоти досить обмежені через розклад при нагріванні та при дії кислот чи основ, то використання моноестеру нітрогомофталевої кислоти дає можливість синтезу 3-арилізокумаринів 16 з нітро-групою у 7-ому положенні ізокумарину. Але за наявності двох замісників біля реакційного центру арилкарбонілхлориду, практично повністю відбувається циклізація моноестеру нітрогомофталевої кислоти з утворенням 3-етокси-7-нітроізокумарину 17. Реакція моноестеру гомофталевої кислоти з просторово утрудненими хлорангідридами ароматичних кислот також зводиться до його циклізації в 3-етоксиізокумарин.
У лужному середовищі відбувається розкриття циклу 3-заміщених ізокумаринів з утворенням 2-(2-оксо-2-R-етил)бензойних кислот 18, розчинних у лузі. Зворотня циклізація 2-(2-оксо-2-піридилетил)бензойних кислот (на відміну від сполук з арильними та тіофеновими замісниками), відбувається швидко, що, очевидно, пояснюється їх розчинністю завдяки основності піридинового циклу у кислому середовищі; тому відкриті форми піридилізокумаринів не були вилучені. 3-(2-Фураніл)ізокумарин під дією лугів розкладається.
Особливості хімічної поведінки ізокумаринів, а саме можливість заміни циклічного Оксигену на Нітроген, дають можливість здійснити одностадійний перехід від оксигенвмісної системи ізокумарину до нітрогенвмісної системи ізохінолону і, таким чином, отримати аналоги алкалоїдів. 3-Гетарилізокумарини при нагріванні у спиртовому розчині аміаку при підвищенному тиску перетворювалися на відповідні ізокарбостирили (1,2-дигідро-1-ізохінолони) 19. Взаємодія ізокумаринів з метиламіном проходить важче: в аналогічних умовах реакції виділяли суміш ізокарбостирилу та продуктів конденсації відкритої форми ізокумарину з метиламіном, і лише подальше нагрівання цієї суміші в оцтовій кислоті давало чистий цільовий продукт 20. Синтезовані 3-гетарил-N-метилізокарбостирили із замісниками 2-тіофеніл та 3-піридил; 3-(2-фураніл)ізокумарин в умовах реакції розкладається.
В ІЧ спектрах отриманих ізокарбостирилів частота поглинання карбонільної групи менша (1640-1670 см-1), ніж у спектрах вихідних ізокумаринів (1740 см-1).
Методики відновлення нітрогрупи, застосовані до 3-арил- та 3-гетарилкумаринів, були випробувані на ізокумаринах з нітрогрупою. Встановлено, що під дією дітіоніту натрію відбувається відновлення до аміногрупи нітрогрупи, як в 7-ому положенні ізокумаринового циклу, так і у арильному заміснику в 3-ому положенні, також синтезовано похідні за аміно-групою – ацетаміди.
