
Основний зміст роботи
1. 3-Гетарил(арил)кумарини та їх похідні: синтез і властивості
Кумарини 1 з різними гетероциклічними замісниками у 3-ому положенні, а також 3-(4-нітрофеніл)кумарини, були синтезовані конденсацією заміщених саліцилових альдегідів з гетарилацетонітрилами (а також 4-нітрофенілацетонітрилом) в присутності основи у спиртовому розчині. Гідроліз іміногрупи у 2-імінокумаринах здійснений у кислому середовищі.
Швидкість гідролізу 2-імінокумаринів 2 залежить в більшій мірі від замісника у бензольному кільці кумаринового ядра, ніж від замісника у 3-ому положенні. Швидко гідролізує іміногрупа у сполуках з електроноакцепторним замісником, наприклад, 6-NO2 та 6-Cl - 0,5-2 год, дещо повільніше - 6-Br (4-6 год), а у випадку 7-ОН групи гідроліз відбувається досить повільно, так, для 7-гідрокси-3-(4-(3,4-метилендіоксифеніл)тіазол-2-іл)кумарину – за 96 год. Останній приклад демонструє також те, як на процес гідролізу впливає розчинність імінокумарину: в той час, як сполуки з піридиновим чи хіноліновим фрагментом мають помітну розчинність, особливо при нагріванні, у кислому водному чи у водно-спиртовому розчині, 3-(4-фенілтіазол-2-іл)кумарини у воді практично не розчиняються.
Будова одержаних 3-заміщених кумаринів доведена за допомогою спектроскопії 1Н ЯМР. Характеристичним є сигнал 4-Н – синглет у слабкому полі – 8.75-9.0 м.ч. для кумаринів з піридиновим замісником, 8.9-9.05 м.ч. для хінолілкумаринів, при 8.35-8.7 м.ч. знаходиться сигнал 4-Н кумаринів з фрагментом фурану, при 8.8-8.95 та 8.95-9.3 м.ч. 4-Н метил- та фенілтіазолілкумаринів відповідно, 8.4-8.8 м.ч. – тріазолілкумаринів, а 4-Н 3-(4-нітрофеніл)кумаринів спостерігаємо при 8.3-8.6 м.ч.
Для 3-(2-піридил)кумаринів можливі дві планарні конформації, в яких реалізується спряження між ядром піридину та кумариновою системою, I и II:
![]()
Конформація I, менш вигідна, ніж II, у зв’язку з відштовхуванням двох електрононадлишкових атомів – атому Оксигену карбонільної групи кумарину й атому Нітрогену піридинового циклу. Аргументом на користь конформації ІІ є також значна різниця в хімічних зсувах у спектрах 1Н ЯМР в-протонів піридинового залишку: завдяки дезекрануючому впливу Оксигену карбонільної групи кумарину сигнал протону 3’-Н піридину знаходиться в більш слабкому полі, ніж 5’-Н (8.3-8.45 та 7.2-7.6 м.ч. відповідно); в той час як для структури I, а також для структури, в якій кумаринова та піридинова системи не знаходяться в одній площині, значення хімічних зсувів 3’-Н и 5’-Н було б практично ідентичним. У конформації ІІ дезекрануючого впливу атому Нітрогену гетероциклічного замісника (і це стосується не лише кумаринів з піридиновим замісником, але й хіноліл- та тіазолілкумаринів) зазнає також сигнал 4-Н кумаринового циклу: порівняно зі сполуками з фурановим і фенільним замісником він знаходиться у більш слабкому полі – 8.75-9.3 м.ч. та 8.3-8.7 м.ч. відповідно.
Подальша модифікація кумаринів проводилась на основі сполук з активною 7-ОН-групою.
Введеня в молекулу кумарину угрупувань різної природи (шляхом алкілювання чи ацилювання гідроксигрупи й амінометилювання активного до електрофільної атаки 8-ого положення 7-гідроксикумарину) дає можливість створювати субстанції, що значно відрізняються за властивостями від вихідних сполук. Так, присутність у молекулі великого алкільного замісника підвищує її ліпофільність і, таким чином ефективність використання сполуки в біологічних дослідженнях, в цьому аспекті також корисним є введення фармакофорних залишків – метокси- та ацилоксигруп. Амінометильна група сприяє кращій розчинності молекули, порівняно з вихідною сполукою, а також приводить до сильного поглиблення кольору. Як це буде описано далі, саме амінометильні похідні кумаринів в УФ-спектрі поглинання мають досить інтенсивний максимум у видимій ділянці спектру.
Дія алкілгалогенідів (та диметилсульфату) на 7-гідроксикумарини в присутності поташу у абсолютному ацетоні чи ДМФА зводиться до алкілювання групи 7-ОН. Таким чином отримані 7-алкоксикумарини 3. Швидкість та ефективність реакції алкілювання мало залежить від замісника Het у 3-ому положенні кумарину і цілком корелюється з активністю алкілюючого агенту.
7-Ацилоксикумарини 4 були отримані взаємодією відповідних 7-гідроксикумаринів з хлорангідридами карбонових кислот у піридині. Ацилювання 7-ОН-групи у складі 7-гідроксифенілтріазолілкумарину потребує подвійного надлишку ацилюючого реагенту та більш сильної основи – триетиламіну. Реакція ацилювання 7-ОН-групи у складі 3-заміщених кумаринів проходить з високим виходом; дещо менший, порівняно з іншими ацилпохідними, вихід 7-півалоїлоксикумаринів, - через великий об’єм замісника при карбонільній групі і пов’язані з цим просторові перешкоди.
Для електронодефіцитного піронового циклу реакції електрофільного заміщення не характерні, але наявність 7-гідроксигрупи активує восьме положення (і в меншій мірі шосте) для електрофільної атаки, що було продемонстровано у реакції амінометилювання (реакція Манніха). У випадку кумаринів з нітрогенвмісним гетероциклом провести реакцію амінометилювання у класичних умовах (кип’ятіння реагенту з вторинним аміном та формальдегідом у солянокислому середовищі) неможливо через протонуванння атому нітрогену гетероциклу, адже у цьому випадку реагент буде виведений зі сфери реакції (випаде в осад у вигляді гідрохлориду). Крім того, в таких умовах відбувається протонування піронового ядра, що значно знижує його здатність до електрофільної атаки. Тому кумаринові основи Манніха 5 були синтезовані з 7-гідроксикумаринів дією аміналів формальдегіду у діоксані.
Амінометилювання 3-гетарилкумаринів завершується за 1.5-3 год у випадку сполук з тіазольним залишком, а для піридил- та хінолілкумаринів час проходження реакції дещо більший (до 6 год), а вихід менший. На перебіг цієї реакції впливають і стеричні фактори: застосування просторово утруднених амінів помітно зменшує вихід.
Сигнали протонів Н-6 та Н-5 у спектрі 1Н ЯМР мають вигляд двох дублетів при – 7.4-7.8 та 6.6-6.8 м.ч. з 3J=8.5, також у спектрах присутній двопротонний синглет при 4.0-4.25 м.ч. метиленової групи у 8-ому положенні.
3-Гетарилкумарини та 4-нітрофенілкумарини – важкорозчинні навіть у сильних органічних розчинниках (ДМФА, ДМСО) сполуки, особливо це стосується 3-(4-фенілтіазол-2-іл)кумаринів з нітрогрупою, як в кумариновому ядрі, так і в фенільному залишку. Але для 4-фенілкумаринів та 3-(4-фенілтіазол-2-іл)кумаринів з амінофункцією можна очікувати значно вищу розчинність, ніж для їх нітроаналогів, на основі таких речовин можуть бути синтезовані різноманітні похідні по аміногрупі, крім того, висока розчинність сполук значно полегшує їх застосування в біологічних дослідженнях.
Як свідчать літературні дані, NO2-група в кумаринах може бути відновлена без руйнування піронового циклу, щоправда ці відомості стосуються сполук простої будови. Тому була здійснена спроба відновити нітрогрупу у складі 3-(4-(3-нітрофеніл)тіазол-2-іл)кумаринів 6 та 4-нітрофенілкумаринів 7:

Було випробувано два методи відновлення: залізом в оцтовій кислоті (А) та дітіонітом натрію у водно-спиртовому середовищі (Б).
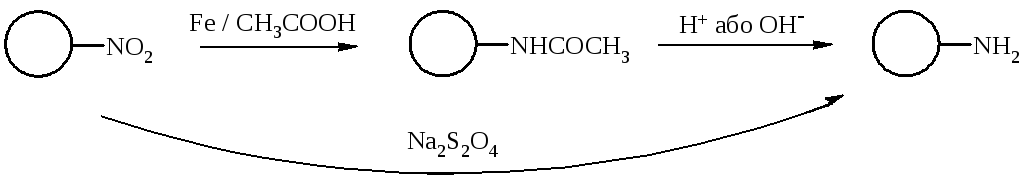
При відновленні за методом А утворюються речовини, аміногрупа в яких ацильована залишком оцтової кислоти. Для одержання сполук з вільними аміногрупами був проведений гідроліз, як у лужному, так і в кислому середовищі; останній спосіб оптимальний для речовин з двома активними групами в молекулі (дві аміно- чи аміно- та гідроксигрупа).
При вивченні межі застосовності вказаних методів відновлення встановлено, що відновлення 3-(4-фенілтіазол-2-іл)кумаринів з високим виходом та таке, що приводить до досить чистих речовин, відбувається лише за методом А, ймовірно через низьку розчинність вихідних нітрокумаринів у водно-спиртовому середовищі, а в оцтовій кислоті їх розчинність достатня для ефективного перебігу реакції. Відновлення ж нітрогрупи в складі 3-(4-нітрофеніл)кумаринів може відбуватися як за методом А, так і за методом Б, хоча 6-нітро-3-(4-нітрофеніл)кумарин утворює неідентифіковану суміш речовин при спробі відновити її за методом Б.
При порівнянні активності аміногрупи в отриманих сполуках у реакціях ацилювання встановлено, що час проходження реакції значно менший для 3-(4-(3-амінофеніл)тіазол-2-іл)кумаринів, ніж для 3-(4-амінофеніл)кумаринів, адже в останніх активність аміногрупи у фенільному фрагменті знижена через вплив електроноакцепторного замісника – кумаринового ядра – у пара-положенні по відношенню до аміногрупи.
На прикладі 3-(2-піридил)кумаринів вивчалась залежність між характером замісників у бензольному кільці кумарину і УФ- та ІЧ-спектрами сполук. У спектрі 3-(2-піридил)кумарину лише один максимум поглинання: лmax=332 нм (e=15800). УФ-спектри поглинання інших піридилкумаринів мають 2-3 максимуми, довгохвильовий максимум знаходиться в області 310-365 нм (e=15000-27000) (за виключенням 7-гідрокси-8-(азепанометил)-3-(2-піридил)кумарину, для якого лmax=400 нм), та залежить від електронної природи замісника у кумариновому ядрі. Наприклад, довгохвильовий максимум поглинання 7-гідрокси-3-(2-піридил)кумарину спостерігаємо при 357 нм (e=19300), а у спектрі 6,8-дихлорпіридилкумарину - 310 нм.
В ІЧ-спектрі 3-(2-піридил)кумарину полоса поглинання карбонільної групи знаходиться при 1723 см-1. Наявність електронодонорних замісників, особливо у 7-ому положенні, збільшує спряження карбонільної групи з бензольним кільцем кумарину і, відповідно, зменшує частоту коливання (до 1700 см-1 для 7-гідрокси-3-(2-піридил)кумарину, 7,8-дигідрокси-3-(2-піридил)кумарину), а у сполук з електроноакцепторними замісниками частота групи С=О, відповідно, більше (1748 см-1 для 6,8-дихлор-3-(2-піридил)кумарину).
Дослідження спектрально-люмінесцентних та генераційних властивостей раніше синтезованих 3-(2-бензтіазоліл)кумаринів показало, що максимум поглинання та флуоресценції залежить від того, в якій протолітичній формі знаходиться молекула: порівняно з нейтральною формою 7-гідрокси-3-(2-бензтіазоліл)кумарину (довгохвильовий максимум флуоренценції – 475 нм) флуоресценція його протонованої за нітрогеном бензтіазолу форми, а також, в більшій мірі, його аніону спостерігається у більш довгохвильовій області – 485 та 505 нм відповідно. Генераційні властивості 7-гідрокси-3-(2-бензтіазоліл)кумарину також поліпшуються при переході до його аніонної форми: від 3 до 25% (XeCl-лазер). Дослідження зміщення максимумів флуоресценції 8-(диізобутиламінометил)-7-гідрокси-3-(2-бензтіазоліл)кумарину в залежності від рН розчину дозволило встановити, що в нейтральному середовищі ця сполука знаходиться переважно у цвіттер-іонній формі. 8-Гідрокси-3-(2-бензтіазоліл)кумарин поглинає у більш короткохвильовій області, ніж його 7-гідроксиізомер, - 365 та 397 нм відповідно, - оскільки гідроксигрупа у 8-ому положенні не спряжена з кумариновою системою. Відсутність флуоресценції у 8-гідрокси-3-(2-бензтіазоліл)кумарину пояснюється дисипацією енергії збудження переважно через триплетні стани.
 При
вивченні флуоресцентних властивостей
деяких тіазолілкумаринів спостерігалося
значне зниження квантового виходу
флуоресценції для сполуки 8 при переході
від неполярного розчинника (толуол,
квантовий вихід 0,42) до полярного (ДМСО,
квантовий вихід 0,01) через зміну геометрії
молекули у збудженому стані в ДМСО, а
саме вихід об’ємного
При
вивченні флуоресцентних властивостей
деяких тіазолілкумаринів спостерігалося
значне зниження квантового виходу
флуоресценції для сполуки 8 при переході
від неполярного розчинника (толуол,
квантовий вихід 0,42) до полярного (ДМСО,
квантовий вихід 0,01) через зміну геометрії
молекули у збудженому стані в ДМСО, а
саме вихід об’ємного
гетероциклічного замісника з площини кумаринового кільця.
Дослідження впливу синтезованих 3-гетарилкумаринів на процес зсідання крові виявили як речовини з антикоагулянтною дією, так і гемостатики; деякі з них мають вищу активність, ніж препарати порівняння – гепарин і амінокапронова кислота:
|
Доза 0,25 мг/мл Препарат порівняння: гепарин, час зсідання крові - 514 с |
Доза 0,25 мг/мл Препарат порівняння: амінокапронова кислота, час зсідання крові - 118 с |
||
|
Сполука |
Час зсідання крові, с |
Сполука |
Час зсідання крові, с |
|
|
374 |
|
155 |
|
|
309 |
|
63 |
|
|
975 |
|
72 |
|
|
343 |
|
|







