
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Сложные вещества, полученные взаимодействием соединений первого порядка, но не путем простого замещения в
- •Координационная теория Вернера
- •Виды комплексов
- •Внутренняя сфера состоит из центрального атома (комплексообразователя), а вокруг него находятся (координируются) лиганды.
- •Характеристики центрального атома: 1)степень окисления (заряд атома)
- •2) Координационное число (КЧ) - количество химических связей, которые комплексообразователь образует с лигандами.
- •Координационное число зависит от природы, степени окисления комплексообразователя, природы лиганда и условий реакции.
- •Лиганды не связаны друг с другом, и между ними действуют силы отталкивания.
- •3) По координационной емкости
- •Лиганды, способные образовывать две и более связи называются полидентантными.
- •Номенклатура комплексных соединений
- •Комплексные соединения с комплексным анионом.
- •Комплексные соединения с комплексным катионом.
- •Нейтральные комплексы
- •Строение комплексных соединений
- •Устойчивость комплексных соединений
- •Диссоциация имеет два этапа:
- •Процесс комплексообразования завершается, когда у комплексообразователя исчерпаны все валентные возможности.
- •Процесс диссоциации характеризуется величиной константой нестойкости.
- •Примеры образования и разрушения комплексов
- •3) Реакция:
- •Теория валентных связей
- •Гибридизация орбиталей и структура комплексов
- •Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, то комплекс парамагнитен и называется
- •Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный
- •Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный
- •Теория кристаллического поля
- •Заселение d - и d
- •При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий
- •При сильном поле лигандов и высоком значении 0 заселение четвертым и пятым электроном
- •Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d
- •В случае сильного поля лигандов шестой электрон заселяет d -АО, приводя к диамагнетизму
- •Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
- •Цветность комплексных соединений
- •Избирательность поглощения света зависит: 1)от степени окисления комплексообразователя; 2)от вида лигандов.
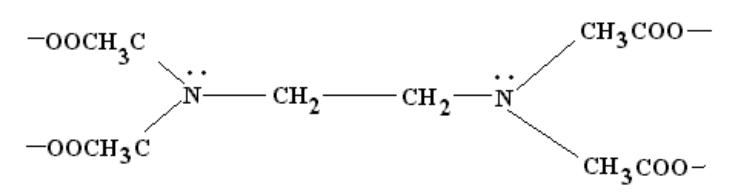
Лиганды, способные образовывать две и более связи называются полидентантными.
Пример гексадентатного лиганда - анион этилендиаминтетрауксусной кислоты:
Этот тип лигандов способн несколькими связями, пространственно отдаленными друг от друга, вцепляться в центральный атом и называются
хелатными, ''клешнеобразными''.
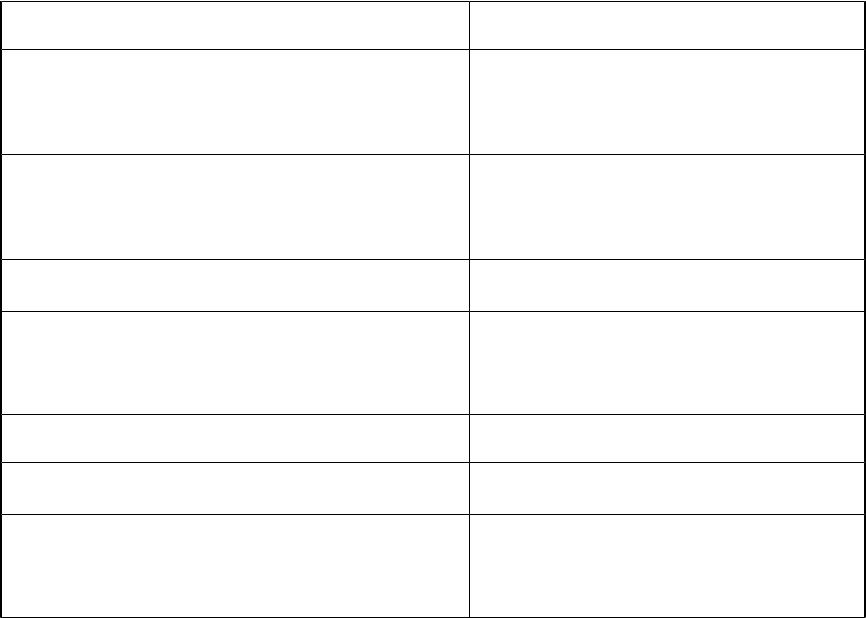
Номенклатура комплексных соединений
Лиганд |
|
Название |
Лиганд |
Название |
|||||
CH COO- |
|
ацетато |
NO- |
нитрозо |
|||||
3 |
|
|
|
|
|
|
|
|
|
CN- |
|
|
циано |
NO - |
нитро |
||||
|
|
|
|
|
|
|
|
2 |
|
CO 2- |
|
карбонато |
O 2- |
пероксо |
|||||
|
|
3 |
|
|
|
|
|
2 |
|
C |
O |
2- |
|
оксалато |
OH- |
гидроксо |
|||
2 |
|
4 |
|
|
|
|
|
|
|
Cl- |
|
|
|
хлоро |
SO 2- |
сульфито |
|||
|
|
|
|
|
|
|
|
3 |
|
H- |
|
|
|
гидридо |
SO S2- |
тиосульфато |
|||
|
|
|
|
|
|
|
|
3 |
|
H2O |
|
|
аква |
NH3 |
аммин |
||||
NO |
|
|
нитрозил |
CO |
карбонил |
||||
SO2 |
|
|
диоксосера |
PF3 |
трифторофосфор |
||||
NH (CH |
) |
NH |
2 |
этилендиамин |
N H + |
гидразиний |
|||
2 |
2 |
|
2 |
|
|
2 |
5 |
|
|
(NH ) |
CO |
|
карбамид |
NO+ |
нитрозилий |
||||
|
2 |
2 |
|
|
|
|
|
|
|
Комплексные соединения с комплексным анионом.
Указывается число и название лиганда, комплексообразователь по латински с окончанием -ат (феррат, никелат, хромат, купрат). Число
лигандов в комплексе обозначают греческими приставками ди, три, тетра, пента, гекса и т.д.
Степень окисления металла в комплексе указывается в скобках после названия комплекса:
Na[Al(OH)4] – Тетрагидроксоалюминат натрия K2[PtCl6] – Гексахлорплатинат (IV) калия
Ag - аргент- ; Au - аур- ; Cu - купр- ; Fe - ферр- ; Hg - меркур- ; Mn - манган- ; Ni - никкол- ; Pb - плюмб- ; Sb - стиб- ; Sn - станн-.
Комплексные соединения с комплексным катионом.
Сначала указывается название аниона, затем число и названия лиганда и
комплексообразователя |
по-русски |
в |
родительном падеже |
(для многоядерных |
|
комплексов – с указанием их числа). Обозначение степени окисления комплексообразователя дают римскими цифрами в скобках после названия:
[Zn(NH3)4]Cl2 – хлорид тетраамминоцинка
[Cо(H2O)2(NH3)4]C12-хлорид тетрааминодиаква кобальта(II).
Нейтральные комплексы
Названия состоят из одного слова.
Указывается число и названия лигандов (для лигандов каждого вида отдельно), затем название центрального атома в именительном падеже (в случае многоядерных комплексов – с указанием числа центральных атомов).
Например:
[Ni(H2O)4SO4] – сульфотетраакваникель [Co2(CO)8] – октакарбонилдикобальт
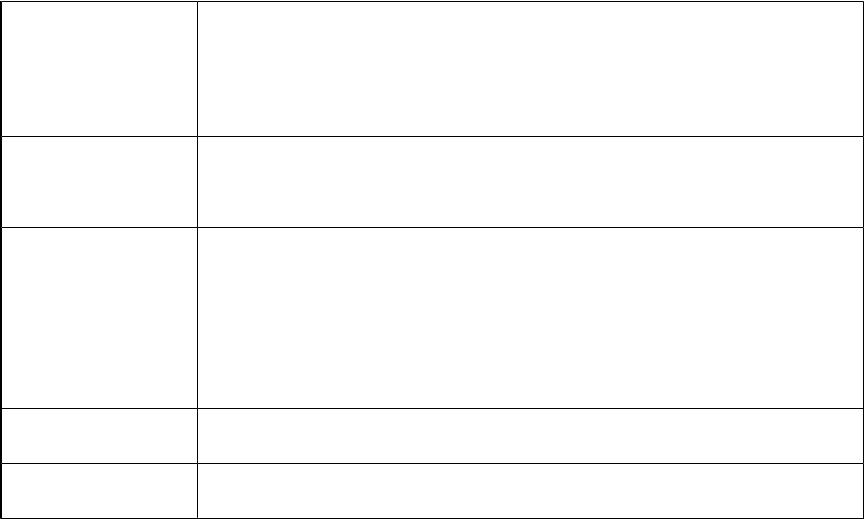
Строение комплексных соединений
Координаци |
Строение молекулы |
Пример |
онное число |
|
|
2 |
линейное |
3 |
равносторонний треугольник |
3 |
пирамидальное |
4 |
тетраэдрическое |
4 |
плоскоквадратное |
5 |
тригональное бипирамидальное |
5 |
квадратная пирамида |
6 и выше |
октаэдрическое |
7 |
Пентагональная бипирамида |
[С1-Сu-С1]-
[НgI3]- [SnС13]-
[ВF4]- [РtС14]2-
Устойчивость комплексных соединений
Делятся на электролиты и неэлектролиты.
К неэлектролитам относят прежде всего внутрикомплексные соединения (хелаты), карбонилы металлов и p-комплексы и др.
Растворимые комплексные соединения, не имеющие внешней сферы, ведут себя в растворах как слабые электролиты.
Комплексные соединения, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации.
Диссоциация имеет два этапа:
1) ведут себя как сильные электролиты, т.е. полностью диссоциируют на внутреннюю и внешнюю сферы.
K3[Fe(CN)6] 3K+ + [Fe(CN)6]3-
Комплексные основания и кислоты являются сильными электролитами.
2) комплексные ионы диссоциируют как слабые электролиты в незначительной степени, обратимо и ступенчато.
На каждой ступени комплекс отщепляет одну частицу – лиганд. Новый уменьшенный комплекс на следующей стадии снова отщепляет один лиганд и т. д.
[Fe(CN)6]3- [Fe(CN)5]2-+С -
........................................................................................................
[FeCN]2+ Fe3+ + С -
Процесс комплексообразования завершается, когда у комплексообразователя исчерпаны все валентные возможности.
Присоединения лигандов происходит ступенчато.
Полная константа образования комплекса Кn(обр) характеризует устойчивость комплексного соединения: чем она больше, тем более устойчив комплекс данного состава.
Например,
Ag+ + 2NH3=[Ag(NH3)2]+; К1(обр)=2,5*106
Ag+ + 2CN-=[Ag(CN)2]-; К2(обр)=1,2*1021 К2(обр) > К1(обр) более прочен второй комплекс.
Кn(обр)=K1(обр)*K2(обр)*K3(обр)*…*Kn(обр)
Процесс диссоциации характеризуется величиной константой нестойкости.
Kn(обр)=1/Kn(нест)
Константа нестойкости характеризует устойчивость комплексного иона в водной среде.
[Fe(CN)6]3- Fe3++6С - Кнест=[Fe3+]*[С -]6/[[Fe(CN)6]3-]
Чем ниже константа нестойкости, тем стабильнее комплекс.
Прочность комплексных ионов возрастает с увеличением степени окисления металла.
Металлы побочных подгрупп дают более прочные комплексы, чем металлы главных подгрупп. Прочность комплекса возрастает с увеличением силы лиганда.
