
- •Минобр науки россии
- •Растворимость. Произведение растворимости.
- •Курск 2012
- •305040 Курск, ул. 50 лет Октября, 94.
- •Реакции осаждения и растворения осадков
- •1. Тепловой эффект растворения
- •2. Растворимость
- •2.1. Растворимость газов в газах
- •2.2. Растворимость газов в жидкостях
- •2.3. Взаимная растворимость жидкостей
- •2.4. Растворимость твердых веществ в жидкостях
- •3. Равновесие между раствором и твердой фазой.
- •3.1. Механизм образования
- •Твердой фазы - теория кристаллизации
- •3.2 Произведение растворимости.
- •3.3 Солевой эффект.
- •3.4. Условие выпадения осадка.
- •3.4.1 Влияние температуры на полноту осаждения
- •3.4.2 Влияние рН среды на полнотуосаждения
- •3.4.3 Влияние на растворимость реакций комплексообразования
- •3.5. Дробное осаждение
- •3.6. Превращение одних малорастворимых соединений в другие
- •4. Расчёт количества осадителя
- •5. Потери при промывании осадков
- •Контрольные вопросы:
- •Лабораторная работа Опыт 1. Условия выпадения осадка
- •Опыт 2. Дробное осаждение
- •Опыт 3. Сравнение полноты осаждения ионов различными осадителями
- •Опыт 4. Условия растворения осадков
- •Опыт 5. Переосаждение малорастворимых веществ
- •Индивидуальные задания
- •Приложение
- •Произведения растворимости малорастворимых в воде электролитов
- •Растворимость различных веществ в воде
- •Растворимость солей и оснований при 250с
- •Приближенные коэффициенты активности отдельных ионов
- •Список используемой литературы
3.3 Солевой эффект.
Сильные электролиты, присутствующие в растворе, обычно повышают растворимость соприкасающихся с ним осадков. Например, растворимость PbSО4 в присутствии KNО3, NaNO3 и т. п. повышается и притом тем сильнее, чем больше общая концентрация всех подобных солей в растворе. Это явление, называемое солевым эффектом.
Произведение растворимости только в первом приближении можно рассматривать как произведение концентраций ионов в насыщенном растворе. В действительности же постоянным является не оно, а произведение активностей ионов в насыщенном растворе.
Например, действительные концентрации ионов Н+ и С1- в 0,1М растворе НС1, которая, как сильный электролит считается диссоциированной в водных растворах почти нацело, равны также по 0,1моль/л. Однако действуют эти ионы при различных химических реакциях так, как если бы их концентрация равнялась всего 0,0814 моль/л.
Концентрацию для сильных электролитов вычисляют, исходя из допущения почти полной диссоциации их в растворе. Что же касается коэффициента активности, то, согласно современной теории сильных электролитов, он представляет собой меру влияния электростатических сил притяжения и отталкивания, действующих между ионами на способность иона к химическим действиям.
Если fa < 1, это значит, что и он стеснен в своих движениях междуионными силами. В таком случае а < С, т. е. данное количество ионов (С, моль/л) действует так, как если бы их было меньше (а, моль/л). Если fa = 1, то а = С. Это значит, что ион действует соответственно своей «концентрации» в растворе. У сильных электролитов это происходит только в очень разбавленных растворах (С≤0,0001М), где расстояния между ионами настолько велики, что действующие между ними силы практически не играют роли. Аналогично же можно не считаться с междуионными силами и в случае не слишком концентрированных растворов слабых электролитов, у которых только ничтожная часть всех молекул диссоциирована на ионы. Для таких растворов можно принять, что fa =1 и а=С.
ПРИМЕР 3.5 Вычислить растворимость BaSO4 в 0,01М растворе Na2SО4 и сопоставить её с растворимостью этой соли в воде. ПР BaSO4=1,1·10-10.
Решение: Обозначим растворимость сульфата бария через х.
х моль BaSО4 дадут по х моль Ва2+ и SO42- соответственно. Но SO42-ионы образуются также в результате диссоциации Na2SО4. Учитывая, что каждый моль соли дадут 1 моль SO42-, можно написать:
[Ва2+]=х [SO42- ]=0,01+х.
Подставив эти значения в уравнение произведения растворимости, получим: ПР=х·(х + 0.01)= 1,1·10-10.
Если учесть, что растворимость BaSО4 очень мала, величиной по сравнению с 0,01 можно пренебречь. Сделав это, получим:
х·0,01= 1,1·10-10 х= 1,1·10-8 моль/л.
Растворимость BaSO4 в воде равна у:
![]()
Таким образом, присутствие 0,01 моль/л Na2SO4 должно понизить растворимость BaSО4 в :
![]()
3.4. Условие выпадения осадка.
Произведение растворимости является одной из основных характеристик осадка. Пользуясь этой характеристикой, можно изменять растворимость осадка, рассчитывать оптимальные условия осаждения, предвидеть, какими реакциями осаждения лучше пользоваться для определения тех или иных ионов.
Из уравнения (3.1.) вытекают условия образования в растворе осадка:
Осадок малорастворимого электролита образуется только в том случае, когда произведение концентраций его ионов (П) в растворе превышает величину произведения растворимости этого соединения, т.е. когда раствор становится пересыщенным относительно данного малорастворимого соединения. Из ненасыщенного раствора осадок не выделяется, происходит растворение твёрдой фазы.
ПРИМЕР 3.6 Определить, образуется ли осадок PbCО3 при смешении 400 мл 0,001 М Pb(NO)2 и 100 мл 0,01 М К2СО3.
Решение: Найдём молярные концентрации веществ в момент смешения по формуле:
![]()
![]()
![]()
![]()
Концентрации ионов, образующих осадок, равны:
[Pb2+]= См2(Pb(NO)2), т.к. при диссоциации из 1 моль соли образуется 1 моль ионов свинца.
[СО32-]= См2(К2СО3), т.к. при диссоциации из 1 моль соли образуется 1 моль ионов СО32-.
Отсюда ПР = [Pb2+]·[СО32-]= 0,0008·0,002=1,6·10-5.
Полученное значение больше ПРPbCO3 = 7,5·10-14, следовательно, раствор пересыщен относительно карбоната свинца и осадок образуется.
ПРИМЕР 3.7 При каком соотношении концентраций ионов Ва2+и Рb2+ их карбонаты при введении ионов СО32- будут выпадать одновременно? ПРВаСО3 =7∙10-9, ПРРbСО3 =1,5∙10-13.
Решение: Концентрацию вводимых карбонат-ионов обозначим через ССО32-, тогда:
![]()
![]()
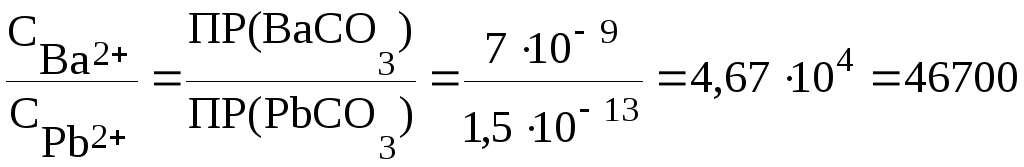
Итак, карбонаты бария и свинца будут выпадать одновременно из раствора, если СВа2+>СРb2+ в 46700 раз. Если отношение СВа2+/ СPb2+>46700, то первым из раствора будет выпадать ВаСО3 до тех пор, пока отношение СВа2+/ СPb2+ не будет равным 46700. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов бария и свинца меньше 46700, то первым начнет осаждаться карбонат свинца. Осаждение карбоната свинца будет протекать до тех пор, пока отношение СВа2+/ СPb2+ не достигнет значения, при котором ВаСО3 и РbСО3 будут осаждаться одновременно.
