
- •Минобр науки россии
- •Растворимость. Произведение растворимости.
- •Курск 2012
- •305040 Курск, ул. 50 лет Октября, 94.
- •Реакции осаждения и растворения осадков
- •1. Тепловой эффект растворения
- •2. Растворимость
- •2.1. Растворимость газов в газах
- •2.2. Растворимость газов в жидкостях
- •2.3. Взаимная растворимость жидкостей
- •2.4. Растворимость твердых веществ в жидкостях
- •3. Равновесие между раствором и твердой фазой.
- •3.1. Механизм образования
- •Твердой фазы - теория кристаллизации
- •3.2 Произведение растворимости.
- •3.3 Солевой эффект.
- •3.4. Условие выпадения осадка.
- •3.4.1 Влияние температуры на полноту осаждения
- •3.4.2 Влияние рН среды на полнотуосаждения
- •3.4.3 Влияние на растворимость реакций комплексообразования
- •3.5. Дробное осаждение
- •3.6. Превращение одних малорастворимых соединений в другие
- •4. Расчёт количества осадителя
- •5. Потери при промывании осадков
- •Контрольные вопросы:
- •Лабораторная работа Опыт 1. Условия выпадения осадка
- •Опыт 2. Дробное осаждение
- •Опыт 3. Сравнение полноты осаждения ионов различными осадителями
- •Опыт 4. Условия растворения осадков
- •Опыт 5. Переосаждение малорастворимых веществ
- •Индивидуальные задания
- •Приложение
- •Произведения растворимости малорастворимых в воде электролитов
- •Растворимость различных веществ в воде
- •Растворимость солей и оснований при 250с
- •Приближенные коэффициенты активности отдельных ионов
- •Список используемой литературы
3.4.3 Влияние на растворимость реакций комплексообразования
Увеличение растворимости малорастворимых соединений часто связано с образованием комплексов. Во многих случаях осаждаемые ионы способны взаимодействовать с различными лигандами, в результате чего они влияют на состояние равновесия между осадком и раствором. Так, ионы винной кислоты и других оксикислот мешают осаждению железа в виде гидроксида. Растворимость сульфата свинца в присутствии Рb(NО3)2 увеличивается в результате образования комплексных катионов [Pb2SO4]2+, [Pb3(SO4)2]2+ и др. При осаждении ионов серебра избытком хлороводородной кислоты или хлорида натрия часть осадка хлорида серебра переходит в раствор в виде комплексных анионов [AgCl2]-или [AgC13]2-.
Сдвиг состояния равновесия между осадком и раствором в сторону растворения осадка зависит от произведения растворимости осадка, устойчивости комплекса, концентрации лиганда, кислотности раствора и других условий.
С помощью лигандов можно связать различные ионы, которые мешают анализу, методом осаждения или другими методами. По существу этот процесс соответствует разделению без фильтрования, промывания и т. д., которые требуют много времени.
Расчеты растворимости осадков при образовании комплексов связаны с некоторыми затруднениями. Обусловлено это тем, что для многих комплексных соединений пока не установлены константы нестойкости или устойчивости. Кроме того, комплексные ионы, аналогично многоосновным кислотам, образуются и диссоциируют ступенчато. Состояние равновесия между отдельными формами комплексных групп зависит от концентрации лиганда и кислотности раствора.
ПРИМЕР 3.10 Рассчитать растворимость хлорида серебра в 1М растворе NH3 при условии, что после достижения равновесия концентрация избытка аммиака [NH3] составила 0,1моль/л.
Решение: Растворимость хлорида серебра в растворе аммиака связана с образованием аммиачного комплекса:
AgCl + 2NH3 ↔[Ag(NH3)2]Cl.
Это соединение представляет собой сильный электролит и диссоциирует на ионы [Ag(NH3)2]+ и С1-. Таким образом, комплексным является катион [Ag(NH3)2]+, который очень слабо диссоциирует. Поэтому растворимость в этом случае связана с взаимодействием ионов серебра с аммиаком по уравнению:
Ag+ + 2NH3 ↔[Ag(NH3)2]+.
Константа устойчивости комплекса имеет вид:
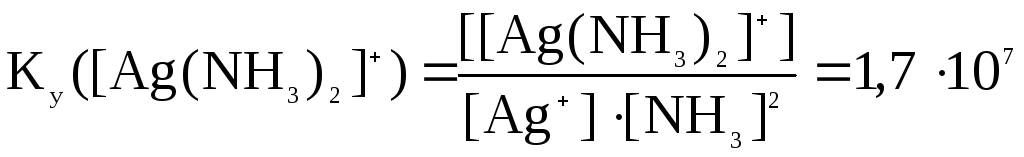 .
.
Произведение растворимости хлорида серебра:
ПPAgCI = [Ag+][С1-] = 1∙10-10.
Уравнение реакции между хлоридом серебра и аммиаком можно записать следующим образом:
AgCl + 2NH3 ↔[Ag(NH3)2]+ + CI-.
Константа равновесия этой реакции
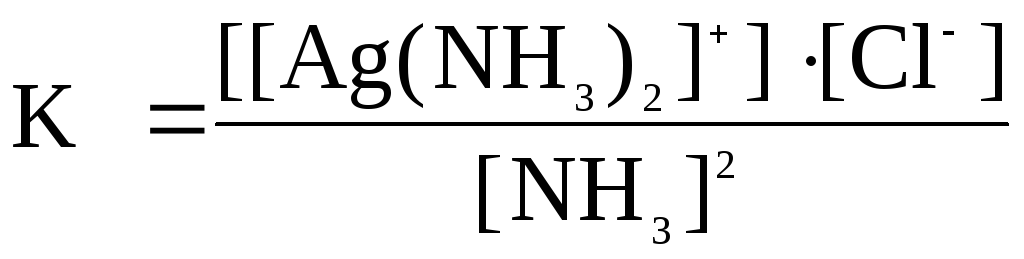 .
.
Если это выражение умножить и поделить на концентрацию ионов серебра [Ag+] и подставить соответствующие значения, то
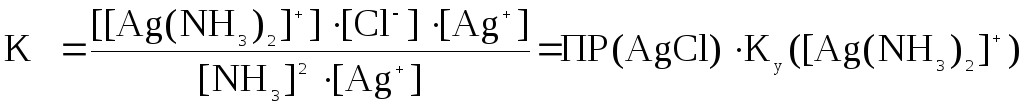 .
.
К=1,7∙107∙10-10=1,7∙10-3
Состояние равновесия реакции смещается вправо тем больше, чем больше растворимость осадка и чем меньше константа диссоциации комплекса, т. е. чем больше его устойчивость.
При растворении осадка AgCl в растворе NH3 количества ионов С1- и [Ag(NH3)2]+ будут равны, т.е. [C1-] = [Ag(NH3)2]+.
Тогда можно записать:
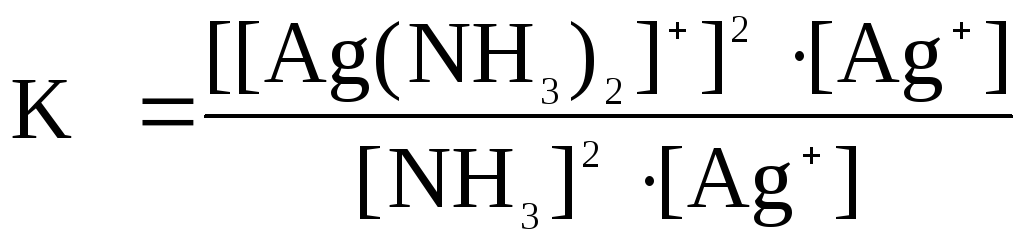
Отсюда,
![]()
Следовательно, растворимость AgCl, в воде равна 10-5М, а в 1М растворе аммиака увеличивается до 3,7∙10-3 М, т.е. осадок практически полностью переходит в раствор.
