
- •Министерство образования Республики Беларусь
- •3 Физические свойства аминокислот 24
- •4 Химические свойства аминокислот 25
- •5 Полипептиды 34
- •6 Пространственное строение полипептидов и белков 39
- •7 Значение аминокислот и пептидов. Незаменимые аминокислоты 43
- •Введение
- •Классификация, изомерия и номенклатура
- •Классификация аминокислот
- •Неполярные r-группы
- •Изомерия аминокислот
- •Проекционные формулы энантиомеров:
- •Номенклатура аминокислот
- •Способы получения аминокислот
- •Гидролиз белков под влиянием ферментов, кислот и щелочей
- •Действие аммиака на галогензамещенные кислоты (аммонолиз)
- •Микробиологический синтез
- •Химические свойства аминокислот
- •Амфотерный характер аминокислот
- •Реакции карбоксильной группы
- •Алкилирование аминокислот
- •Действие азотистой кислоты на аминокислоты
- •Образование оснований Шиффа
- •Образование днф-производных
- •Образование фтг-производных (реакция Эдмана)
- •Качественные реакции аминокислот
- •Реакции, протекающие с одновременным участием карбоксильной и аминной групп
- •Отношение аминокислот к нагреванию
- •Биохимические превращения аминокислот
- •Полипептиды
- •Защита аминогруппы
- •Защита карбоксильной группы
- •Способы активирования карбоксильной группы
- •Пространственное строение полипептидов и белков
- •Первичная структура
- •Строение пептидной группы
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Значение аминокислот и пептидов. Незаменимые аминокислоты
- •Список использованной литературы
Алкилирование аминокислот
При алкилировании аминокислот галоидными алкилами, алкилсульфатами образуются моно-ди- и три-N-алкилпроизводные. Три-N-алкилпроизводные представляют собой четвертичные аммониевые основания, внутренние соли которых называютсябетаинами:
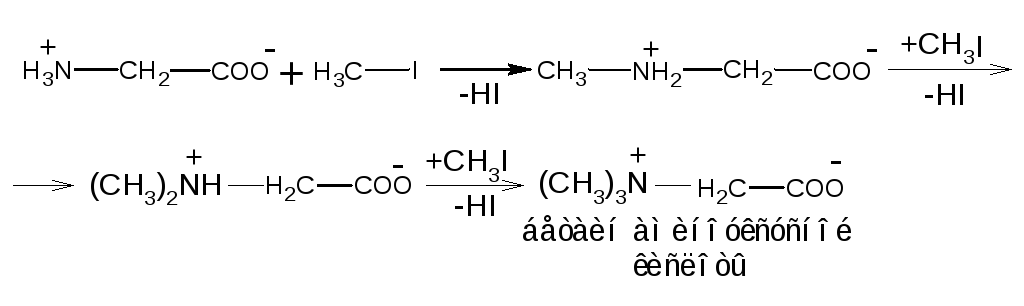
Бетаин аминоуксусной кислоты входит в состав многих растений, впервые выделен из сока сахарной свеклы (Betavulgaris), дал название всему классу внутренних солей. Ряд алкилированных аминокислот нашел применение при изучении первичной структуры белков и синтезе пептидов.
Действие азотистой кислоты на аминокислоты
При действии азотистой кислоты на аминокислоты, содержащие первичную аминогруппу, образуется оксикислота и выделяются азот и вода:

Этой реакцией пользуются для количественного газометрического определения аминогрупп в аминокислотах и белках по методу Ван-Сляйка.
Образование оснований Шиффа
При взаимодействии аминокислот с альдегидами образуются азометины (основания Шиффа), причем промежуточно образуются карбиноламины:
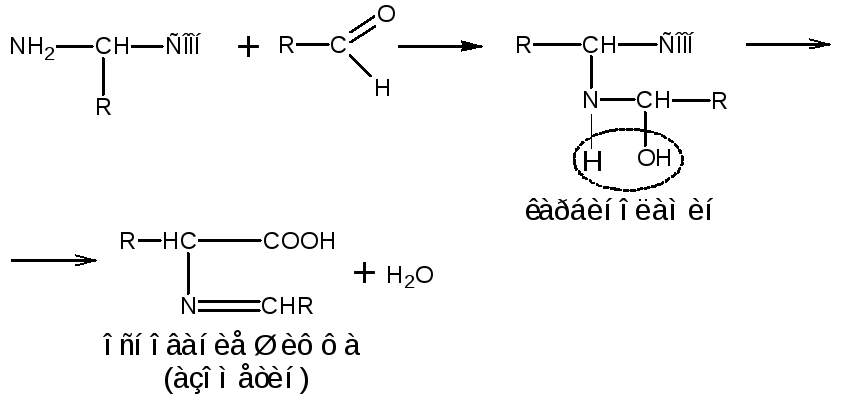
Реакция с формальдегидом лежит в основе количественного определения -аминокислот методом формольного титрования (метод Серенсена). Образующиеся в результате реакции устойчивые карбиноламины–N-моногидроксиметил-аминокислоты, содержащие свободную карбоксильную группу, титруют щелочью:

Образование днф-производных
-Аминокислоты образуют с 2,4-динитрофторбензолом (ДНФБ) окрашенные в желтый цвет динитрофенильные производные (ДНФ-производные), устойчивые к кислотному гидролизу и хорошо растворимые в органических растворителях. Они экстрагируются из реакционной смеси органическими растворителями и используются для идентификации методом тонкослойной хроматографии (ТСХ). Для всех аминокислот известны Rf(факторы задержки – англ.retcntionfactor) их ДНФ-производных.
Взаимодействие -аминокислот с ДНФБ является реакцией нуклеофильного замещения в бензольном кольце:

Эту реакцию успешно применил Сенгер при определении аминокислотной последовательности гормона инсулина.
Образование фтг-производных (реакция Эдмана)
Эта реакция широко используется при установлении строения пептидов. Взаимодействие -аминокислот с фенилизотиоцианатом протекает по механизму нуклеофильного присоединения. В образовавшемся продукте затем происходит внутримолекулярная реакция нуклеофильного замещения, приводящая к образованию циклического замещенного амида – фенилтиогидантоина (ФТГ-производного). ФТГ-производные (фенильные производные тиогидантоина) получаются с количественным выходом и различаются строением радикалаR.

Эту реакцию впервые использовал Эдман для определения аминокислотной последовательности пептидов путем постепенного отщепления концевых аминокислот кислотным гидролизом.
Качественные реакции аминокислот
Существует ряд качественных (цветных) реакций, которые применяются для идентификации -аминокислот.
Общая качественная реакция -аминокислот –реакция с нингидрином. Продукт нингидринной реакции имеет интенсивный сине-фиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое), а также спектрофотометрического определения на аминокислотных анализаторах (продукт поглощает свет в области 550-570 нм).
Следует отметить, что окрашивание с нингидрином дают не только аминокислоты, но и пептиды, первичные и вторичные амины.

Для обнаружения пептидных связей в пептидах и белках служит биуретовая реакция – пептиды в щелочной среде в присутствии ионов меди дают фиолетовое или красно-фиолетовое окрашивание, которое зависит от длины пептида. Пептидные связи в щелочной среде с солями меди образуют окрашенные комплексы (хелатные соединения). Биуретовую реакцию дают также некоторые аминокислоты (гистидин, треонин) и аспарагин.
Пептидная связь в щелочной среде присутствует в таутомерной енольной форме:

Биуретовый комплекс имеет строение:

Для обнаружения ароматических и гетероциклических -аминокислот используетсяксантопротеиновая реакция (реакция на фенилаланин, тирозин, гистидин, триптофан). Например, при действии концентрированной азотной кислоты на тирозин образуется нитросоединение, окрашенное в желтый цвет. При добавлении к нему щелочи окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.

Ксантопротеиновую реакцию не дают белки, в молекулах которых отсутствуют ароматические и гетероциклические аминокислоты.
