
- •Министерство образования Республики Беларусь
- •3 Физические свойства аминокислот 24
- •4 Химические свойства аминокислот 25
- •5 Полипептиды 34
- •6 Пространственное строение полипептидов и белков 39
- •7 Значение аминокислот и пептидов. Незаменимые аминокислоты 43
- •Введение
- •Классификация, изомерия и номенклатура
- •Классификация аминокислот
- •Неполярные r-группы
- •Изомерия аминокислот
- •Проекционные формулы энантиомеров:
- •Номенклатура аминокислот
- •Способы получения аминокислот
- •Гидролиз белков под влиянием ферментов, кислот и щелочей
- •Действие аммиака на галогензамещенные кислоты (аммонолиз)
- •Микробиологический синтез
- •Химические свойства аминокислот
- •Амфотерный характер аминокислот
- •Реакции карбоксильной группы
- •Алкилирование аминокислот
- •Действие азотистой кислоты на аминокислоты
- •Образование оснований Шиффа
- •Образование днф-производных
- •Образование фтг-производных (реакция Эдмана)
- •Качественные реакции аминокислот
- •Реакции, протекающие с одновременным участием карбоксильной и аминной групп
- •Отношение аминокислот к нагреванию
- •Биохимические превращения аминокислот
- •Полипептиды
- •Защита аминогруппы
- •Защита карбоксильной группы
- •Способы активирования карбоксильной группы
- •Пространственное строение полипептидов и белков
- •Первичная структура
- •Строение пептидной группы
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Значение аминокислот и пептидов. Незаменимые аминокислоты
- •Список использованной литературы
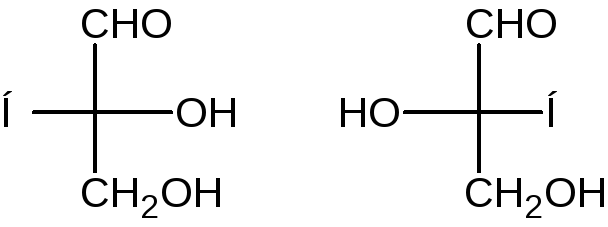
Проекционные формулы энантиомеров:

D-глицериновый L-глицериновый D-аланин L-аланин
альдегид альдегид
По R,S- системе обозначений-углеродный атом у всех-аминокислотL-ряда имеетS-, а уD-ряда –R-конфигурацию (исключение составляет цистеин).
Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежат к L-ряду, т.е. имеют пространственное расположение, аналогичное конфигурацииL-глицеринового альдегида. Следует отметить, что знак вращения плоскости поляризации поляризованного света(+) – правовращающий и (–) – левовращающийраствором аминокислоты не связан с принадлежностью кD- илиL-ряду, он определяется экспериментально в поляриметре.
Использование для построения белков животных и растительных организмов только одного вида стереоизомеров -аминокислот, а именноL-энантиомеров, имеет важнейшее значение для формирования пространственной структуры белков. С этим непосредственно связана стереоспецифичность действия ферментов. Макромолекулы ферментов, построенные из-аминокислот, т.е. хирального материала, в целом являются хиральными и поэтому вступают во взаимодействие только с теми субстратами, которые также имеют определенную конфигурацию.
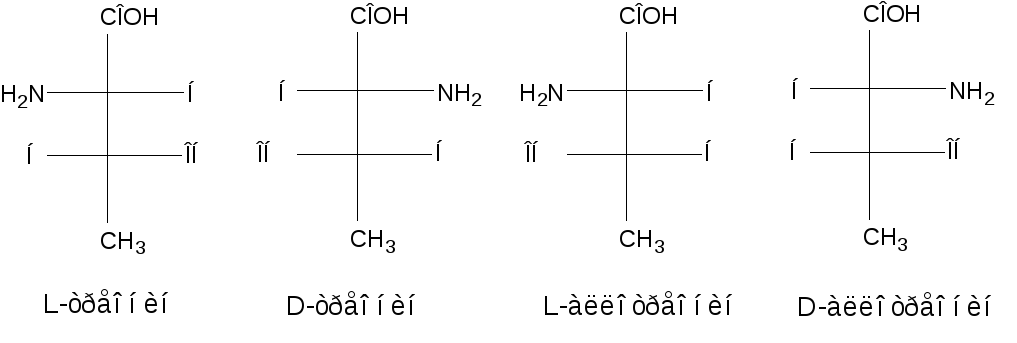
Среди белковых аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода, и поэтому могут существовать в виде четырех стереоизомеров (N= 22 = 4), т.е. двух пар энантиомеров и двух рацематов. Так, для треонина выделены все четыре стереоизомера. Если условно обозначить символомLвыделенный из природных белков треонин, то его зеркальное отображение называютD-треонином.
Два других стереоизомера, являющихся диастереоизомерами по отношению к первой паре антиподов, имеют другое название – аллоформы, но также относятся кD- иL-ряду. Отнесение треонина кD- илиL-ряду производится по верхнему тетраэдру путем сравнения с глицериновым альдегидом.
Структурные конфигурации четырех стереоизомеров треонина можно представить следующими проекционными формулами:

Номенклатура аминокислот
Для наименования природных аминокислот широко используются тривиальные названия. По рациональной номенклатуре аминокислоты рассматривают как аминопроизводные соответствующих карбоновых кислот, при этом положение аминогруппы по отношению к карбоксильной группе указывается буквами греческого алфавита: ,,,,и т.д. ПоJUPACпри заместительной номенклатуре для наименования аминокислот группуNН2 называют приставкой «амино», указывая цифрой номер углеродного атома, с которым она связана (нумеруют от карбоксильной группы), затем следует название соответствующей кислоты. Приведем примеры названий аминокислот по трем номенклатурам:

Глицин, аминоуксусная кислота, аминоэтановая кислота

Аланин, -аминопропионовая кислота, 2-аминопропановая кислота

Треонин, -амино--гидроксимасляная кислота, 2-амино-3-гидроксибутановая кислота

Фенилаланин, -амино--фенилпропионовая кислота, 2-амино-3-фенилпро-пановая кислота.
Способы получения аминокислот
Гидролиз белков под влиянием ферментов, кислот и щелочей
В состав белков входят до 30-ти различных аминокислот, которые могут быть выделены при гидролизе белка. Однако разделение образовавшейся при гидролизе смеси аминокислот представляет собой трудную задачу. Полученные из белковых гидролизатов L-аминокислоты разделяют методами ионообменной хроматографии, электрофореза и газожидкостной хроматографии. В большинстве случаев аминокислоты получают синтетическим путем, но в этом случае образуется рацемическая смесь аминокислот, для разделения которой на отдельные антиподы разработаны химические методы разделения. Однако более предпочтительным является ферментативный способ расщепления с использованием ферментовацилаз, способных гидролизоватьN-ацетил-L--аминокислоты.
Смесь энантиомеров ацетилируют уксусным ангидридом и получают смесь N-ацетилпроизводных-аминокислоты, которую обрабатывают ферментом, выделенным из животного сырья. При этом гидролизуются производные аминокислоты толькоL–ряда. Свободная аминокислота отличается от ацетилированной растворимостью: кислота растворяется как в кислотах, так и в щелочах, аN-ацетил--аминокислота – только в щелочах. После отделенияL–-аминокислоты можно провести кислотный гидролиз и получить свободнуюD--аминокислоту.

