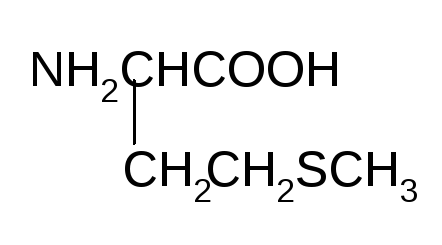- •Министерство образования Республики Беларусь
- •3 Физические свойства аминокислот 24
- •4 Химические свойства аминокислот 25
- •5 Полипептиды 34
- •6 Пространственное строение полипептидов и белков 39
- •7 Значение аминокислот и пептидов. Незаменимые аминокислоты 43
- •Введение
- •Классификация, изомерия и номенклатура
- •Классификация аминокислот
- •Неполярные r-группы
- •Изомерия аминокислот
- •Проекционные формулы энантиомеров:
- •Номенклатура аминокислот
- •Способы получения аминокислот
- •Гидролиз белков под влиянием ферментов, кислот и щелочей
- •Действие аммиака на галогензамещенные кислоты (аммонолиз)
- •Микробиологический синтез
- •Химические свойства аминокислот
- •Амфотерный характер аминокислот
- •Реакции карбоксильной группы
- •Алкилирование аминокислот
- •Действие азотистой кислоты на аминокислоты
- •Образование оснований Шиффа
- •Образование днф-производных
- •Образование фтг-производных (реакция Эдмана)
- •Качественные реакции аминокислот
- •Реакции, протекающие с одновременным участием карбоксильной и аминной групп
- •Отношение аминокислот к нагреванию
- •Биохимические превращения аминокислот
- •Полипептиды
- •Защита аминогруппы
- •Защита карбоксильной группы
- •Способы активирования карбоксильной группы
- •Пространственное строение полипептидов и белков
- •Первичная структура
- •Строение пептидной группы
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Значение аминокислот и пептидов. Незаменимые аминокислоты
- •Список использованной литературы
Классификация, изомерия и номенклатура
Классификация аминокислот
Аминокислотами называются соединения, содержащие одновременно аминогруппы и карбоксильные группы.
Аминокислоты по взаимному расположению карбоксильной и аминогруппы делятся на -,- и- и т.д. аминокислоты. С биологической точки зрения огромное значение имеют-аминокислоты, которые можно получить гидролизом белков (см. таблицу 1).
Таблица 1 – Важнейшие аминокислоты белка
|
№ п/п |
Тривиальное название, по ИЮПАК |
Сокращенное название остатка аминокислоты |
Формула |
Температура плавления |
[]D в ледяной уксусной кислоте, градусы |
Изоэлектрическая точка рН |
Растворимость в воде при 25оС, г/100г |
|
1 |
Глицин, аминоэтановая кислота |
Гли |
NH2CH2COOH |
292 |
– |
5,97 |
25 |
|
2 |
Аланин, 2-амино-2-метилпропановая кислота |
Ала |
|
297 |
+33 |
6,00 |
16,6 |
|
3 |
Валин, 2-амино-3-метилбутановая кислота |
Вал |
|
315 |
+62 |
5,96 |
8,85
|
|
4 |
Лейцин, 2-амино-4-метилпентановая кислота |
Лей |
|
337 |
+22,5 |
5,98 |
2,2 |
|
5 |
Изолейцин, 2-амино-3-метилпентановая кислота |
Иле |
|
284 |
+49 |
6,02 |
4,12 |
|
6 |
Аспарагиновая кислота, 2-аминобутандиовая кислота |
Асп |
|
270 |
+25,4 |
2,77 |
0,5 |
|
7 |
Аспарагин, 2-амино-3-карбамоилпропановая кислота |
Асн |
|
236 |
+34,3 |
5,41 |
2,5 |
|
8 |
Глутаминовая кислота, 2-аминопентандиовая кислота |
Глу |
|
249 |
+31,8 |
3,22 |
0,84 |
|
9 |
Глутамин, 2-амино-4-карбамоилбутановая кислота |
Глн |
|
185
|
6,1 (в воде) |
5,65 |
4,2 |
|
10 |
Орнитин, 2,5-диаминопентановая кислота
|
Орн |
|
– |
– |
– |
– |
|
1
Продолжение
табл. 1 |
Лизин, 2,6-диаминогексановая кислота |
Лиз |
|
– |
+25,9 |
9,74 |
Хорошо
растворим в
Продолжение
табл. 1 |
|
12 |
Аргинин, 2-амино-5-гуанидилпентановая кислота |
Арг |
|
238 |
+29,4 |
10,76 |
15 |
|
13 |
Серин, 2-амино-3-гидроксипропановая кислота |
Сер |
|
228 |
+15 |
5,68 |
5 |
|
14 |
Треонин, 2-амино-3-гидроксибутановая кислота |
Тре |
|
253 |
–30 |
6,16 |
20,5 |
|
15 |
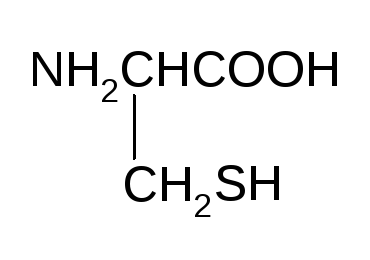
Цистеин, 2-амино-3-тиопропановая кислота |
Цис |
|
178 |
+13 |
5,02 |
Хорошо растворим |
|
16 |
Цистин, дицистеинил-дисульфид |
|
|
260 |
–232 |
5,03 |
0,011 |
|
17 |
Метионин, 2-амино-4-метилтиобутановая кислота |
Мет |
|
283 |
+20 |
5,74 |
3,5 |
|
18 |
Фенилаланин, 2-амино-3-фенилпропановая кислота |
Фен |
|
– |
–75 |
3,0 |
3,0 |
|
19 |
Тирозин, 2-амино-4-гидроксифенилпропановая кислота |
Тир |
|
344 |
–10 |
5,66 |
5,66 |
|
2
Продолжение
табл. 1 Продолжение
табл. 1 |
Триптофан, 2-амино-3-(-индолил)пропановая кислота |
Трп |
|
382 |
–34 |
5,89 |
5,89 |
|
21 |
Пролин, 2-пирролидинкарбоновая кислота |
Про |
|
299 |
–80 |
6,30 |
6,30 |
|
22 |
Оксипролин, 4-гидроксипирролидин-2-карбоновая кислота |
Орг |
|
270 |
–77 |
5,83 |
5,83 |
|
23 |
Гистидин, 2-амино-3-(5/-диазолил)пропановая кислота |
Гис |
|
277 |
+7,5 |
7,6 |
7,6 |
Для -аминокислот общая формула может быть представлена в следующем виде:

Как видно из общей формулы, -аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все-амино- и-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называетсясобственно основнойиликислой аминокислотой.
Совершенная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы:
неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные; 5) положительно заряженные.
В представленной классификации аминокислот (табл. 2) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки и молекулярной массы. Отдельно даны структурные формулы всех 20 аминокислот белковой молекулы.
Таблица 2 – Классификация аминокислот, основанная на полярности радикалов
|
Аминокислоты |
Принятые сокращенные обозначения и однобуквенные символы |
М/pI |
Среднее содержание в белках, % | ||
|
англ. |
символ |
русск. | |||
|
1 Неполярные R-группы Глицин Аланин Валин Лейцин Изолейцин Пролин |
Gli Ala Val Leu Ile Pro |
G A V L I P |
Гли Ала Вал Лей Иле Про |
75/5,97 89/6,02 117/5,97 113/5,97 113/5,97 115/6,10 |
7,5 9,0 6,9 7,5 4,6 4,6 |
|
2 Полярные, незаряженные R-группы Серин Треонин Цистеин Метионин Аспарагин Глутамин |
Ser Thr Cys Met Asn Gln |
S T C M N Q |
Сер Тре Цис Мет Асн Глн |
105/5,68 119/6,53 121/5,02 149/5,75 132/5,41 146/5,65 |
7,1 6,0 2,8 1,7 4,4 3,9 |
|
3
Продолжение
табл. 2 Продолжение
табл. 2 Фенилаланин Тирозин Триптофан |
Phe Tyr Trp |
F Y W |
Фен Тир Трп |
165/5,98 181/5,65 204/5,88 |
3,5 3,5 1,1 |
|
4 Отрицательно заряженные R-группы Аспарагиновая кислота Глутаминовая кислота |
Asp Glu |
D E |
Асп Глу |
133/2,97 147/3,22 |
5,5 6,2 |
|
5 Положительно заряженные R-группы Лизин Аргинин Гистидин |
Lys Arg His |
K R H |
Лиз Арг Гис |
146/9,74 174/10,76 155/7,59 |
7,0 4,7 2,1 |