
- •Министерство образования Республики Беларусь
- •3 Физические свойства аминокислот 24
- •4 Химические свойства аминокислот 25
- •5 Полипептиды 34
- •6 Пространственное строение полипептидов и белков 39
- •7 Значение аминокислот и пептидов. Незаменимые аминокислоты 43
- •Введение
- •Классификация, изомерия и номенклатура
- •Классификация аминокислот
- •Неполярные r-группы
- •Изомерия аминокислот
- •Проекционные формулы энантиомеров:
- •Номенклатура аминокислот
- •Способы получения аминокислот
- •Гидролиз белков под влиянием ферментов, кислот и щелочей
- •Действие аммиака на галогензамещенные кислоты (аммонолиз)
- •Микробиологический синтез
- •Химические свойства аминокислот
- •Амфотерный характер аминокислот
- •Реакции карбоксильной группы
- •Алкилирование аминокислот
- •Действие азотистой кислоты на аминокислоты
- •Образование оснований Шиффа
- •Образование днф-производных
- •Образование фтг-производных (реакция Эдмана)
- •Качественные реакции аминокислот
- •Реакции, протекающие с одновременным участием карбоксильной и аминной групп
- •Отношение аминокислот к нагреванию
- •Биохимические превращения аминокислот
- •Полипептиды
- •Защита аминогруппы
- •Защита карбоксильной группы
- •Способы активирования карбоксильной группы
- •Пространственное строение полипептидов и белков
- •Первичная структура
- •Строение пептидной группы
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Значение аминокислот и пептидов. Незаменимые аминокислоты
- •Список использованной литературы
Строение пептидной группы
Пептидная связь по своей химической природе является ковалентной и придает высокую прочность первичной структуре белковой молекулы. Являясь повторяющимся элементом полипептидной цепи и имея специфические особенности структуры, пептидная связь влияет не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи.
Для пептидной (амидной) группы свойственна оригинальная структура.

Все четыре атома – N,C,OиCрасполагаются в одной плоскости, что отвечаетsp2-гибридизации атомов углерода и кислорода карбонильной группы. Неподеленная пара электронов атома азота вступает в сопряжение с-электронами двойной связи карбонильной группы. В результате этого связь С–Nв пептидах и белках сильно укорачивается, а двойная связь С=О удлиняется. С позиций электронного строения пептидная группа представляет собой трехцентровую р––сопряженную систему, электронная плотность в которой смещена в сторону более электроотрицательного атома кислорода. При этом возникают высокие электронодонорные (атом =О) и электроноакцепторные свойства (атом Н при азоте), которые резко увеличивают способность этих атомов к образованию водородной связи, за счет которой возникает важнейшее свойство белков – образовывать структуры бесконечно разнообразных форм:
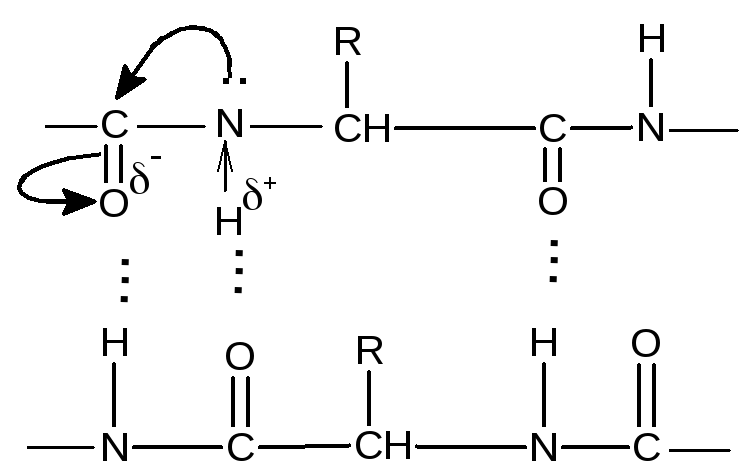
Каждая пептидная группа может образовывать по две водородные связи с другими группами, в том числе и пептидными. Исключением являются пептидные группы, образованные с участием аминокислот пролина или гидроксипролина, которые способны образовывать только одну водородную связь. Пептидная цепь на участке, где находятся пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
В результате того, что пептидная связь может существовать в кето-енольной форме (наличие плоской сопряженной системы),

вращение вокруг С–N-связи является запретным и все атомы, входящие в пептидную группу, имеют транс-конфигурацию. Цис-конфигурация является энергетически менее выгодной и встречается лишь в некоторых циклических пептидах.
В составе полипептидной цепи жесткие структурные элементы (плоские пептидные группы) чередуются с относительно подвижными участками (–СНR), которые способны вращаться вокруг связей, хотя такое вращение может быть весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов (R) аминокислотных остатков. Таким образом, электронное и пространственное строение пептидной группы влияет на укладку полипептидной цепи в пространстве и, прежде всего, предопределяет формирование вторичной структуры белка.
Вторичная структура
Вторичная структура белков представляет собой способ укладки полипептидной цепи в упорядоченную форму за счет системы водородных связей, т.е. определяет пространственную ориентацию полипептидной цепи. Различают две формы вторичной структуры: спиральную (-спираль), возникающую в пределах одной полипептидной цепи, ислоисто-складчатую (-структура) – между смежными полипептидными цепями.
Хотя спиральная структура в полипептидных цепях белков обнаружена в виде отдельных участков, она придает молекуле белка достаточно высокую прочность, обуславливает в ней как ближний, так и дальний порядок сил, участвующих в создании водородных связей.
-Спираль учитывает все свойства пептидной связи, ее конфигурация имеет винтовую симметрию. Витки спирали регулярны; все аминокислотные остатки в остове спирали равнозначны независимо от строения их боковых радикалов, причем последние не участвуют в образовании -спирали. В одном витке-спирали находится 3,6 аминокислотных остатка. Спираль может быть описана последовательностью

с 13-ю атомами в кольце (R-остатки аминокислот), где О…Н – водородная связь.
Каждая пептидная группа образует водородную связь с четвертой от нее по счету пептидной группой.
-Спираль обеспечивает наименьшее напряжение связей, минимальные размеры незанятого пространства вблизи оси и минимальные размеры витка спирали. -Спираль впервые была обнаружена в кристаллическом гемоглобине, а позднее – почти во всех глобулярных белках.
Слоисто-складчатая структура (-структура) имеет слегка изогнутую конфигурацию у-углеродного атома полипептидной цепи и формируется с помощью межцепочечных водородных связей.
-Складчатые листы могут быть образованы параллельными (N-концы направлены в одну сторону) и антипараллельными (N-концы направлены в разные стороны) полипептидными цепями. Складчатые структуры были обнаружены во многих структурных белках (коллагене, кератине, фиброине шелка).
Совокупность -спиралей и-структур является важным критерием, по которому можно судить о степени упорядоченности структуры белковой молекулы, стабильности белков при действии физико-химических факторов сред.
На основании последних исследований глобулярных белков были установлены еще два уровня: сверхвторичная структура, характеризующая энергетически предпочтительные агрегаты вторичной структуры, идомены – части белковой глобулы, представляющие собой достаточно обособленные глобулярные области.
Сверхвторичная структура (суперспираль)– это ансамбли взаимодействующих между собой вторичных структур. Возникновение этих ансамблей указывает на то, что они предпочтительны с точки зрения либо кинетики процесса свертывания, либо выигрыша свободной энергии в уже свернутом белке. Суперспирализованная-спираль встречается в фибриллярных белках.
Под доменами принято понимать компактные автономные субобласти в составе белка, характеризующиеся минимальным отношением поверхности к объему, а также тем, что число функциональных связей в составе домена значительно превышает таковое по сравнению с соседними доменами. Как правило, домены выполняют определенные функции и поэтому их называютфункциональными доменами.
