
- •Химия гетероциклических соединений
- •49 01 01, 49 01 02, 91 01 01, 48 01 02
- •Содержание
- •Введение
- •Номенклатура гетероциклических соединений
- •Пятичленные гетероциклические соединения с одним гетероатомом
- •Источники и методы получения фурана, тиофена и пиррола
- •Получение из 1,4-дикарбонильных соединений
- •Получение фурана и пиррола из слизевой кислоты
- •Галогенирование
- •Сульфирование
- •Нитрование
- •Ацилирование
- •Восстановление и окисление пятичленных гетероциклических соединений.
- •Реакции гидрирования
- •Реакция окисления
- •Другие реакции пятичленных гетероциклических соединений
- •Фурфурол, особенности его химического поведения
- •Важнейшие производные пиррола
- •Индол и его важнейшие производные
- •Способы получения индола
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Пиразол (1,2-диазол)
- •Имидазол (1,3-диазол)
- •Тиазол (1-тиа-3-азол)
- •Шестичленные гетероциклические соединения
- •Пиридин (азин)
- •Биологически активные соединения пиридинового ряда
- •Понятие о хинолине, изохинолине, акридине
- •Хинолин
- •Изохинолин
- •Акридин
- •Шестичленные гетероциклические соединения с двумя атомами азота
- •Пиримидин, пиримидиновые основания
- •5.2 Пурин, пуриновые основания
- •Понятие о нуклеозидах и нуклеотидах
- •Шестичленные кислородсодержащие гетероциклические соединения неароматического характера и их природные производные
- •Кумарин (-бензопирон)
- •Хромон (-бензопирон)
- •Литература
5.2 Пурин, пуриновые основания
Б ициклическая
система пурина состоит из двух гетероциклов
– пиримидина и имидазола, сконденсированных
между собой. Открыл пурин немецкий химик
Э. Фишер. Производные пурина имеют
исключительное биологическое значение
прежде всего потому, что входят вместе
с пиримидиновыми основаниями в структуру
нуклеиновых кислот и имеют, таким
образом, отношение к программированию
синтеза белков и к явлениям наследственности.
ициклическая
система пурина состоит из двух гетероциклов
– пиримидина и имидазола, сконденсированных
между собой. Открыл пурин немецкий химик
Э. Фишер. Производные пурина имеют
исключительное биологическое значение
прежде всего потому, что входят вместе
с пиримидиновыми основаниями в структуру
нуклеиновых кислот и имеют, таким
образом, отношение к программированию
синтеза белков и к явлениям наследственности.
К таким соединениям относится аденозинтрифосфат (АТФ) – переносчик энергии в биохимических реакциях и фосфорилирующий агент.
Пурин является ароматической системой с энергией делокализации, равной 243,6 кДж/моль (для бензола – 150,7 кДж/моль). Пиримидиновое кольцо в пурине в целом имеет дефицит электронов, а имидазольное кольцо – избыток электронов. Поскольку в пурине имеет место перекрывание -электронных облаков двух моноциклических систем, то электронная плотность в каждом цикле в определенной степени может изменяться в результате перехода электронов из имидазольного цикла в пиримидиновый.
Таким образом, пурин – это ароматическая система сильно делокализованных -электронов, обладающая лабильной «переливающейся» электронной плотностью, в результате чего возможны таутомерные превращения. Кроме этого, эта система является прекрасным донором электронов вследствие низкой энергии высшей заполненной молекулярной орбитали.
Электронодонорные заместители в кольце пиримидина способствуют восстановлению электронной плотности в имидазольном цикле. Реакции нуклеофильного замещения в пурине идут в основном в положение 8 имидазольного кольца, но возможна атака нуклеофильными реагентами атомов углерода в положениях 2 и 6 пиримидинового цикла. Реакции электрофильного замещения возможны лишь при наличии электронодонорных заместителей в кольце пиримидина, и замещение происходит по углероду С8 имидазольного цикла.
Все реакции пуриновых соединений можно разделить на две группы: реакции по атомам азота и реакции по атомам углерода кольца. Пуриновые основания – сравнительно слабые основания, но электрофильная атака по атому азота весьма распространена, причем выбор атома азота при электрофильной атаке определяется степенью основности того или иного атома азота. В незамещенном пурине таким является N1, в мочевой кислоте алкилированию сначала подвергается N9, а затем N3 и N1; в кислой среде алкилирование замещенных пуринов происходит в основном в положение 9. Аденин, единственный их всех пуринов, показывает небольшую реакционную способность в положении 3.
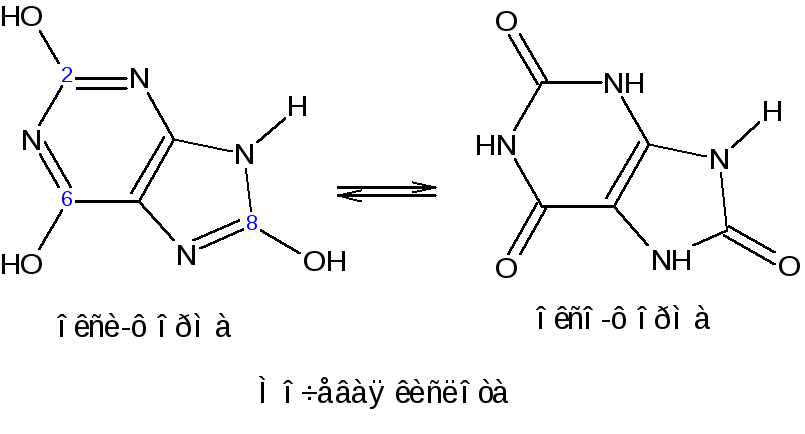
Одним из ключевых соединений в синтезе пуриновых оснований служит мочевая кислота (2, 6, 8-тригидроксипурин), играющая у птиц и рептилий роль вещества, выводящего из организма избыток азота (как мочевина у млекопитающих). Соли мочевой кислоты (ураты) откладывается при неправильной работе организма в суставах и в виде почечных камней.
Аденин (6-аминопурин) является одним из наиболее распространенных пуриновых оснований:

Аденин существует практически в амино-форме, т.к. энергия делокализации для амино-формы наибольшая. В связанном виде аденин содержится в нуклеиновых кислотах и легко получается при их гидролизе. В свободном состоянии встречается в некоторых растениях (чай, сахарная свекла, хмель), в грибах, дрожжах, бактериях и т.д. Аденин является наиболее устойчивым в термодинамическом отношении соединением среди природных пуриновых и пиримидиновых оснований.
Гуанин, 2-амино-6-гидроксипурин вместе с аденином и пиримидиновыми основаниями входит в состав нуклеиновых кислот:

Наиболее устойчивой является лактамная форма, в которой гуанин и находится в природных нуклеиновых кислотах. Значительные количества гуанина содержатся в чешуе и коже рыб, пресмыкающихся и амфибий, от чего зависит их блеск.
Ксантин, 2,6-дигидроксипурин образуется в результате распада нуклеозидмонофосфатов: гуанинмонофосфата и аденинмонофосфата, существует, главным образом, в оксо-форме:

Гипоксантин, 6-гидроксипурин образуется при расщеплении аденинмонофосфата, также существует в оксо-форме:

Под действием фермента ксантиноксидазы гипоксантин затем окисляется в ксантин.
