
- •Пространственная изомерия
- •Содержание
- •Введение
- •1 Исторический очерк
- •2 Геометрия простых молекул
- •2.1 Алканы. Поворотная изомерия, конформации
- •2.2 Алкены. Геометрическая (цис-, транс-) изомерия, конфигурации
- •2.3 Пространственное строение циклоалканов
- •3 Оптическая изомерия
- •3.1 Энантиомеры
- •3.2 Диастереомеры
- •3.3 Знак вращения и конфигурация
- •3.4 Проекционные формулы. Номенклатура стереоизомеров
- •3.5 Рацемические модификации. Расщепление рацематов
- •4 Решение задач по стереоизомерии
- •Пространственная изомерия органических соединений
- •2120027, Могилев, пр-т Шмидта, 3.
2 Геометрия простых молекул
2.1 Алканы. Поворотная изомерия, конформации
В молекулах предельных углеводородов и их производных вращение вокруг простых связей не вполне свободно, т.к. молекулы при вращении переходят из одной формы в другую, отличающуюся энергией. Отдельные состояния, через которые проходят молекулы в процессе вращения и отличающиеся расположением заместителей у атомов углерода, связанных простой связью, относительно которой происходит вращение, называются конформациями.
Конформации переходят друг в друга без разрыва химических связей, а
только вращением вокруг простой
![]() связи и отличаются энергией.
связи и отличаются энергией.
Например, для этана известны две конформации – заторможенная и заслоненная, имеющие энергетический барьер около 3 ккал/моль. Однако выделить их не удается, так как теплового движения достаточно, что бы они могли переходить друг в друга. Изомеры, возникающие при вращении атомных группировок вокруг простой σ-связи, называют поворотными, а изомерия – поворотной, вращательной изомерией. Они представляют одно и то же вещество и имеют одну и ту же структурную формулу.
Заторможенная конформация для этана оказывается более выгодной, вследствие взаимного отталкивания электронных оболочек атомов водорода. При комнатной температуре большинство молекул этана существует в заторможенной конформации.

Заторможенная конформация

Заслоненная конформация
Для дибромэтана заторможенная форма молекулы выгоднее уже на 19 кДж/моль, а кроме этого появляется еще одна конформация – скошенная конформация.

Чем ниже температура, тем меньше энергия теплового движения, тем больше молекул находится в виде более устойчивого поворотного изомера (конформации).
Кривая изменения потенциальной энергии дибромэтана (ДБЭ) при изменении поворота (φ)

Минимум энергии соответствует заторможенной конформации, т.е. термодинамически наиболее устойчивому поворотному изомеру. Аналогичную кривую можно начертить и для бутана:

В проекции Ньюмена молекулу рассматривают вдоль С – С-связи, относительно которой происходит вращение. Три линии, расходящиеся под углом 1200из центра круга, обозначают связи ближайшего к наблюдателю углеродного атома; линии «высовывающиеся» из-за круга – связи удаленного углеродного атома.
Однако уже в пентане надо учитывать вращение вокруг двух «внутренних» связей С – С. По мере усложнения молекул число возможных конформаций возрастает, а графическое изображение их становится сложным.
2.2 Алкены. Геометрическая (цис-, транс-) изомерия, конфигурации
Важное следствие жесткости двойной связи (отсутствие вращения вокруг нее) – существование геометрических изомеров.
Геометрическая или цис-, транс-изомерия обусловлена различным расположением неодинаковых заместителей относительно двойной связи.
Простейшииим примером могут служить изомеры бутена-2:
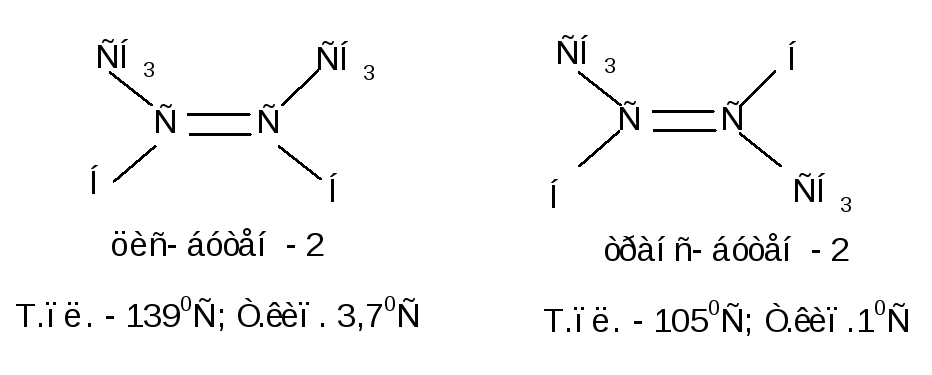
Геометрические изомеры имеют одинаковый порядок химической связи атомов, различаясь по их пространственному расположению, по конфигурации. Это различие и создает разницу в физических, а также и в химических свойствах; цис-транс-изомеры обычно сильно отличаются по своим физическим свойствам. Например, дипольный момент транс-дихлорэтилена СНСl= СНСlравен нулю, так как диполи С – Сlнаправлены в противоположные стороны и взаимно компенсируются; в то же время дипольный момент цис-изомера равен 1,89 Д. Это различие можно использовать для установления конфигурации. цис-транс-изомеры имеют разные температуры плавления (обычно температура плавления транс-изомера выше), температуры кипения, показатели преломления и плотности (обычно выше для изомера с большим дипольным моментом), кислотность, ультрафиолетовые, инфракрасные и ЯМР-спектры и т.д.
В случае бутена-2 СН3 ~ СН = СН3и других этиленов с углеродными заместителями, таких как кротоновая кислота СН3СН = СНСООН, транс-изомер устойчивее цис-изомера. Вероятно, причиной этого являются пространственные факторы.
Определенное расположение атомов в пространстве, ведущее к наличию стереоизомерии, называется конфигурацией.
Геометрические изомеры могут быть выделены в чистом виде и существуют как индивидуальные, устойчивые вещества. Для их взаимного превращения необходима энергия порядка 130-170 кДж/моль (нагревание, УФ – облучение и др.).
Цис- и транс- изомерия встречается у полимеров цис-полиизопрен (натуральный каучук) и транс-полизопрен (гуттаперча), в растительных маслах, где остатки молекул ненасыщенных кислот( олеиновой, линолевой, линоленовой, арахидоновой) находятся в цис-конфигурации, что предопределяет их соответствующие биологические свойства.
