
- •1) Ковалентные связи
- •1.1 Ковалентные пептидные связи
- •1.2 Ковалентные связи -s-s-.
- •2.1 Водородные связи внутри полипептидной цепи.
- •2.3 Водородные связи между боковой группой и полипептидной цепью.
- •4) Электростатические взаимодействия между ионными центрами боковых групп.
- •4) Ван- дер- ваальсовы силы
- •1. Электрохимические свойства белков
- •2. Гидрофильность белков
- •3. Осаждение белков
- •4. Денатурация белков
3. Осаждение белков
Гидрофильность белков является важнейшим фактором устойчивости их растворов. Если в такой раствор внести какую-либо нейтральную соль, то белки выпадают в осадок. Механизм осаждения состоит в том, что анионы и катионы вносимой в раствор белка соли, имеющие достаточно большие электростатические заряды, интенсивно гидратируются диполями воды. Между гидрофильной поверхностью белковой молекулы и ионами соли развивается конкуренция за обладание молекулами воды. Более мощные электростатические силы соли снимают гидратную оболочку с поверхности белковой молекулы. Лишенные гидратных оболочек белковые молекулы при броуновском движении сталкиваются между собой, агрегируются и, в конечном счете, выпадают в осадок (рис. 1.12). При внесении нейтральной соли снижается также диэлектрическая проницаемость воды.
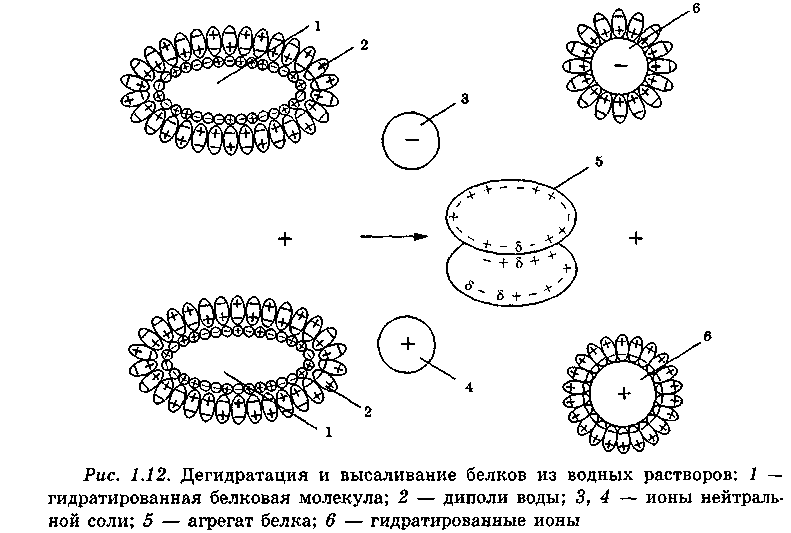
Сильной гидратационной способностью обладают также некоторые органические растворители (этанол, ацетон, пропанол, изопропанол); они также осаждают белки из водных растворов. Осаждение белков является обратимым процессом. Оно нашло широкое применение при их фракционировании. В основу этой операции положены различия в размерах гид-ратной оболочки: чем плотнее электрические заряды на поверхности белковой молекулы, тем выше гидрофильность поверхностного слоя молекулы, тем больше потребуется нейтральной соли для осаждения данного белка. Таким образом, внося в раствор, содержащий смесь различных белков, нейтральную соль порционно, но все в более возрастающем количестве, белки можно разделить на отдельные фракции. На эффект фракционирования существенное влияние оказывает величина рН: она должна быть близка к изоэлектрической точке белка.
4. Денатурация белков
Н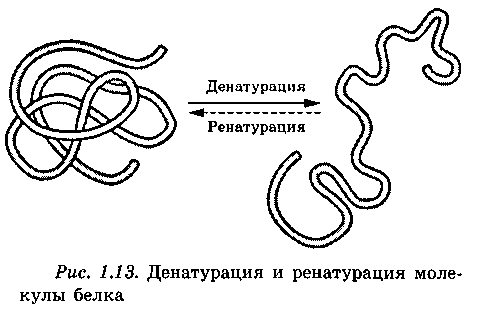 ативная
(естественная) конформация глобулярного
белка, обладая высокой лабильностью,
подвержена глубоким изменениям под
действием жестких физико-химических
факторов среды. Эти изменения получили
названиеденатурации
белка.
Денатурация является следствием
нарушения уникальной конформации
(вторичной, третичной, четвертичной
структур) нативного белка с сохранением
его первичной структуры. Типичным
примером денатурации является свертывание
яичного альбумина при варке яиц. При
денатурации белок изменяет свои
физические, химические свойства и теряет
биологическую функцию. Полипептидная
цепь при этом развертывается и
превращается в беспорядочный,
хаотический клубок (рис. 1.13).
ативная
(естественная) конформация глобулярного
белка, обладая высокой лабильностью,
подвержена глубоким изменениям под
действием жестких физико-химических
факторов среды. Эти изменения получили
названиеденатурации
белка.
Денатурация является следствием
нарушения уникальной конформации
(вторичной, третичной, четвертичной
структур) нативного белка с сохранением
его первичной структуры. Типичным
примером денатурации является свертывание
яичного альбумина при варке яиц. При
денатурации белок изменяет свои
физические, химические свойства и теряет
биологическую функцию. Полипептидная
цепь при этом развертывается и
превращается в беспорядочный,
хаотический клубок (рис. 1.13).
При денатурации белок из гидрофильного состояния переходит в гидрофобное, в котором его молекулы могут оставаться в растворе только при наличии какого-либо стабилизирующего фактора, например, электрического заряда. В противном случае при броуновском движении молекулы белка, сталкиваясь, агрегируются и в виде хлопьев выпадают в осадок. В изоэлектрической точке денатурация протекает медленнее и ускоряется в кислых и щелочных растворах.
Факторы, вызывающие денатурацию белка, можно подразделить на физические и химические. К физическим факторам относятся нагревание, механическое перемешивание, ультразвук, ультрафиолетовое и ионизирующее излучения; к химическим — кислоты, щелочи, соли тяжелых металлов, мочевина, таннин, ди- и трихлоруксусная кислота, гуанидинхлорид, гуанидинсульфат, лаурилсульфат и др.
Тепловая денатурация является одним из характерных признаков белков. Однако для различных белков она различна. Многие белки, особенно животного происхождения, термолабильны: процесс их денатурация начинается уже при 40 °С и быстро ускоряется с повышением температуры. Однако известны белки, устойчивые к нагреванию, например, трипсин, химо-трипсин, некоторые белки мембраны. Особенно устойчивы белки термофильных микроорганизмов. Следует отметить, что компактно свернутые пептидные цепи нативного белка не разворачиваются до тех пор, пока в пространство между цепями не попадет вода. Поэтому сухие белки (например, гемоглобин, яичный альбумин) более устойчивы к тепловой денатурации, чем белки в растворе. По той же причине большей устойчивостью обладают концентрированные белковые растворы по сравнению с разбавленными.
Некоторые химические соединения оказывают на белки защитное действие. Так, денатурация тормозится концентрированными растворами глицерина, глюкозы и других Сахаров, что связано, видимо, с их адсорбцией на глобулах белков и образованием крупных гидрофильных комплексов.
Процесс денатурации белков играет большую роль в технологии пищевых продуктов при их тепловой обработке. При выпечке хлебобулочных изделий примерно при 60—70°С белки теста (клейковина) денатурируют; этот процесс имеет большое значение в формировании мякиша изделия. Обработка свекловичной стружки водой при температуре 70—80 °С, осуществляемая при получении диффузионного сока, вызывает денатурацию белков мембран и протоплазмы клеток свекловичной стружки и резко повышает скорость диффузии сахарозы из нее. Бланшировка плодов и овощей перед их консервированием вызывает денатурацию (инактивацию) окислительных ферментов, ведет к сохранению витамина С. Тепловая обработка пищевых продуктов повышает их вкусовые качества, а также биологическую ценность, поскольку денатурированные белки обладают лучшей атакуемостью пищеварительными ферментами.
