
Цитохромы
.docxЦитохромы, сложные железосодержащие белки, простетическая (небелковая) группа которых представлена гемом (гемопротеиды). Впервые описаны в 1886 Мак-Манном (Шотландия) под название гистогематины, однако роль их в живых клетках оставалась невыясненной до 1925, когда Ц. были вновь открыты Д. Кейлином. Ц. широко распространены в растительных и животных клетках и микроорганизмах (дрожжах и некоторых факультативных анаэробах) и связаны с мембранами митохондрий, эндоплазматического ретикулума, хлоропластов и хроматофоров. Они играют важную роль во многих процессах, протекающих в живых организмах, — клеточном дыхании, фотосинтезе, микросомальном окислении. Все Ц. способны отдавать и принимать электрон путём обратимого изменения валентности атомов железа, входящих в состав гема. Объединённые в короткие или длинные цепи (в зависимости от величины потенциала конечного акцептора электронов) Ц. переносят электроны от дегидрогеназ к конечным акцепторам. Передача электронов от Ц. к Ц. позволяет клетке использовать энергию химических соединений или солнечного света в энергетических или пластических целях. Так, в составе цепи дыхательных ферментов митохондрий Ц. при участии цитохромоксидазы осуществляют конечные этапы окисления субстратов кислородом. Освобождающаяся при этом энергия утилизируется для образования аденозинтрифосфорной кислоты (АТФ) или в виде мембранного потенциала; Ц. эндоплазматического ретикулума составляют короткие нефосфорилирующие цепи, являющиеся частью системы, осуществляющей обмен и обезвреживание ароматических соединений (см. Окисление биологическое, Окислительное фосфорилирование).
По спектральным характеристикам, химическому строению боковых цепей гема и природе связи гема с белковой молекулой Ц. подразделяют на 4 типа: а, b, с, d, каждый из которых, в свою очередь, содержит несколько видов Ц. Те Ц., индивидуальность которых установлена, обозначают курсивной строчной буквой лат. алфавита, указывающей на принадлежность к определённой группе, и подстрочным числовым индексом (например, цитохром c1). В восстановленном состоянии Ц. дают чёткий спектр с тремя выраженными полосами поглощения, характерными для каждого типа Ц. и позволяющими обнаружить Ц. спектрофотометрическими методами. Известно около 30 Ц., но только часть из них получена в виде индивидуальных белков. Получение высокоочищенных Ц. затруднено тем, что они прочно связаны с мембранами и отделяются только при обработке поверхностно-активными веществами или протеолитическими ферментами. Исключение составляют цитохромы b3 и с, легко экстрагируемые солевыми растворами. Сравнение последовательности аминокислот в белковой части молекул цитохрома с, полученного из различных организмов, показало, что последовательность 35 и 11 аминокислотных остатков в разных участках цепи остаётся неизменной. Количество замен в др. участках белковой цепи этого Ц., полученного из организмов различных видов, находится в прямой зависимости от филогенетических различий между этими видами (молекулы цитохромов с лошади и дрожжей различаются по 48 аминокислотным остаткам, утки и курицы — только по двум; у свиньи, коровы и овцы они идентичны).
Лит.: Арчаков А. И., Микросомальное окисление, М., 1975; Ленинджер А., Биохимия. Молекулярные основы структуры и функций клетки, пер. с англ., М., 1976.
В. В. Зуевский.
Цитохромы
сложные белки — переносчики электронов, простетич. группа к-рых представлена гемом. Содержатся в клетках всех организмов. Локализованы в мембранах митохондрий, хлоропластов, хроматофоров, эндоплазматич. ретикулума и в др. мембранных структурах, участвуют во всех осн. группах окислит.-восстановит, процессов, протекающих в живых клетках,— дыхании, фотосинтезе, микросомальном окислении. Как правило, образуют т. н. цепи, по к-рым электроны последовательно переносятся от донора к конечному акцептору. При функционировании Ц. и переносе восстановит, эквивалентов обратимо изменяется уровень окисления простетич. группы (Fe(II) ? Fe(III)). Электрон-транспортные цепи в хлоропластах, митохондриях и прокариотич. микроорганизмах участвуют в обеспечении клетки энергией за счёт энергии света (при фотосинтезе) или окисления субстрата (при дыхании). В мембранах эндоплазматич. ретикулума электрон-транспортные цепи обычно короче и выполняют функцию обезвреживания ароматич. соединений в ходе микросомального окисления. Известно св. 30 Ц. (часть Ц. получена в виде индивидуальных белков), объединённых в 4 осн. группы: Ц. а — простетич. группой служит гем с формильной боковой цепью; Ц. в — простетич. группа протогем или родственный ему гем, не имеющий формильной группы; Ц. с — простетич. группы ковалентно присоединены к белку; Ц. d — простетич. группой служит хелат железа, в к-ром степень сопряжённости двойных связей меньше, чем в порфирине. Помимо Ц. указанных 4 групп, имеются Ц. Р-450 и h. Ряд Ц.— внутренние, или интегральные, мембранные белки, что затрудняет их выделение в высокоочищенном виде и изучение их первичной структуры. Другие Ц.— внеш. мембранные белки (напр., Ц. с) — подробно охарактеризованы для мн. объектов. Сопоставление аминокислотных последовательностей однотипных Ц.. выделенных из разл. организмов, с помощью спец. программ на ЭВМ позволяет количественно охарактеризовать нек-рые эволюционные явления: темпы мутационного процесса, филогенетич. близость, степень эволюционной изменчивости отд. участков белковой молекулы в связи с их функц. нагрузкой и др. В эволюции биосферы появление Ц. резко усилило геохимич. активность живого вещества. С одной стороны, Ц. увеличили скорость и масштабы образования свободного кислорода при фотосинтезе, с другой — размах биол. окисления восстановленных соединений углерода и неорганич. веществ. Они позволили сформировать эффективную систему энергообеспечения клетки, что способствовало появлению эукариотного типа организации клетки и затем — выходу жизни на сушу
Цитохромы (синоним: миогематины, гистогематины) — гемопротеиды, биологическая функция которых заключается в переносе электронов и осуществляется (в процессе тканевого дыхания) путем обратимого изменения валентности атомов железа, входящих в состав гема (см. Гемоглобин). В зависимости от конфигурации простетической группы цитохромы делятся на четыре типа (каждый из которых в свою очередь содержит несколько видов цитохромов): цитохромы a, b, c, d. Соответствующие им простетические группы: железо-формил-порфирин (гем А или родственный ему гем с формильной боковой цепью); протогем (железо-протопорфирин); замещенный мезогем; железо-дигидропорфирин. В восстановленном состоянии цитохромы дают четкий спектр с тремя полосами поглощения (а, р и у), характерными для каждого типа цитохромов и позволяющими обнаружить цитохромы спектрофотометрическими методами. Цитохромы найдены во всех животных и растительных клетках, а также в дрожжах и в некоторых факультативных анаэробах. Роль многих цитохромов в организме еще неизвестна, хотя некоторым приписывают высокоспециализированные функции. Важнейшей функцией цитохромов нужно считать их связь с нормальной окислительной цепью в процессе дыхания большинства тканей. Общепризнанным в настоящее время считается следующее расположение цитохромов в цепи переносчиков электронов: b — c1 — с — а — а3 — О2. У бактерий часто отсутствуют отдельные компоненты полной цитохромной системы, присущей животным и растительным тканям; в некоторых случаях вместо них обнаружены другие цитохромы, отсутствующие в животном и растительном организмах. Основные компоненты цитохромной системы локализованы в митохондриях. В микросомах животных клеток обнаружен цитохром b5; в растительных микросомах — b3; в хлоропластах растений — b6. Цитохромы плохо растворимы в воде; их растворимость повышается при обработке исходного материала, содержащего цитохромы, поверхностно-активными веществами. Имеющиеся в настоящее время данные указывают на то, что основная часть энергии биологического окисления освобождается в результате реакций, катализируемых цитохромной системой. Характеристика некоторых цитохромов. Цитохром c получен в кристаллическом виде. Молекулярный вес — 12 000. В организме находится как в свободном, водорастворимом, состоянии, так и в связанном с клеточными частицами. Окисленный цитохром с восстанавливается химическими реагентами, например гидросульфитом и др. В тканях организма восстановление может осуществляться за счет ферментов, называемых цитохромредуктазами. Относятся они к флавопротеидам. Различают два типа: окисляющие НАД восстановленный (восстановленный НАД-цитохром-С-редуктазы) и НАДФ восстановленный (восстановленный НАДФ-цитохром-С-редуктазы). Цитохром a3 (цитохромоксидаза; цитохром-с : O2-оксидоредуктаза; Варбурга дыхательный фермент) — фермент, переносящий электроны от цитохрома c на O2. Содержит медь. Вопрос о самостоятельном существовании цитохромов a и a3 является спорным. Предполагается даже, что оба соединения представляют собой один и тот же белок. Недавно получены данные, указывающие на то, что цитохромоксидаза, возможно, состоит из шести единиц, две из которых эквивалентны цитохрому a3, а четыре — цитохрому a. В гистохимии цитохромоксидаза определяется по нади-реакции: α-нафтол + диметил-α-фенилендиамин + 4 цитохром c спонтанно → индофеноловый синий + 4 цитохром с (восстановленный) цитохромоксидаза + кислород → цитохром c + Н2O. Результатом является возникновение синего или сине-фиолетового окрашивания. См. также Окисление биологическое.
ЦИТОХРОМ с-ОКСИДАЗА
Яндекс.Директ
Все
объявления![]() Зимняя
одежда KLINGEL
Утепляйтесь вместе с KLiNGEL. Каталог теплой
одежды из Германии. klingel.ru
Зимняя
одежда KLINGEL
Утепляйтесь вместе с KLiNGEL. Каталог теплой
одежды из Германии. klingel.ru
ЦИТОХРОМ с-ОКСИДАЗА(цитохромоксидаза), фермент класса оксидоредуктаз; катализирует конечный этап переноса электронов на кислород в процессе окислительного фосфорилирования:
![]()
Окисление
цитохрома
ссопровождается
появлением мембранного протонного
потенциала![]() ,
к-рый используется клеткой
для обеспечения всех видов работ,
выполняемых биомембранами, и в первую
очередь для синтеза
АТФ.
Фермент
широко распространен как среди эукариот,
так и среди прокариот.
У эукариот
фермент
расположен во внутр. мембране
митохондрий,
у прокариот
- в цитоплазматич. мембране.Цитохром
c-оксидаза- сложный белок,
состоящий из неск. полипептидных цепей,
связанных с4 окислит.-восстановит.
центрами, 2 ионами
Си2+
и 2 гемами
а(см. ф-лу).
,
к-рый используется клеткой
для обеспечения всех видов работ,
выполняемых биомембранами, и в первую
очередь для синтеза
АТФ.
Фермент
широко распространен как среди эукариот,
так и среди прокариот.
У эукариот
фермент
расположен во внутр. мембране
митохондрий,
у прокариот
- в цитоплазматич. мембране.Цитохром
c-оксидаза- сложный белок,
состоящий из неск. полипептидных цепей,
связанных с4 окислит.-восстановит.
центрами, 2 ионами
Си2+
и 2 гемами
а(см. ф-лу).
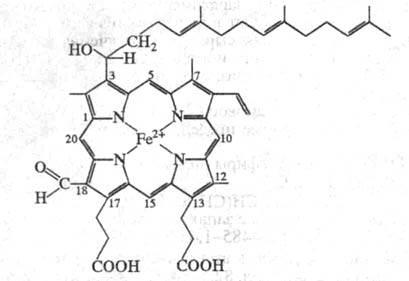
Мол.
масса фермента
(напр., цитохром
c-оксидаза из сердца быка) составляет
от 180 до 200 тыс. Цитохром
c-оксидаза обычно существует в димерной
форме и прочно ассоциирована с молекулами
фосфолипидов
мембран
и ПАВ, использованных при ее выделении.
Цитохром
c-оксидаза имеет характерный спектр
поглощения;![]() нм
(
нм
(![]() -10-3):восстановленная
форма 443 (107), 603 (23,2); окисленная форма
-421 (82), 598 (11).
Железо
гемов
может находиться в окисленном или
восстановленном состоянии и образует
координац. связи с одним либо двумя
аминокислотными остатками белковой
цепи. В зависимости от белкового окружения
гемы
различаются по св-вам: один (гем
а3),высокоспиновый,
после восстановления
реагирует с О2
или СО,CN. Другой (гем
а), низкоспиновый, в такие р-ции не
вступает. Ионымеди
в цитохром
c-оксидазе также неравноценны. Один из
них, СuА,
дает сигнал в спектре ЭПР
и взаимод. с гемом
a, другой, Сuв,
не дает сигналов, взаимод. с гемом
а3.
Число полипептидных цепей в ферменте
зависит от эволюционной ступени,
занимаемой организмом
- источникомцитохром
c-оксидазы. Фермент
прокариот
включает 2-3 белковые цепи, эукариоты
содержат цитохром
c-оксидазы из 5 (соя, батат) или 7-8 субъединиц
(дрожжи). У млекопитающих число
субъединицфермента
возрастает до 12-13. Все полипептиды
в цитохром
c-оксидазах различны по структуре и
имеют мол. м. от 5 до 57 тыс. Три наиб.
крупные субъединицы (I-III; рис.).Цитохром
c-оксидазы эукариот
кодируются в митохондриальном
геноме
и синтезируются на митохондриальных
рибосомах.
Эти субъединицы играют главную роль в
выполнении биол.
ф-цийцитохром
c-оксидаз. Они связаны со всеми
окислит.-восстановит. центрами и имеют
участки узнавания цитохрома
с.
Остальные субъединицы цитохром
c-оксидазы кодируются в ядерномгеноме
и синтезируются в цитоплазме.
Ф-ции этих полипептидов,
вероятно,связаны с регуляцией активности
цитохром
c-оксидазы и могут отражать также тканевую
специфичностьфермента.
Первичная структура полипептидов
наиб. изученных ферментов
(бык,крыса, Saccharomyces cerevisiae)полностью
известна.
-10-3):восстановленная
форма 443 (107), 603 (23,2); окисленная форма
-421 (82), 598 (11).
Железо
гемов
может находиться в окисленном или
восстановленном состоянии и образует
координац. связи с одним либо двумя
аминокислотными остатками белковой
цепи. В зависимости от белкового окружения
гемы
различаются по св-вам: один (гем
а3),высокоспиновый,
после восстановления
реагирует с О2
или СО,CN. Другой (гем
а), низкоспиновый, в такие р-ции не
вступает. Ионымеди
в цитохром
c-оксидазе также неравноценны. Один из
них, СuА,
дает сигнал в спектре ЭПР
и взаимод. с гемом
a, другой, Сuв,
не дает сигналов, взаимод. с гемом
а3.
Число полипептидных цепей в ферменте
зависит от эволюционной ступени,
занимаемой организмом
- источникомцитохром
c-оксидазы. Фермент
прокариот
включает 2-3 белковые цепи, эукариоты
содержат цитохром
c-оксидазы из 5 (соя, батат) или 7-8 субъединиц
(дрожжи). У млекопитающих число
субъединицфермента
возрастает до 12-13. Все полипептиды
в цитохром
c-оксидазах различны по структуре и
имеют мол. м. от 5 до 57 тыс. Три наиб.
крупные субъединицы (I-III; рис.).Цитохром
c-оксидазы эукариот
кодируются в митохондриальном
геноме
и синтезируются на митохондриальных
рибосомах.
Эти субъединицы играют главную роль в
выполнении биол.
ф-цийцитохром
c-оксидаз. Они связаны со всеми
окислит.-восстановит. центрами и имеют
участки узнавания цитохрома
с.
Остальные субъединицы цитохром
c-оксидазы кодируются в ядерномгеноме
и синтезируются в цитоплазме.
Ф-ции этих полипептидов,
вероятно,связаны с регуляцией активности
цитохром
c-оксидазы и могут отражать также тканевую
специфичностьфермента.
Первичная структура полипептидов
наиб. изученных ферментов
(бык,крыса, Saccharomyces cerevisiae)полностью
известна.
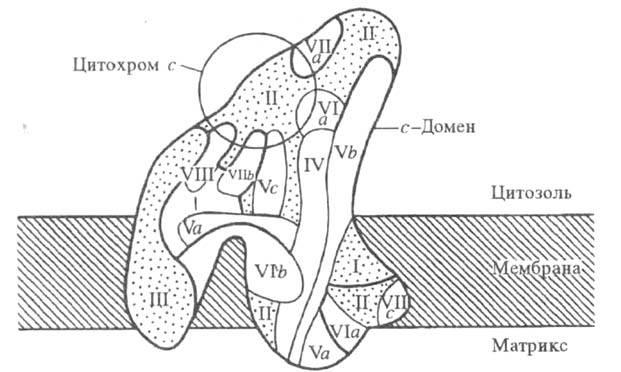
Модель
структурной н функциональной
организацииполипептидов
в цитохромоксидазе из печени
крысы. Римскими цифрами и буквами
обозначены отдельные субъединицы
фермента.
Цитохром
c-оксидаза- мембранный фермент.
с-Домен ферментавыступает
из плоскости мембраны
с цитоплазматич. стороны на 0,50-0,55 нм;с
матричной стороны выступают на 0,15-0,25
нм два домена,
к-рые состоят из спирализованных участков
полипептидных цепей и включают 8-12 и 5-8
спиралей,соотв.
Цитохром
с
взаимод. с
цитохром
c-оксидазой, связываясь с субъединицей
П. Цепочка, по к-рой электроны
передаются к кислороду,
м.б. представлена схемой: Цитохром
с![]() СuА
СuА![]() Гема
Гема![]() Гема3-СuВ
+ О2.
Переносэлектрона
сопровождается трансмембранным переносом
двух протонов
из матрикса в цитозольное пространство
и появлением
Гема3-СuВ
+ О2.
Переносэлектрона
сопровождается трансмембранным переносом
двух протонов
из матрикса в цитозольное пространство
и появлением![]() .Такой
механизм позволяет отнести цитохром
c-оксидазу к мембранным протонным
насосам.
Для
выделения цитохром
c-оксидазы из митохондрий
или субмитохондриальных частиц используют
ПАВ, чаще всего холат или дезоксихолат
натрия.
Обычно чистоту цитохром
c-оксидазы выражают через отношение
содержания гема
а к кол-ву белка.Для
препаратов фермента,
выделенных разл. способами, этот
показатель составляет8-14 нмоль/мг.
Определить точное значение этой величины
пока невозможно из-за отсутствия надежных
данных о числе субъединиц, действительно
необходимых для функционирования
фермента.
Важная
характеристика цитохром
c-оксидазы - ферментативнаяактивность,
к-рая определяется спектрофотометрически
(по уменьшению поглощения ферроцитохрома
с) либо полярографически (по изменению
концентрацииО2
в среде); она может достигать 400 моль
цитохрома
с
намоль
цитохром
c-оксидазы в секунду. Активность
фермента
сильно зависит от кол-ва липидовв
препарате. При тщательном удалении
липидов
ферментативная активностьрезко
снижается, но после добавления липидов
частично восстанавливается.
Цитохром
c-оксидаза необходима для обеспечения
жизнедеятельности всех эукариотич. и
нек-рых прокариотич. клеток.
Нарушение биосинтеза
цитохром
c-оксидазы в клетках
человека приводит к их гибели. Структурные
и функциональные измененияфермента
являются причиной серьезных заболеваний.
.Такой
механизм позволяет отнести цитохром
c-оксидазу к мембранным протонным
насосам.
Для
выделения цитохром
c-оксидазы из митохондрий
или субмитохондриальных частиц используют
ПАВ, чаще всего холат или дезоксихолат
натрия.
Обычно чистоту цитохром
c-оксидазы выражают через отношение
содержания гема
а к кол-ву белка.Для
препаратов фермента,
выделенных разл. способами, этот
показатель составляет8-14 нмоль/мг.
Определить точное значение этой величины
пока невозможно из-за отсутствия надежных
данных о числе субъединиц, действительно
необходимых для функционирования
фермента.
Важная
характеристика цитохром
c-оксидазы - ферментативнаяактивность,
к-рая определяется спектрофотометрически
(по уменьшению поглощения ферроцитохрома
с) либо полярографически (по изменению
концентрацииО2
в среде); она может достигать 400 моль
цитохрома
с
намоль
цитохром
c-оксидазы в секунду. Активность
фермента
сильно зависит от кол-ва липидовв
препарате. При тщательном удалении
липидов
ферментативная активностьрезко
снижается, но после добавления липидов
частично восстанавливается.
Цитохром
c-оксидаза необходима для обеспечения
жизнедеятельности всех эукариотич. и
нек-рых прокариотич. клеток.
Нарушение биосинтеза
цитохром
c-оксидазы в клетках
человека приводит к их гибели. Структурные
и функциональные измененияфермента
являются причиной серьезных заболеваний.
