
ФИЗИКА3 БОЛЬШЕ ГОТОВОГО1 / 1-st / Механика / alexlab18
.docМинистерство образования Российской Федерации
Санкт-Петербургский государственный горный институт
имени Г.В. Плеханова (технический университет)
Кафедра общей и технической физики
ЛАБОРАТОРИЯ МЕХАНИКИ
РАБОТА 18
определение отношения теплоемкости при постоянном давлении к теплоемкости при постоянном объеме для воздуха методом адиабатического расширения
Выполнил: студент 1 курса, геологоразведочного факультета,
группы РФ-02, Гончаров А.Е.
Проверил: Мезенцев А.П.
САНКТ – ПЕТЕРБУРГ
2003
Цель работы – изучить законы идеального газа и основные положения классической теории теплоёмкости; определить коэффициент Пуассона - отношение теплоёмкости при постоянном давлении Ср к теплоемкости при постоянном объеме CV методом адиабатического расширения (методом Клемана - Дезорма).
Общие сведения
Количество тепла,
которое необходимо сообщить одному молю
вещества, чтобы повысить его температуру
на 1 К, называют молярной теплоемкостью.
![]() (M
– масса газа,
- масса моля). Как показывают и теория,
и опыт, теплоемкость зависит от условий,
при которых нагревается газ, т.е. от
характера термодинамического процесса.
(M
– масса газа,
- масса моля). Как показывают и теория,
и опыт, теплоемкость зависит от условий,
при которых нагревается газ, т.е. от
характера термодинамического процесса.
Любой политропический процесс, т.е. термодинамический процесс, идущий при неизменной теплоёмкости, может быть описан уравнением вида
pV n = const, (1)
где р - давление газа; V - его объем; n - показатель политропы, принимающий в зависимости от характера процесса значения в диапазоне - < n < . Для изохорического процесса n = , для изобарического n = 0; для изотермического n = 1, для адиабатического n = Ср/СV.
Из первого начала термодинамики Q = dU + A с использованием определения молярной теплоемкости имеем (для одного моля газа)
![]() (2)
(2)
где i - число степеней свободы молекулы.
Продифференцируем уравнение (1), учитывая изменение p и V. Принимая во внимание уравнение состояния идеального газа для одного моля рV = RT, получим
![]() (3)
(3)
Объединяя уравнения (3) и (2), будем иметь:
![]() . (4)
. (4)
Из уравнения (4) очевидно, что теплоёмкость определяется характером термодинамического процесса. В частности, для изохорического процесса (n = ) CV = iR/2, для изобарического (n = 0) Ср = iR/2 + R, т.е.
Cp = CV + R.
Последнее выражение носит название соотношения Р.Майера.
Таким образом, теплоёмкость газа при постоянном давлении больше теплоёмкости при постоянном объёме. Это легко показать качественно на основании первого начала термодинамики. Если газ нагревается при постоянном объеме, то все подводимое тепло идет на увеличение запаса его внутренней энергии, т.е. только на повышение температуры газа. Если же газ нагревается при постоянном давлении, он расширяется и производит работу, требующую дополнительного расхода тепла. Таким образом, для повышения температуры газа на определённую величину в изобарическом процессе требуется большее количество теплоты, чем при изохорическом.
Отношение Ср/CV входит в уравнение Пуассона, описывающее адиабатический процесс, т.е. процесс, идущий без теплообмена с окружающей средой (Q = 0):
![]() .
(5)
.
(5)
Здесь
![]() и V1 - давление
и объем газа в первом состоянии; p2
и
и V1 - давление
и объем газа в первом состоянии; p2
и
![]() -
давление и объем газа во втором состоянии
,
Ср/CV
.
-
давление и объем газа во втором состоянии
,
Ср/CV
.
Полную теплоизоляцию газа от внешней среды осуществить невозможно. Однако, если параметры состояния газа изменяются очень быстро, процесс можно считать адиабатическим приближенно. На практике адиабатический процесс совершается в некоторых тепловых двигателях (к примеру, в двигателе Дизеля); распространение звука в газах (быстрое периодическое изменение давления в малых областях пространства) также протекает адиабатически.
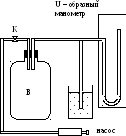
Схема
установки:![]() .
.
Основные формулы:
![]() ;
;
![]() – среднее значения
– среднее значения
![]() ;
;
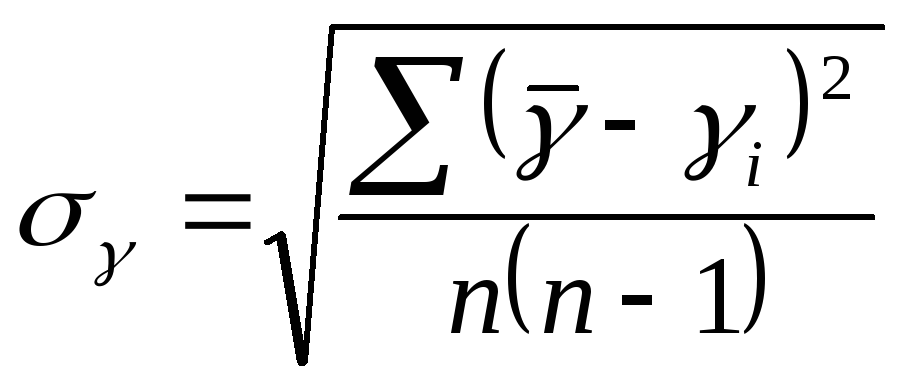 – средняя квадратическая погрешность.
– средняя квадратическая погрешность.
|
Номер опыта |
h1, м. |
|
h2, м. |
|
h1 - h2, м. |
i |
|
1. |
0,092 |
10-3 |
0,025 |
10-3 |
0,067 |
1,373 |
|
2. |
0,093 |
0,027 |
0,066 |
1,409 |
||
|
3. |
0,092 |
0,026 |
0,066 |
1,394 |
||
|
4. |
0,069 |
0,019 |
0,050 |
1,380 |
||
|
5. |
0,118 |
0,032 |
0,086 |
1,372 |
||
|
6. |
0,088 |
0,025 |
0,063 |
1,397 |
||
|
7. |
0,095 |
0,027 |
0,068 |
1,397 |
||
|
8. |
0,085 |
0,023 |
0,062 |
1,371 |
||
|
9. |
0,097 |
0,027 |
0,070 |
1,386 |
||
|
10. |
0,076 |
0,022 |
0,054 |
1,407 |
Вычисления: опыт 1.
![]() ;
;
![]() ;
;
![]() .
.
Вычисления погрешностей:
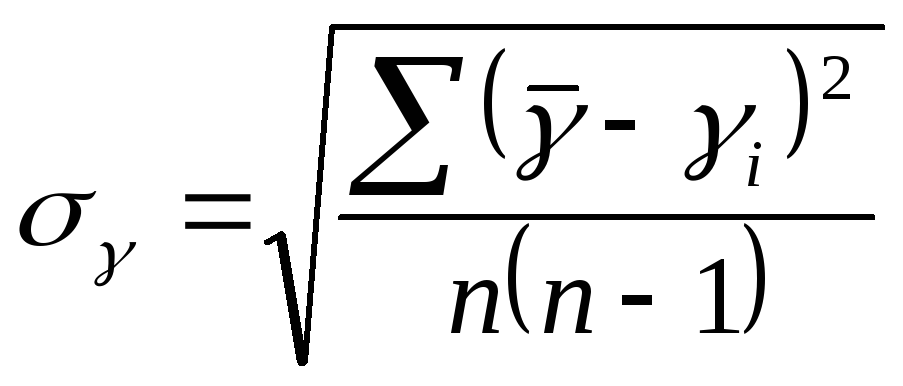 =0,977∙10-3;
=0,977∙10-3;
![]()
![]() ;
;
![]()
![]() =
=![]() .
.
1)
![]() 1,373·0,0418=0,057
1,373·0,0418=0,057
2)
![]() 1,409·0,0418=0,059
1,409·0,0418=0,059
3)
![]() 1,394·0,0418=0,058
1,394·0,0418=0,058
4)
![]() 1,38·0,0418=0,058
1,38·0,0418=0,058
5)
![]() 1,372·0,0418=0,057
1,372·0,0418=0,057
6)
![]() 1,397·0,0418=0,058
1,397·0,0418=0,058
7)
![]() 1,397·0,0418=0,058
1,397·0,0418=0,058
8)
![]() 1,371·0,0418=0,057
1,371·0,0418=0,057
9)
![]() 1,386·0,0418=0,058
1,386·0,0418=0,058
10)
![]() 1,407·0,0418=0,059
1,407·0,0418=0,059
Окончательные результаты.
1)
![]() =1,373
=1,373![]() 0,057
0,057
2)
![]() =1,409
=1,409![]() 0,059
0,059
3)
![]() =1,394
=1,394![]() 0,058
0,058
4)
![]() =1,380
=1,380![]() 0,058
0,058
5)
![]() =1,372
=1,372![]() 0,057
0,057
6)
![]() =1,397
=1,397![]() 0,058
0,058
7)
![]() =1,397
=1,397![]() 0,058
0,058
8)
![]() =1,371
=1,371![]() 0,057
0,057
9)
![]() =1,386
=1,386![]() 0,058
0,058
10)
![]() =1,407
=1,407![]() 0,059
0,059
Вывод – изучив законы идеального газа и основные положения классической теории теплоёмкости, мною был определён коэффициент Пуассона - отношение теплоёмкости при постоянном давлении Ср к теплоёмкости при постоянном объёме Сv методом адиабатического расширения (методом Клемана-Дезорма).
