
- •Тема 5. Факторы формирования химического состава природных вод
- •1. Физико-географические факторы. Климат
- •Рельеф.
- •Гидрография
- •2. Геологические факторы
- •Литология:
- •История геологического развития;
- •Структура:
- •Тектоника:
- •Магматизм
- •3. Физико-химические факторы Растворимость
- •Растворимость некоторых соединений в дистиллированной воде
- •Щелочно-кислотная и окислительно-восстановительная обстановка
- •4. Физические факторы
- •Температура.
- •Давление.
- •5. Биологические факторы
- •6. Антропогенные факторы
Растворимость некоторых соединений в дистиллированной воде
|
Степень растворимости |
Соединение |
Растворимость, г/л, при t= 20оС | ||
|
Легкорастворимые (>2 г/л) |
NаСlКСlNа2SO4СаСl2МgС12Nа2СО3К2SO4 |
|
360 340 194 745 545 215 111 |
|
|
Слаборастворимые (2—0,1 г/л) |
СаSО4МgСО3ZnСО3SгSО4 |
|
2,00 0,27 0,20 0,11 |
|
|
Труднорастворимые (0,1—0,0001 г/л) |
СаСО3SrСО3Fе(ОН)2 |
|
6,94*10-35,91*10-34,5*10-4 |
|
|
Практически нерастворимые (<:0,0001 г/л) |
Сульфиды Силикаты Самородные металлы |
|
- - - |
|
Из таблицы видно, что в дистиллированной воде легко растворимы лишь некоторые минералы, относящиеся к группе простых солей. Подавляющее число минералов, среди которых — силикаты, сульфиды, самородные элементы и пр., в дистиллированной воде практически не растворяются. Трудно- и очень труднорастворимыми являются такие соли, как гипс и карбонаты щелочных земель.
Легкорастворимые минералы характеризуются преимущественно ионными кристаллическими решетками, обладающими сравнительно невысокими энергиями (по А. Е. Ферсману: NаС1 — 179 ккал, КСI — 156, Nа2SО4 — 410 ккал и т. д.). Механизм растворения этих солей можно представить как разрушение их кристаллических решеток под воздействием воды вследствие высокой диэлектрической ее проницаемости, т. е. способности разрывать химические связи между ионами.
Естественно полагать, что легкорастворимые минералы, которые образованы элементами с наиболее высокими кларками, должны играть главную роль при формировании химического состава природных вод. Такими элементами являются О и Н (они участвуют в строении самой воды), затем К, Nа, Са, Мg, С1, S и С. Последние два элемента вследствие склонности давать сложные ионы присутствуют в водах преимущественно в виде SО42-, СО32- и НСО3-.
Природная вода, однако, никогда не бывает чистой дистиллированной. В ней находится ряд компонентов, повышающих её растворяющую способность. Наиболее важную роль среди них играют Н+, СО2, O2 и живые организмы. Под воздействием этих агрессивных компонентов растворению подвергаются практически все твердые минералы, в том числе и самые распространенные в земной коре силикаты.
Щелочно-кислотная и окислительно-восстановительная обстановка
Общая физико-химическая обстановка характеризуется прежде всего щелочно-кислотными и окислительно-восстановительными условиями, которые определяют формы нахождения элементов в жидкой и твердой фазе.
В обобщенном виде эти свойства характеризуются диаграммой в координатах pH–Eh, построенной А.Н. Павловым и В.Н. Шемякиным (рис. 57) на основе главных щелочно-кислотных и окислительно-восстановительных равновесий, свойственных природным гидрогеохимическим системам.

Рис. 57. Классификация природных вод по кислотно-щелочной и окислительно-восстановительной обстановке [21]. (ссылка [10])
1-9 – линии, соответствующие главным окислительно-восстановительным и щелочно-кислотным реакциям; I-XIX – классы по окислительно-восстановительной и щелочно-кислотной обстановке.
Поля
диаграммы соответствуют условиям
распространения различных типов
природных вод (классам): большей части
грунтовых вод, кислых шахтных вод, вод
щелочных массивов, болотных вод и т.д.
![]()
Наклонные линии на этой диаграмме соответствуют следующим окислительно-восстановительным реакциям:
1) Предел существования Н2О - граница устойчивости воды, выше и правее которой вода окисляется до кислорода
![]() ; (58)
; (58)
2) граница, выше и правее которой возможно окисление воды до перекиси водорода
![]() ; (59)
; (59)
3) граница, выше и правее которой сероводород окисляется до серной кислоты
![]()
![]()
![]()
![]() ;
; ![]() (60)
(60)
(Далее:
![]() ;
; ![]() (61)
(61)
![]()
![]() )
)
4) граница устойчивости воды, ниже и левее которой появляется свободный водород
![]() .
Предел существования Н2О
(62)
.
Предел существования Н2О
(62)
Вертикальные линии диаграммы определяются константами диссоциации главных природных кислот (Щелочно-кислотные равновесия):
5) равенство концентраций серной кислоты и первой ступени ее диссоциации
![]() ; (63)
; (63)
![]()
![]()
6) левее исчезает гидрокарбонат-ион
![]()
![]() ; (64)
; (64)
7) равенство концентрации иона водорода и гидроксил-иона, а также сероводорода и гидросульфид-иона
|
|
(65) |
|
(66) |
8) левее исчезает карбонат-ион
![]() (67)
(67)
9) равенство концентраций гидрокарбонат- и карбонат-ионов
![]() ; (68)
; (68)
В соответствии с этими границами
Поля:
I – вода не существует;
II – VII – окислительная обстановка для больше части процессов;
VIII – XIII – нейтральная обстановка для большей части процессов;
XIV – XVIII – восстановительная обстановка для большей части процессов;
XIX – вода не существует;
II, VIII, XIV – ультракислая среда;
III, IX, XV – кислая среда;
IV, X, XVI – слабокислая среда;
V, XI, XVII – слабощелочная среда;
VI, XII, XIII – щелочная среда;
VII, XIII – ультращелочная среда.
Такая
характеристика природной физико-химической
обстановки носит самый общий характер.
При анализе некоторых конкретных реакций
оценка характера физико-химической
обстановки может оказаться иной. Так,
при окислении двухвалентного железа
до трехвалентного
![]() нормальный потенциал реакции E0 = 780 мВ,
т. е. почти любая природная обстановка
для трехвалентного железа является
окислительной и только при очень высоких
значениях окислительно-восстановительного
потенциала в воде может появиться ион
трехвалентного железа.
нормальный потенциал реакции E0 = 780 мВ,
т. е. почти любая природная обстановка
для трехвалентного железа является
окислительной и только при очень высоких
значениях окислительно-восстановительного
потенциала в воде может появиться ион
трехвалентного железа.
.

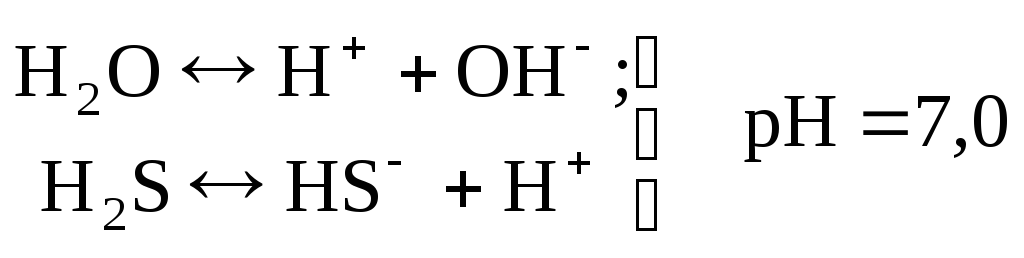 ;
;