
- •Тема 5. Факторы формирования химического состава природных вод
- •1. Физико-географические факторы. Климат
- •Рельеф.
- •Гидрография
- •2. Геологические факторы
- •Литология:
- •История геологического развития;
- •Структура:
- •Тектоника:
- •Магматизм
- •3. Физико-химические факторы Растворимость
- •Растворимость некоторых соединений в дистиллированной воде
- •Щелочно-кислотная и окислительно-восстановительная обстановка
- •4. Физические факторы
- •Температура.
- •Давление.
- •5. Биологические факторы
- •6. Антропогенные факторы
Тема 5. Факторы формирования химического состава природных вод
Природные воды сформировались и формируются в результате сложного взаимодействия геологических, климатических, физико-химических и других предпосылок.
Факторы формирования химического состава – это та природная обстановка, которая способствует формированию химического состава воды. Эти факторы поддерживают или угнетают водную миграцию элементов и целый комплекс процессов, являющихся непосредственными механизмами, формирующими состав воды. Могут быть выделены [15] физико-географические, геологические, физико-химические, физические, биологические, искусственные факторы.
1. Физико-географические факторы. Климат
Главным элементом физико-географических условий, влияющим на формирование химического состава природных вод, является климат.
Скажем, солончаки и связанные с ними соленые воды и рассолы известны только в засушливых областях, воды с очень низкой минерализацией встречаются либо в горах, либо там, где тают ледники и снег, либо в прохладных областях с сильно переувлажненным климатом.
Более точно эти связи установить часто бывает трудно, но они всегда есть и очень важны.
Атмосферные осадки, выпадающие на поверхность Земли, регулируют запасы поверхностных и грунтовых вод.
При значительном превышении количества выпадающих атмосферных осадков над испарением (область избыточного увлажнения) химический состав поверхностных и грунтовых вод определяется, прежде всего, составом атмосферных осадков и процессами растворения горных пород.
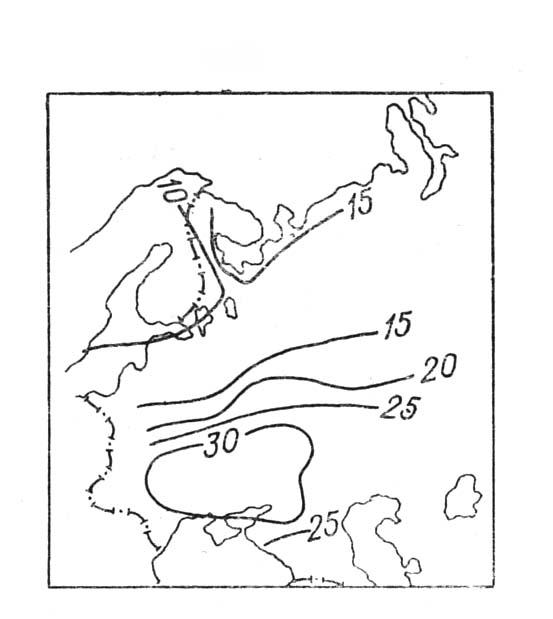




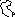


Рис. 54. Средняя минерализация (мг/л) атмосферных осадков на европейской территории России (ссылка [5])
По мере повышения среднегодовой температуры все большее значение приобретает испарение. Площади, на которых количество испаряющейся влаги превышает количество выпадающих атмосферных осадков, составляют область континентального засолонения. Здесь в химическом составе поверхностных и грунтовых вод все большее значение приобретают хорошо растворимые соли, сначала сульфатные, а затем и хлоридные.
Испарительное концентрирование
Порядок выпадения солей:
CaCO3 – CaSO4 – Na2SO4 - Na2CO3 – NaCl – MgCl2 – NaNO3
При r Ca >r HCO 3 – гипсовое засолонение
При r Ca < r HCO 3 – cодовое
В реках, озерах, и водоносных горизонтах грунтовых вод появляются соленые воды, а на участках развития солончаков – рассолы.
Вымораживание природных вод
Анализ результатов термодинамического моделирования процессов вымораживания показал следующее.
Изучалось распределение ионов рассолов в свободной форме (не связанных в ассоциаты и комплексы - Sr2+, Li+, Na+, Ca2+ и др.) между фазами (жидкой и ледяной)
До минерализации 100 г/дм3 количество свободных ионов натрия не изменяется. При минерализации выше 100 г/дм3 содержание свободных ионов натрия в обеих фазах уменьшается, но в жидкой фазе интенсивнее (рис. 62).
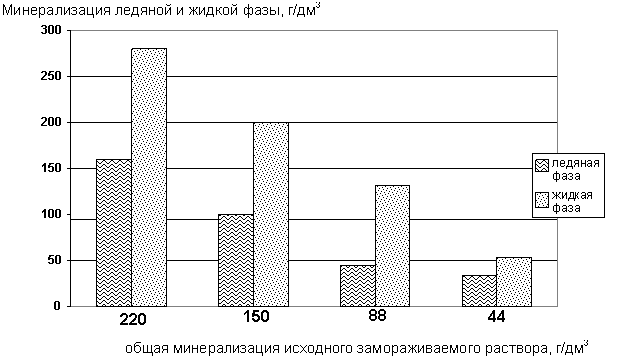
Рис. 62. Содержание свободных ионов Na+ при вымораживании
Количество свободных ионов кальция и хлора до минерализации 100 г/дм3 практически не меняется и равно 97%. При минерализациях свыше 100 г/дм3 этих ионов в свободном состоянии в жидкой фазе становится меньше, чем в ледяной, из-за комплексообразования (рис. 64-65).
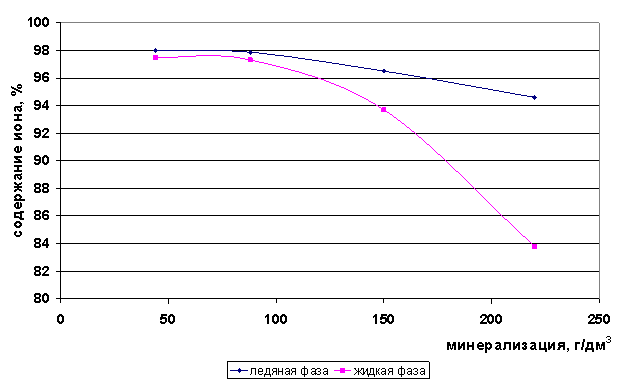
Рис. 65. Содержание свободных ионов Cl- при вымораживании
Видно, что в процессе вымораживании рассолов все элементы концентрируются в жидкой фазе. С увеличением общей минерализации рассола увеличивается и разница в концентрациях элементов, вовлекаемых в ледяную часть и остающихся в рассоле. Микрокомпоненты Li, Sr, Rb и макрокомпонент К содержатся в виде свободных ионов в обеих фазах -ледяной и жидкой - для рассолов с минерализацией до 220 г/дм3. Макрокомпоненты Na, Ca, Cl с повышением общей минерализации рассола переходят из свободной формы в ассоциаты и комплексы. Особенно это характерно для Са и Cl-ионов. Полученные данные свидетельствуют о том, что стронций можно селективно отделить от кальция, за счёт разницы в форме его нахождения в рассоле.
Неравномерность охлаждения гидрогеологической структуры приводит к формированию линз межмерзлотных вод с избыточным криогенным напором и минерализацией до 218 г/л уникального сульфатного магниевого химического состава.
ЭВТЕКТИКА (от греч. eutektos - легко плавящийся), жидкая фаза (расплав), находящаяся в равновесии с двумя или более твердыми фазами. Температура кристаллизации эвтектики называется эвтектической точкой. Продукт кристаллизации жидкой эвтектики - твердая эвтектика, высокодисперсная смесь нескольких твердых фаз того же состава, что и у жидкой эвтектики.
Эвтектика сульфата магния – минус 4.8оС, эвтектическая концентрация – 230 г/л. Наличие в многолетнемерзлых породах сульфатных магниевых рассолов с минерализацией 218г/л указывает на температуру горных пород – минус 4.5оС. При температуре многолетнемерзлых пород ниже эвтектики сульфата магния – минус 4.8оС – следует ожидать засоление льда кристаллогидратами MgSO4.
Криогидратные точки (эвтектики) следует использовать как палеотермометры гидрохимических условий промерзания гидрогеологических структур при палеогидрогеологических реконструкциях [1-3].
В целом последовательность изменения анионного состава подземных вод при промерзании в большинстве случаев можно выразить схемами НСО3 SO4 Cl--, в зависимости от исходного химического состава подземных вод.
Катионный состав, в том числе и микрокомпонентный, при этом испытывает глубокие преобразования, направление которых в общем случае также зависит от исходного химического состава подземных вод.
По мере понижения температуры подземных вод [1, (табл.1)], раствор вымораживания обогащается солями с низкими эвтектиками и, в первую очередь, бромидными и хлоридными солями, а соответствующие им катионы занимают ряд K Na Mg Ca Li. Из сказанного следует, что морская вода полностью не замерзает практически никогда, т.к. эвтектики таких солей как LiCl и CaBr составляют -67 и -82оС соответственно, а при понижении температуры рапы ниже эвтектики CaCl2 (-49 - -55оС), возможно образование рассолов этих солей.
При промерзании раствор вымораживания также обогащается солями тяжелых металлов.
Увеличение объема воды при её замерзании приводит к тому, что часть раствора вымораживания отжимается в сторону от фронта промерзания. Этот процесс ведет, с одной стороны, к концентрированию раствора на фронте промерзания, а с другой - к формированию криогенной гидрохимической зональности (льдов и поровых растворов), отвечающей последовательности кристаллизации солей при вымораживании. Наиболее крепкие рассолы самозахораниваются вследствие высокой плотности в глубоких частях гидрогеологической структуры, вытесняя более пресные воды к фронту промерзания.
При промерзании геологического разреза в нем формируется криогенная трещиноватость вследствие увеличения объема воды на 9% при фазовом переходе жидкость – лед.
При повышении температуры при деградации многолетнемерзлых горных пород растворение солей происходит в порядке, обратном их кристаллизации, образуются маломинерализованные воды.
При деградации многолетнемерзлых горных пород снизу – вверх в них образуются опресненные интервалы подмерзлотных сульфатно-гидрокарбонатных магниево-кальциевых вод.
Важным климатическим параметром, влияющим на формирование химического состава природных вод, являются ветры. На морских побережьях в зависимости от направления и интенсивности ветра меняется химический состав атмосферных осадков, а следовательно, и поверхностных и грунтовых вод. Ветры могут уносить на сотни и даже тысячи километров морские соли, соляную пыль с солончаков и усыхающих соленых озер, вулканические дымы, дымы промышленных предприятий. В засушливых областях ветер может существенно изменять и соотношение главных ионов в природных водах. При полном усыхании соляных озер на поверхности образуется соляная корка, обогащенная хлоридами и сульфатами магния и сульфатами натрия, которая разрушается и выносится ветром. Оставшиеся в донных отложениях хлориды натрия в дождливые годы растворяются, но озерная вода содержит уже меньше «горьких» солей. Похожие процессы протекают и на поверхности солончаков, очищая залегающие под ними воды от хлоридов магния и сульфатов магния и натрия.
