
- •Термодинамика в ХАЙСИС
- •1 Компоненты
- •1.1 Введение
- •1.2 Окно Список компонентов
- •2 Пакет свойств
- •2.1 Введение
- •2.2 Закладка Пакеты свойств
- •2.3 Добавление пакета свойств
- •2.4 Специализированное окно Пакет свойств
- •2.4.1 Закладка Термодинамический пакет
- •2.4.2 Закладка Параметры
- •2.4.3 Закладка Бинарные коэффициенты
- •2.4.5 Закладка Порядок фаз
- •2.4.6 Закладка Реакции
- •2.4.7 Закладка Табличный пакет
- •2.4.8 Закладка Примечания
- •2.5 Окно Пакет свойств с ComThermo
- •2.6 Литература
- •3 Гипотетические компоненты
- •3.1 Введение
- •3.2 Диспетчер гипотетических компонент
- •3.3 Добавление гипотетического компонента
- •3.3.1 Создание этанола
- •3.3.2 Сравнение библиотечного и гипотетического компонентов
- •3.4 Создание группы гипотетических компонент
- •3.4.1 Окно Гипотетические компоненты
- •3.4.2 Задание основной информации
- •3.4.3 Структура UNIFAC
- •3.5 Окно гипотетического компонента
- •3.5.1 Закладка идентификации (ID)
- •3.5.2 Закладка Критические свойства
- •3.5.3 Закладка Дополнительные свойства
- •3.5.4 Закладка Свойства, зависящие от температуры
- •3.6 Твердый гипотетический компонент
- •3.6.1 Закладка идентификации (ID)
- •3.6.3 Закладка Дополнительные свойства
- •3.6.4 Закладка Свойства, зависящие от температуры
- •3.6.5 Закладка PSD
- •3.7 Копирование библиотечных компонент
- •3.8 Управление гипотетическими компонентами
- •3.8.1 Просмотр группы
- •3.8.2 Перемещение компонент
- •3.9 Литература
- •4 Диспетчер нефтяных смесей
- •4.1 Введение
- •4.2 Нефтяной пакет
- •4.2.1 Лабораторные данные
- •4.2.2 Стандартные методы разгонки
- •4.2.3 Единицы измерения
- •4.2.4 Физические свойства
- •4.2.5 Способы задания свойств
- •4.2.6 Поправки лабораторных данных
- •4.2.7 Корреляции по умолчанию
- •4.3 Процедура характеризации нефтяных смесей
- •4.3.1 Введение
- •4.3.2 Первый шаг - Ввод данных
- •4.3.3 Второй шаг - Создание псевдокомпонентов
- •4.3.4 Третий шаг - Инсталляция нефтяного потока
- •4.3.5 Пользовательское свойство
- •4.3.6 Корреляции
- •4.4 Окно Характеризация нефти
- •4.5 Ввод экспериментальных данных
- •4.5.1 Закладка Исходные данные
- •4.5.2 Закладка Параметры по умолчанию
- •4.5.3 Закладка Рабочие кривые
- •4.5.4 Закладка График
- •4.5.5 Закладка Методы расчета
- •4.5.6 Закладка Пользовательские кривые
- •4.5.7 Закладка Заметки
- •4.6 Создание псевдокомпонентов
- •4.6.1 Закладка Данные
- •4.6.2 Закладка Корреляции
- •4.6.3 Закладка Таблицы
- •4.6.4 Закладка Графики свойств
- •4.6.5 Закладка Графики распределений
- •4.6.6 Закладка Композитные графики
- •4.6.7 Закладка Подшивка графиков
- •4.6.8 Закладка Примечания
- •4.7 Пользовательское свойство
- •Закладка Пользовательское свойство
- •Окно Пользовательское свойство
- •4.8 Корреляции и инсталляция
- •4.8.1 Закладка Корреляции
- •4.8.2 Окно Корреляции
- •4.8.3 Закладка Примечания
- •4.8.4 Закладка Инсталляция
- •4.9 Пример - характеризация нефти
- •4.9.1 Начало работы
- •4.9.2 Шаг 1 - Задание экспериментальных данных
- •4.9.3 Шаг 2 - Разбивка на псевдокомпоненты
- •4.9.4 Шаг 3 - Инсталляция смеси в схему
- •4.9.5 Связанный пакет свойств
- •4.10 Пример 2 - Кривая распределения серы
- •4.10.1 Пакет свойств
- •4.10.2 Добавление Пользовательского свойства
- •4.10.3 Ввод данных
- •4.10.4 Разбивка на псевдокомпоненты
- •4.10.5 Результаты
- •4.11 Литература
- •5 Диспетчер реакций
- •5.1 Введение
- •5.2 Компоненты реакций
- •5.2.1 Выбор компонентов из Диспетчера базиса
- •5.2.2 Выбор компонентов внутри Диспетчера реакций
- •5.2.3 Компоненты библиотечных реакций
- •5.3 Реакции
- •5.3.1 Работа с реакциями
- •5.3.2 Конверсионные реакции
- •5.3.3 Равновесные реакции
- •5.3.4 Кинетические реакции
- •5.3.5 Гетерогенная каталитическая реакция
- •5.3.6 Простая реакция
- •5.4 Наборы реакций
- •5.4.1 Работа с наборами реакций
- •5.4.2 Окно Набор реакций
- •5.4.3 Экспорт/Импорт наборов реакций
- •5.4.4 Добавление набора реакций к пакету свойств
- •5.4.5 Доступ к реакциям из расчета
- •5.5 Обобщенная процедура
- •5.6 Демонстрационный пример
- •5.6.1 Добавление компонент
- •5.6.2 Создание реакции
- •5.6.3 Добавление реакции в набор реакций
- •5.6.4 Связывание набора реакций с Пакетом свойств
- •6.1 Введение
- •6.2 Закладка Отображение
- •6.2.1 Отображение компонентов
- •6.2.2 Коллекции
- •6.2.3 Отображения для коллекций
- •6.3 Окно Отображение компонентов
- •7.1 Введение
- •7.2 Закладка Пользовательское свойство
- •7.2.1 Добавление пользовательского свойства
- •7.3 Окно Пользовательское свойство
- •7.3.1 Закладка Данные
- •7.3.2 Закладка Примечания
- •Б.1 Введение
- •Б.2 Методика характеризации
- •Б.2.1 Построение рабочих кривых
- •Б.2.2 Анализ газовой части
- •Б.2.3 Автоматический расчет газовой части
- •Б.2.4 Разбивка кривой ИТК на псевдокомпоненты
- •Б.2.5 Графическое определение свойств компонентов
- •Б.2.7 Корреляции
- •Б.3 Литература
- •Г.1 Введение
- •Г.2 Упругость паров чистых компонент
- •Г.3 Правила смешения
- •Г.3.1 Правила смешения TST
- •Г.3.2 Правила смешения CEOS/AE при нулевом давлении
- •Г.3.3 Модель жидкости GE
- •Г.4 Расчет фазового равновесия
- •Г.5 Расчет энтальпии и энтропии
- •Г.6 Литература

Пользовательские свойства 7 - 3
7.2.1 Добавление пользовательского свойства
1Нажмите кнопку Добавить на закладке Пользовательское свойство окна Диспетчер базиса. Появится окно Пользовательское свойство.
2Задайте имя свойства, отражающее его характер.
3В группе Параметры уравнения выберите единицы для расчетов смешения.
4Выберите правило смешения.
5При необходимости, измените значения параметров смешения F1 и F2.
6Выберите исходный пакет свойств, чтобы получит доступ к списку компонент.
7Задайте величину пользовательского свойства для каждого компонента.
7.3 Окно Пользовательское свойство
Всякий раз, кода Вы создаете пользовательское свойство на закладке
Пользовательское свойство окна Диспетчер базиса, на экран вызывается окно Пользовательское свойство. В этом окне имеются две закладки - Данные и Примечания. Вся информация, необходимая для расчета пользовательского свойства, задается на экране Данные.
7.3.1Закладка Данные
На этой закладке имеются группы Параметры уравнения и Значения пользовательского свойства для компонент.
7 - 4 Пользовательские свойства
Параметры уравнения
Имеются следующие поля:
Параметр |
Описание |
|
Единицы |
Имеются варианты: мольные доли, массовые доли, объемные |
|
смешения |
доли жидкости, мольные расходы, массовые расходы и |
|
|
объемные расходы жидкости. |
|
|
Все расчеты проводятся с использованием внутренних единиц |
|
|
ХАЙСИС. Если в качестве единиц заданы расходы - мольные, |
|
|
массовые или объемные жидкости, - ХАЙСИС будет работать с |
|
|
расходами вычисленными в соответствующих внутренних |
|
|
единицах. |
|
|
Например, если в качестве единиц смешения заданы мольные |
|
|
расходы, при расчете пользовательского свойства расходы будут |
|
|
приниматься в кмоль/сек, даже если по умолчанию в этот момент |
|
|
для мольных расходов выбраны другие единицы. |
|
Правило |
Имеются следующие три варианта правил смешения: |
|
смешения |
N |
|
|
( Pmix ) f 1 = f 2∑(x(i) P(i) f 1 ) |
(7.1) |
|
i=1 |
|
|
N |
|
|
( Pmix ) f 1 = f 2∑(x(i) ln P(i) f 1 ) |
(7.2) |
|
i=1 |
|
|
N |
|
|
Index = ∑x(i)( f 1 P(i) +10 f 2 P(i) ) |
(7.3) |
|
i=1 |
|
|
здесь Pmix - значение свойства для потока |
|
|
P(i) - значение свойства для компонента i |
|
|
x(i) - доля или расход компонента в соответствии с |
|
|
выбранными единицами смешения |
|
|
Index - суммарное значение индекса смешения |
|
|
f1 и f2 - константы |
|
Параметры F1 и |
По умолчанию параметры смешения f1 и f2 принимаются |
|
F2 |
равными 1. Пользователь может задать любую величину. |
|
Правило смешения
Таким образом, при вычислении пользовательского свойства имеются три правила смешения. Правила (7.1) и (7.2) относительно просты, правило (7.3) - более сложное, с его помощью можно рассчитывать свойство, которое зависит от состава нелинейно. Уравнение (7.3) можно для простоты представить в виде следующих трех уравнений:
Indexi = f 1 P(i) +10 f 2 P(i) |
(7.4) |
N |
|
Index = ∑x(i) Indexi |
(7.5) |
i=1 |
|
Index = f 1 P +10 f 2 P |
(7.6) |
Уравнение индекса целесообразно использовать для вычисления таких свойств, как октановое число по исследовательскому методу (RON), температура застывания и вязкость.
Пользователь задает значения свойств индивидуальных компонент (Pi) и параметры уравнения (f1 и f2). С помощью (6.4) ХАЙСИС рассчитывает значение индекса для каждого компонента. Затем с помощью (6.5)
рассчитывает значение индекса для смеси. Наконец, с помощью (6.6) рассчитывается свойство для смеси (P), причем последний расчет производится итерационно.
Пользовательские свойства 7 - 5
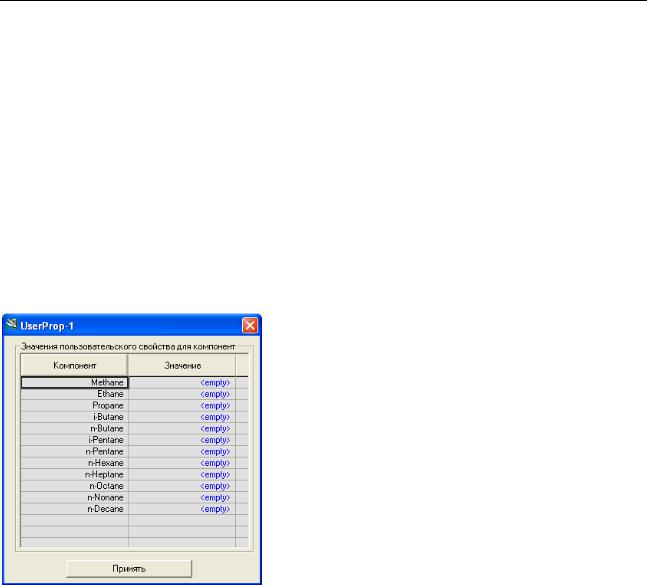
Значения пользовательского свойства для компонент
В этой группе следует выбрать исходный пакет свойств. Все компоненты выбранного пакета появятся в столбце Компоненты. Следует задать значения свойства этим компонентам.
Именно здесь пользователь объясняет программе, как следует вычислять данное свойство для произвольного потока технологической схемы. Вне зависимости от того, рассчитывается ли свойство с помощью утилиты Пользовательское свойство, или в рамках расчета колонны, схем расчета не меняется.
Изменение значений
В окне пользовательского свойства нажмите кнопку Задать значения свойства. Откроется окно:
Задайте или измените значения свойства для всех компонент и нажмите кнопку Принять.
7.3.2Закладка Примечания
Имеется специальная закладка Примечания, где пользователь может записать информацию, которая может потребоваться в дальнейшем.

Методы расчета свойств А - 1
A Методы расчета свойств
A Методы расчета свойств............................................................................ |
1 |
||
A.1 |
Введение................................................................................................. |
3 |
|
A.2 |
Выбор термодинамического пакета ................................................. |
3 |
|
A.3 |
Термодинамические пакеты............................................................... |
7 |
|
A.3.1 |
Уравнения состояния ...................................................................... |
7 |
|
A.3.2 |
Модели активности........................................................................ |
13 |
|
A.3.3 Опции моделей активности для паровой фазы.......................... |
26 |
||
A.3.4 |
Полуэмпирические методы........................................................... |
27 |
|
A.3.5 |
Пакеты упругости пара.................................................................. |
28 |
|
A.3.6 |
Прочие пакеты................................................................................ |
30 |
|
A.4 |
Расчет энтальпии и энтропии .......................................................... |
33 |
|
A.4.1 |
Уравнения состояния .................................................................... |
34 |
|
A.4.2 |
Модели активности........................................................................ |
35 |
|
A.4.3 |
Вариант Ли-Кеслера...................................................................... |
36 |
|
A.5 |
Физические и транспортные свойства........................................... |
37 |
|
A.5.1 |
Плотность жидкости ...................................................................... |
38 |
|
A.5.2 |
Плотность пара.............................................................................. |
38 |
|
A.5.3 |
Вязкость.......................................................................................... |
38 |
|
A.5.4 Правила смешения жидких фаз при расчете вязкости.............. |
40 |
||
A.5.5 |
Теплопроводность......................................................................... |
40 |
|
A.5.6 |
Поверхностное натяжение............................................................ |
42 |
|
A.5.7 |
Теплоемкость................................................................................. |
43 |
|
A.6 |
Расчет объемных расходов ............................................................. |
43 |
|

А - 2 |
Методы расчета свойств |
|
|
|
|
A.6.1 |
Имеющиеся варианты расходов.................................................. |
43 |
|
|
A.6.2 Плотность пара и жидкости.......................................................... |
44 |
||
|
A.6.3 |
Вычисление расходов................................................................... |
45 |
|
|
A.6.4 Объемные расходы как спецификации....................................... |
46 |
||
|
A.7 |
Расчет фазового равновесия .......................................................... |
47 |
|
|
A.7.1 Расчет испарения при заданных T- P.......................................... |
47 |
||
|
A.7.2 Расчет испарения при заданной доле пара................................ |
48 |
||
|
A.7.3 Расчет равновесия при заданной энтальпии ............................. |
49 |
||
|
A.7.4 Расчет равновесия при заданной удельной энтропии .............. |
49 |
||
|
A.7.5 Расчет равновесия в пакете Электролиты................................. |
49 |
||
|
A.7.6 |
Вода................................................................................................ |
50 |
|
|
A.7.7 Расчеты для сверхкритических состояний ................................. |
51 |
||
|
A.7.8 |
Твердая фаза ................................................................................ |
51 |
|
|
A.7.9 |
Информация о потоках................................................................. |
52 |
|
|
A.8 |
Литература........................................................................................... |
53 |
|

Методы расчета свойств А - 3
A.1 Введение
Материалы в этом дополнении организованы таким образом, чтобы пояснить детали расчетов, которые выполняются в рамках Диспетчера базиса и при расчете технологических схем. Имеются следующие разделы:
•Даются общие указания относительно выбора термодинамического пакета.
•Дается детальная информация относительно каждого термодинамического пакета, имеющегося в ХАЙСИС. Рассматриваются уравнения состояния, модели активности, полуэмпирические модели на основе метода Чао-Сидера, модели упругости паров и прочие методы.
•Подробно рассмотрены методы расчета энтальпии и энтропии. Выбор этих методов существенно зависит от выбранного Вами термодинамического пакета.
•Подробно рассмотрены методы расчета физических и транспортных свойств, таких как плотность жидкости, плотность пара, вязкость, теплопроводность и поверхностное натяжение.
•В ХАЙСИС реализованы собственные методы расчета объемных расходов. Приводится описание этих методов.
•Этот раздел объединяет приведенную выше информацию. В ХАЙСИС расчет фазового равновесия использует уравнения выбранного термодинамического пакета, а также формулы расчета физических и транспортных свойств для определения всех свойств технологического потока. После проведения расчета фазового равновесия определяются все термодинамические, физические и транспортные свойства. Расчет фазового равновесия в ХАЙСИС не требует задания начальных приближений, а также явных указаний относительно постановки задачи расчета (расчет доли отгона при заданных P и T, расчет Т при заданной доли отгона и т.д.).
•В конце приводится список литературы.
A.2 Выбор термодинамического пакета
Имеющиеся в ХАЙСИС термодинамические пакеты позволяют пользователю получить свойства самых различных смесей - от легких углеводородов до сложных нефтяных смесей и неидеальных (неэлектролитных) химических систем. В ХАЙСИМ имеются расширенные уравнения состояния (PR и PRSV) для точных расчетов углеводородных систем, полуэмпирические модели и модели упругости паров для более тяжелых углеводородных систем, корреляции для точных расчетов свойств пара и модели коэффициентов активности для химических систем. Все эти уравнения имеют присущие им ограничения, и пользователь может лучше познакомиться с применением каждого уравнения, обратившись к описанию каждого пакета в настоящем документе или к дополнительной литературе, указанной ниже.
Далее в таблице представлены некоторые типовые системы и рекомендуемые термодинамические пакеты. Если у Вас возникли сомнения в точности или в применимости какого-либо пакета, свяжитесь с нами, и мы постараемся представить Вам дополнительный материал по достоверности данных или дать нашу оценку его точности.

А - 4 |
Методы расчета свойств |
|
|
|
|
|
|
|
|
|
|
Система |
Рекомендуемый пакет |
|
|
|
Осушка с помощью ТЭГ |
Пенг-Робинсон (PR) |
|
|
|
|
|
|
|
|
Кислая вода |
Пенг-Робинсон (PR), Пенг-Робинсон для кислых сред |
|
|
|
|
(Sour PR) |
|
|
|
Криогенные газовые системы |
Пенг-Робинсон (PR), Пенг-Робинсон-Стижек-Вера |
|
|
|
|
(PRSV) |
|
|
|
Разделение воздуха |
Пенг-Робинсон (PR), Пенг-Робинсон-Стижек-Вера |
|
|
|
|
(PRSV) |
|
|
|
Атмосферная перегонная |
Пенг-Робинсон (PR), опции Пенга-Робинсона, |
|
|
|
нефти |
Грейсон-Стрид (GS) |
|
|
|
Вакуумные колонны |
Пенг-Робинсон (PR), опции Пенга-Робинсона, |
|
|
|
|
Грейсон-Стрид (GS, <10mmHg), Braun K10, Таблицы |
|
|
|
|
Эссо |
|
|
|
Этиленовые колонны |
Ли Кеслер-Плокер (Lee Kesler Plocker) |
|
|
|
|
|
|
|
|
Системы с высоким |
Пенг-Робинсон (PR), Зудкевич-Йофе (ZJ) или |
|
|
|
содержанием Н2 |
Грейсон-Стрид (GS) (см. ограничения по Т/Р) |
|
|
|
Резервуарные системы |
Пенг-Робинсон (PR), опции Пенга-Робинсона |
|
|
|
|
|
|
|
|
Водяной пар |
Пакеты водяного пара, Чао-Сидер (CS) или Грейсон- |
|
|
|
|
Стрид (GS) |
|
|
|
Ингибирование |
Пенг-Робинсон (PR) |
|
|
|
гидратообразования |
|
|
|
|
Химические системы |
Модели активности, Пенг-Робинсон-Стижек-Вера |
|
|
|
|
(PRSV) |
|
|
|
Алкилирование в присутствии |
Пенг-Робинсон-Стижек-Вера (PRSV), NRTL |
|
|
|
HF |
(свяжитесь с Хайпротех) |
|
|
|
Дегидрирование с помощью |
Пенг-Робинсон (PR) (свяжитесь с Хайпротех) |
|
|
|
ТЭГ в присутствии ароматики |
|
|
|
|
Углеводородные системы, в |
Кабади-Данер (KD) |
|
|
|
которых важна растворимость |
|
|
|
|
Н2О в углеводородах |
|
|
|
|
Легкие неуглеводородные и |
Модифицированное уравнение Бенедикта-Вебба- |
|
|
|
углеводородные газы |
Рубина (MBWR) |
|
Для нефтепродуктов, газов и сред, применяемых в нефтехимии, обычно рекомендуется уравнение состояния Пенга-Робинсона (PR). Усовершенствованное фирмой Хайпротех, это уравнение состояния хорошо описывает разнообразные системы в широком диапазоне условий. С его помощью рассчитываются фазовые равновесия одно-, двух- и трехфазных систем с высокой степенью эффективности и надежности. Оно применяется для широкого диапазона условий, что видно из следующей таблицы:
|
Метод |
|
Температура, °С (°F) |
|
Давление, kPa (psia) |
|
|
|
|
|
|||
|
PR |
> -271°C (-456 F) |
< 100000 (15000) |
|
||
|
|
|
|
|
||
|
SRK |
> -143°C (-225 F) |
< 35000 (<5000) |
|
||
|
|
|
|
|
|
|
Диапазон применимости во многих случаях указывает скорее на наличие хороших экспериментальных данных, а не на фактические ограничения.
Уравнение PR было усовершенствовано для получения точных расчетов фазового равновесия самых различных систем - от низкотемпературных криогенных систем до систем с высокой температурой и высоким давлением. Это же уравнение состояния удовлетворительно описывает распределение компонентов для систем тяжелых нефтепродуктов, водных растворов гликолей и метанола, а также систем кислого газа/кислой воды, хотя имеются специальные модели, описывающие кислые среды (Sour_PR и Sour_SRK). Мы настоятельно рекомендуем использовать уравнение состояния Пенга-Робинсона. Хотя уравнение Соава-Редлиха-Квонга (SRK) также дает сравнимые результаты с уравнением PR, но во многих случаях

Методы расчета свойств А - 5
мы считаем, что его пределы применения намного более ограничены и не так надежны для неидеальных систем. Например, его не следует использовать для описания систем с метанолом и гликолями.
В качестве альтернативы следует рассматривать также и уравнение состояния Пенга-Робинсона-Стрижека-Веры (PRSV). Оно применимо для тех же систем, что и уравнение PR, с равноценной или лучшей точностью; кроме того, оно более пригодно для неидеальных систем.
Преимуществом уравнения PRSV является не только тот факт, что оно более точно описывает фазовое равновесие углеводородных систем, особенно состоящих из компонентов разной природы, но и то, что точность описания неидеальных систем конкурирует с точностью традиционных моделей коэффициентов активности. Единственным минусом является увеличение продолжительности расчета и дополнительные параметры взаимодействия, требующиеся для уравнения.
Уравнения состояния PR и PRSV дают точные расчеты трехфазного состояния для водных систем, содержащих воду, метанол или гликоли, а также для систем, содержащих другие углеводороды или неуглеводороды во второй жидкой фазе. Для уравнения SRK вода является единственным компонентом, который инициализирует водную фазу. Пакеты Чао-Сидера (CS) и Грейсона-Стрида (GS) также могут применяться для расчета трехфазного состояния, но второй жидкой фазой может быть только чистая вода.
Уравнение PR может также использоваться для нефтяных систем, которые традиционно моделировались с помощью двойственных термодинамических пакетов (модель активности, представляющая поведение жидкой фазы, и уравнение состояния или закон идеального газа для свойств паровой фазы). Эти ранние модели могут оказаться непригодными для систем с большим количеством легких фракций или при приближении к критическим зонам. Кроме того, двойственные модели могут приводить к внутренним противоречиям. Разработанные фирмой усовершенствованные уравнения PR и SRK правильно описывают вакуумные системы и фазовое равновесие тяжелых компонентов (что является проблемой для традиционных уравнений состояния), а также легкие фракции и системы высокого давления.
Модели активности, которые применяются для сильно неидеальных систем, по своей природе являются гораздо более эмпирическими, чем методы расчета, обычно применяемые в нефте- и газопереработке. Полярные и неидеальные химические системы традиционно рассчитываются с помощью двойственных моделей, когда для расчета коэффициентов фугитивности паров используется уравнение состояния, а для расчета жидкой фазы - модели коэффициентов активности. Экспериментальные данные параметров моделей активности обрабатываются в определенном диапазоне значений, поэтому их применимость ограничена.
Методы CS и GS, хотя они применимы в более узком диапазоне, в некоторых случаях могут быть предпочтительнее. Например, они рекомендуются для систем, содержащих главным образом воду или водяной пар, поскольку эти методы включают специальные корреляции, более точно представляющие таблицы пара. При желании для легких углеводородных смесей можно использовать метод Чао-Сидера. Метод Грейсона-Стрида рекомендуется для систем с высоким содержанием водорода. Кроме того, этот метод может оказаться несколько более точным при моделировании вакуумных колонн.
Модели упругости пара, а именно, модифицированный метод Антуана, BK10 и табличная модель Эссо, разработаны главным образом для расчета систем тяжелых углеводородов при низких давлениях. Эти уравнения традиционно применялись для описания систем фракционирования тяжелых углеводородов и, следовательно, они обеспечивают хорошую основу для сравнения с точными моделями. Их не следует использовать для расчета

А - 6 Методы расчета свойств
паро-жидкостного равновесия систем, работающих при высоких давлениях, или систем с большим количеством легких углеводородов.
Как показано в следующей таблице, термодинамические пакеты в системе ХАЙСИC можно разделить на несколько основных категорий. Для каждого пакета приведены возможные методы вычисления парожидкостного равновесия, энтальпии и энтропии.
Методы расчета энтальпии и энтропии смотри в соответствующем разделе данной главы (А.4).
Термодинамический пакет |
Расчет паро-жидкостного |
Расчет |
|
равновесия |
энтальпии/энтроп |
|
|
ии |
Уравнения состояния |
|
|
Пенг-Робинсон (PR) |
PR |
PR или Ли-Кеслер |
Соав-Редлих-Квонг (SRK) |
SRK |
SRK или Ли- |
|
|
Кеслер |
Кабади-Данер (Kabadi Danner) |
Kabadi Danner |
SRK |
Ли-Кеслер-Плокер (Lee Kesler |
Ли-Кеслер-Плокер |
Ли-Кеслер |
Plocker) |
|
|
Пенг-Робинсон-Стрижек-Вера |
PRSV |
PRSV или Ли- |
(PRSV) |
|
Кеслер |
Кислый Пенг-Робинсон (Sour PR) |
PR & API-Sour |
PR |
Кислый Соав-Редлих-Квонг (Sour |
SRK & API-Sour |
SRK |
SRK) |
|
|
Зудкевич-Йофе (Zudkevitch- |
Zudkevitch-Joffee |
Ли-Кеслер |
Joffee) |
|
|
Модели активности |
|
|
Жидкость |
|
|
Чьен-Нулл (Chien Null) |
Chien Null |
Кавет (Cavett) |
Расширенный и обобщенный |
NRTL |
Кавет (Cavett) |
NRTL |
|
|
Маргулис (Margules) |
Margules |
Кавет (Cavett) |
NRTL |
NRTL |
Кавет (Cavett) |
UNIQUAC |
UNIQUAC |
Кавет (Cavett) |
Ван-Лаар (Van Laar) |
Van Laar |
Кавет (Cavett) |
Вильсон (Wilson) |
Wilson |
Кавет (Cavett) |
Пар |
|
|
Идеальный газ (Ideal Gas) |
Ideal Gas |
Ideal Gas |
Редлих-Квонг (RK) |
RK |
RK |
Вириальная (Virial) |
Virial |
Virial |
Пенг-Робинсон (PR) |
PR |
PR |
Соав-Редлих-Квонг (SRK) |
SRK |
SRK |
Полуэмпирические модели |
|
|
Чао-Сидер (Chao-Seader) |
CS-RK |
Ли-Кеслер |
Грейсон-Стрид (Grayson-Streed) |
GS-RK |
Ли-Кеслер |
Модели упругости паров |
|
|
Модифицированный Антуана |
Mod Antoine-Ideal Gas |
Ли-Кеслер |
(Mod Antoine) |
|
|
Брауна (Braun K10) |
BK10-Ideal Gas |
Ли-Кеслера |
Таблицы Эссо (Esso Tabular) |
Esso-Ideal Gas |
Ли-Кеслер |
Прочие методы |
|
|
Амины |
Модифицированный метод |
Обработка |
|
Кента-Айзенберга |
экспериментальны |
|
(жидкость), PR (пар) |
х данных |
Пакеты водяного пара |
|
|
Таблицы водяного пара ASME |
Таблицы водяного пара |
Таблицы водяного |
(Американское общество |
ASME |
пара ASME |
инженеров-механиков) |
|
|

|
|
|
Методы расчета свойств А - 7 |
|
|
|
|
Таблицы водяного |
|
|
Таблицы водяного пара NBS |
Таблицы водяного пара |
|
|
|
(Национальное бюро стандартов |
NBS Таблицы водяного |
пара NBS/NRC |
|
|
США) |
пара NBS |
|
|
|
Модифицированное уравнение |
MBWR |
MBWR |
|
|
Бенедикта-Вебба-Рубина |
|
|
|
|
(MBWR) |
|
|
|
A.3 Термодинамические пакеты
В этом разделе дается детальная информация относительно каждого термодинамического пакета, имеющегося в ХАЙСИС. Рассматриваются уравнения состояния, модели активности, полуэмпирические модели на основе метода ЧаоСидера, модели упругости паров и прочие методы.
A.3.1 Уравнения состояния
В настоящее время ХАЙСИС предлагает модифицированные уравнения состояния Пенга-Робинсона14(PR) и Соава-Редлиха-Квонга19(SRK).
Свойства, полученные с помощью уравнений состояния PR и SRK в системе ХАЙСИМ, не обязательно совпадают со свойствами, полученными с помощью этих уравнений другими коммерческими программами.
Кроме этого, ХАЙСИС предлагает несколько методов, которые базируются на этих уравнениях состояния, такие как PRSV, Зудкевича-Йоффе (ZJ) и Кабади-Даннер (KD). Корреляция Ли-Кеслера-Плокера3(LKP) является расширением уравнения Ли-Кеслера, применимым для расчетов смесей. В свою очередь уравнение Ли-Кеслера было получено как модификация уравнения Бенедикта-Вебера-Рубина (BWR). При этом уравнение состояния Пенга-Робинсона обеспечивает расчет физических свойств самых разнообразных систем в широком диапазоне рабочих условий. Уравнения состояния Пенга-Робинсона и Соава-Редлиха-Квонга непосредственно генерируют все необходимые равновесные и термодинамические свойства. Хотя уравнения этих методов одинаковы для большинства коммерческих программ моделирования, они были значительно усовершенствованы фирмой ХАЙПРОТЕХ, став приемлемыми для большего числа систем и более широкого диапазона рабочих условий.
На базе уравнения состояния Пенга-Робинсона имеются варианты: PR, кислый PR (Sour PR) и Пенг-Робинсон-Стрижек-Вера (PRSV). На базе уравнения состояния Соава-Релиха-Квонга имеются варианты: SRK, кислый SRK (Sour SRK), Кабади-Даннер (KD) и Зудкевич-Йоффе (ZJ).
PR и SRK
Пакеты PR и SRK содержат модифицированные параметры бинарного взаимодействия для всех библиотечных пар углеводород-углевод, а также для большинства пар углеводород-неуглеводород.
Для небиблиотечных компонентов и углеводородных псевдокомпонентов параметры взаимодействия угловодород-углеводород могут генерироваться автоматически системой ХАЙСИС с целью уточнения расчета парожидкостного равновесия.
Уравнения состояния PR и SRK не следует применять для неидеальных химических компонентов, таких как спирты, кислоты и т.д. Более точные результаты в этом случае дают модели активности (для сильно

А - 8 Методы расчета свойств
неидеальных систем) или уравнение состояния PRSV (для умеренно неидеальных систем).
Для некоторых компонентов параметры взаимодействия вычисляются специальным образом. К этим компонентам относятся He, H2, N2, CO2, H2S, H2O, CH3OH, этиленгликоль и триэтиленгликоль. Для получения более подробной информации о применении уравнений состояния в отношении конкретных компонентов следует связаться с ХАЙПРОТЕХ.
Ниже дается сравнение уравнений, используемых ХАЙСИС в уравнениях состояния PR и SRK.
|
|
Соав-Редлих-Квонг |
|
|
|
|
|
|
|
|
|
|
Пенг-Робинсон |
|
|
|
|
|
|
|
|
|||||||||
|
|
P = |
|
R T |
|
|
− |
|
|
|
|
a |
|
|
P = |
RT |
− |
|
|
|
|
|
|
a |
|
|||||
|
|
|
|
V − |
b |
|
|
|
|
V (V + b ) |
|
|
V − b V (V |
+ b) + b(V − b) |
||||||||||||||||
|
|
Z 3 − Z 2 + ( A − B − B 2 ) Z − A B = 0 |
|
Z3 + (1 − B)Z2 + ( A − 2B − 3B2 )Z − ( AB − B2 − B3) = 0 |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b= |
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
∑xi bi |
|
|
|
|
∑xi bi |
|
|
|
|
||||||||||||||||
|
|
|
|
|
i=1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
i=1 |
|
|
|
|
|
|
|
|
|||
bi= |
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|
RT |
||||||||||
|
|
|
0.08664 |
|
|
|
|
ci |
0.077796 |
|
|
ci |
||||||||||||||||||
|
|
|
|
|
P |
|
|
|
|
P |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ci |
|
|
|
|
|
|
|
|
|
|
ci |
||||||
a= |
|
N N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N N |
|
|
|
|
|
|
|
|
||||
|
|
∑∑xi x j (ai a j )0.5 (1− kij ) |
|
∑∑xi x j (ai a j )0.5 (1− kij ) |
||||||||||||||||||||||||||
|
|
i=1 j=1 |
|
|
|
|
|
|
|
|
|
|
|
|
i=1 j=1 |
|
|
|
|
|
|
|
|
|||||||
ai= |
|
|
|
|
aciαi |
|
|
|
|
aciαi |
|
|
|
|
|
|||||||||||||||
aci= |
|
|
0.42748 |
|
(RTci )2 |
|
0.457235 |
(RTci )2 |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
Pci |
|
|
|
|
Pci |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
α0.5 |
= |
|
1+ m (1−T 0.5 ) |
|
|
1+ m (1−T 0.5 ) |
||||||||||||||||||||||||
i |
|
|
|
|
i |
|
|
|
|
|
|
|
ri |
|
|
|
|
|
i |
|
|
|
|
ri |
||||||
mi= |
|
0.48 |
+1.574ωi |
|
|
2 |
|
|
0.37646 +1.54226ωi |
2 |
||||||||||||||||||||
|
|
|
|
− 0.176ωi |
|
− 0.26992ωi |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
если ацентрический фактор > 0.49, используется |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
следующее уравнение: |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.379642 + (1.48503 − (0.164423 −1.016666ϖi )ϖi )ϖi |
||||||||||||
A= |
|
|
|
|
|
aP |
|
|
|
|
|
|
|
|
|
|
|
|
|
aP |
|
|
|
|
|
|||||
|
|
|
|
|
(RT )2 |
|
|
|
|
|
(RT )2 |
|
|
|
|
|||||||||||||||
B= |
|
|
|
|
|
bP |
|
|
|
|
|
|
|
|
|
|
|
|
|
bP |
|
|
|
|
|
|||||
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
|
|
||||
Кабади-Даннер
Модель Кабади-Даннера10(KD) - это модифицированное уравнение состояния Соава-Редлиха Квонга, позволяющее лучше рассчитывать равновесие пар-жидкость-жидкость для систем вода-углеводороды особенно в области малых концентраций.
Эта модель является усовершенствованием предыдущего варианта, который имел ограниченную область применения. Модификация основана на асимметричном правиле смешения; взаимодействие в водной фазе (с ее сильными водородными связями) рассчитывается как на основе взаимодействия углеводород-вода, так и на основе влияния углеводородов на взаимодействие вода-вода.
Уравнение Ли-Кеслера-Плокера
Уравнение Ли-Кеслера-Плокера является точным общим методом, применимым для расчета неполярных компонент и их смесей. Плокер и другие3 применил уравнение Ли-Кеслера к смесям. В свою очередь

Методы расчета свойств А - 9
уравнение Ли-Кеслера было получено как модификация уравнения Бенедикта-Вебера-Рубина (BWR).
z = z (0) + ωω(r) (z (r) − z (0) )
Фактор сжимаемости определяется следующим образом:
z= ρν = ρr νr = z(Tr , νr , Ak )
RT Tr
z = 1+ |
B |
+ |
C |
+ |
D |
+ |
|
νr2 |
|
||||
|
νr |
|
ν5r |
|||
где:
νr = ρc ν
RTc
C = c1 − c2 + c3
Tr Tr2
ω(0) = 0
C |
4 |
|
γ |
|
|
− γ |
||
|
β+ |
|
exp |
|
|
|||
T 3 |
ν2 |
ν2 |
ν2 |
|||||
|
|
|
|
|||||
r |
r |
|
r |
|
|
r |
|
|
B = b1 − b2 − b3 − b4
Tr Tr2 Tr3
D = d1 − d2
Tr
ω(r) = 0.3978
Правило смешения для расчета псевдокритических свойств выглядит следующим образом:
|
|
|
|
|
|
|
|
1 |
|
∑∑xi x j νcij |
|
|
|
|
|
|
|
||
|
|
|
|
Tcm |
= |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
η |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
Vc |
|
i j |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
где: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T = (T T )1 2 |
|
|
|
|
T = T |
|
T = T |
|
|||||||||||
c |
c |
|
c |
j |
|
|
|
|
c |
|
c |
|
c |
jj |
c |
j |
|||
ij |
i |
|
|
|
|
|
|
ii |
|
|
i |
|
|
|
|||||
νcm = ∑∑xi x j νcij |
|
|
νcij |
= |
1 |
(νci |
+ νc j |
) |
3 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 3 |
1 3 |
|
|
|
||
|
i |
|
j |
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
νc |
= zc |
RTc |
|
|
|
|
zc |
= 0.2905 −0.085ωi |
|
|
|||||||||
|
|
i |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
i |
i |
ρc |
|
|
|
|
i |
|
|
|
|
|
|
|
|
||||
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ρc |
= zc |
|
RTc |
|
|
|
|
zc |
= 0.2905 −0.085ωm |
|
|
||||||||
|
|
m |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
m |
m |
|
νc |
|
|
|
|
m |
|
|
|
|
|
|
|
|
|||
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ωm |
= ∑xi ωi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(А.1)
(A.2)
(А.3)
(А.4)
Пенг-Робинсон Стрижек-Вера
Уравнение состояния Пенга-Робинсона-Стрижека-Веры (PRSV) представляет собой двойную модификацию уравнения состояния PR, которая распространяет применение исходного метода PR на неидеальные системы. Хотя это уравнение еще относительно новое, предварительные испытания показали, что оно соответствует кривым упругости паров чистых компонентов и смесей значительно точнее, особенно при низкой упругости паров.
Оно успешно распространяется на расчеты неидеальных систем, давая такие же результаты, что и при использовании функций избыточной энергии Гиббса в уравнениях Вильсона, NRTL и UNIQUAC.

А - 10 Методы расчета свойств
Первая модификация уравнения состояния PR Стрижеком и Верой заключалась в обобщении величины "α", которая стала функцией
ацентрического фактора, и эмпирического параметра κi, применяемого для подгонки упругости паров чистых компонентов.
αi = [1+κi (1 - T 0r.5 ]2 |
|
κi = κ0i +κ1i (1+T 0ri.5 )(0.7 - T ri ) |
(А.5) |
κ0i = 0.378893 +1.4897153ωi - 0.17131848ωi2 +0.0196554ωi3
где:
κli= характеристический параметр чистого компонента
ωi= ацентрический фактор
Регулируемый член κ1i обеспечивает более точное соответствие кривым упругости паров чистых компонентов. Эти величины были подобраны с помощью регрессии на основе упругости паров чистых компонентов для всех компонентов библиотеки ХАЙСИС.
Для псевдокомпонентов, задаваемых для представления нефтяных
фракций, ХАЙСИС автоматически подбирает путем регрессии член κ1i для каждого псевдокомпонента по отношению к кривым упругости паров по ЛиКеслеру. Для индивидуальных гипотетических компонентов, добавляемых
пользователем,κ1i могут быть введены или они будут автоматически подобраны путем регрессии по отношению к корреляциям Ли-Кеслера, Гомеца-Тодоса и Рейделя.
Для дальнейшей модификации уравнения состояния PR использовались новые правила смешения. Для объемных и энергетических параметров использовались традиционные правила смешения, а правило смешения для aij было модифицировано так, что оно теперь зависит от состава. Хотя в исходной публикации были предложены два разных правила смешения, в ХАЙСИС включено только выражение Маргулиса для вышеупомянутого члена.
aij = (aii a jj )0.5 (1.0 − xi kij − x j k ji ) |
(А.6) |
где: |
kij ≠ k ji |
Если kij =kji , правила смешения сводятся к стандартному уравнению состояния PR.
Хотя для этого уравнения было обработано лишь ограниченное количество бинарных пар, наш опыт позволяет предположить, что PRSV с повышенной точностью может применяться для моделирования неидеальных систем, таких, как водно-спиртовые системы, углеводородно-спиртовые системы, а также углеводородные системы. Кроме того, поскольку в уравнении PRSV увеличена точность расчета упругости паров, следует ожидать увеличения точности расчета теплоты испарения.
Для каждой пары интерактивных параметров можно ввести различные значения.
Опции для кислых сред
Опции для кислых сред (Sour) доступны с пакетами PR и SRK. Опция ПенгаРобинсона для кислых сред объединяет уравнение состояния PR и Вильсоновскую модель Американского Нефтяного Института для кислых сред (API-Sour Model), в то время как опция Соава-Редлиха-Квонга для кислых сред использует уравнение состояния SRK с моделью Вильсона.

Методы расчета свойств А - 11
Опции для кислых сред используют соответствующее уравнение состояния для расчета фугитивности паровых и жидкостных углеводородных фаз, а также энтальпии для всех трех фаз. Значения К для всех водных фаз рассчитываются по методу Вильсона API-Sour. В этих опциях модель Вильсона применяется для учета ионизации H2S, CO2 и NH3 в водной фазе. Значение рН водной фазы может регулироваться добавлением щелочи (NaOH) или любой карбоновой кислоты из библиотеки компонентов ХАЙСИС. Модель водной фазы базируется на модификации исходной модели Ван-Кревелена, где сняты многие ключевые ограничения. Подробная информация об этой модели имеется в публикациях АРI.
Исходная модель применима для температур от 20 до 140°С и давлений до 3.50 кг/см. Применение уравнения состояния PR, либо SRK для учета неидеальности паровой фазы расширяет этот диапазон, но ввиду отсутствия экспериментальных данных точный диапазон указать невозможно. Диапазон приемлемого давления для моделей ХАЙСИС в значительной степени зависит от концентрации кислых газов и воды. Метод достаточно надежен до тех пор, пока парциальное давление воды менее 7 кг/см2.
Поскольку эти опции выполняют ионный баланс при каждом вычислении значения К, расчет испарения происходит намного медленнее по сравнению со базовыми уравнениями состояния.
Эти опции можно применять для расчета отпарных колонн кислой воды, систем очистки воды, атмосферных нефтяных колонн и любых других процессов, содержащих углеводороды, кислые газы и воду. При отсутствии водной фазы эти опции дадут те же результаты, что и базовые уравнения состояния PR или SRK, в зависимости от того, какую опцию Вы выбрали.
Зудкевич-Иоффе
Модель Зудкевича-Иоффе - это модифицированное уравнение состояния Редлиха-Квонга. Эта модель дает лучшие результаты при расчете парожидкостного равновесия в углеводородных системах и системах, содержащих водород. Наиболее важное отличие этой модели от уравнения Редлиха Квонга - это более высокая точность расчета равновесия чистых компонентов и упрощение метода определения необходимых коэффициентов уравнения.
Расчет энтальпии для этой модели производится по уравнению Ли-Кеслера.
Расчет энтальпии для уравнений состояния
Для всех уравнений состояния, за исключением ZJ и LKP, можно задать способ расчета энтальпии: с помощью уравнения состояния или с помощью уравнения Ли-Кеслера. Модели ZJ и LKP используют уравнение Ли-Кеслера для расчета энтальпии. Выбор метода расчета энтальпии проводится с помощью селективных кнопок в групповой рамке Метод расчета энтальпии для уравнения состояния.
Расчет энтальпии по Ли-Кеслеру может оказаться более точным для тяжелых углеводородов, но требует больше ресурсов, поскольку используются две модели.
Выбор селективной кнопки Ли-Кеслер приводит к комбинированным термодинамическим пакетам, где для расчета парожидкостного равновесия используется одно из уравнений состояния (PR или SRK), а уравнение Ли-

А - 12 Методы расчета свойств
Кеслера - для расчета энтальпии и энтропии (различия между уравнениями состояния и уравнением Ли-Кеслера рассмотрены в разделе А.4 - Расчет энтальпии и энтропии).
Уравнение Ли-Кеслера дает результаты, сравнимые с результатами, полученными на основе базовых уравнений состояния, и имеет ту же область применения. Заметим, что PR имеет несколько большую область применения, чем SRK.

Методы расчета свойств А - 13
Опция Нулевые параметры Kij
Если бинарные коэффициенты для углеводородных компонент не известны и выбрана опция Углеводороды - расчет, остальные -> 0, ХАЙСИС автоматически определяет эти коэффициенты.
Эта опция задается на закладке Бинарные коэффициенты окна Пакет свойств.
Если выбран вариант Все->0, то расчеты бинарных коэффициентов не проводятся вовсе. Однако бинарные коэффициенты, имеющиеся в библиотеке, сохраняются.
Вариант Все->0 может оказаться полезным при сравнении результатов с расчетами, полученными с помощью других коммерческих программ, которые далеко не всегда могут рассчитать бинарные коэффициенты для углеводородов с высоким молекулярным весом.
A.3.2 Модели активности
Хотя модели уравнений состояния являются точными для большинства углеводородных сред в широком диапазоне рабочих условий, их применение ограничено главным образом неполярными и малополярными компонентами. Полярные и неидеальные химические системы традиционно рассчитываются с помощью двойственных моделей. В этих методах уравнение состояния применяется для расчета коэффициентов летучести паров (обычно предполагается идеальный газ или используется уравнение состояния Редлиха-Квонга, Пенга-Робинсона или SRK, хотя в некоторых случаях может быть использовано вириальное уравнение состояния), а модель коэффициентов активности применяется для жидкой фазы. Несмотря на то, что ведутся интенсивные исследования по распространению уравнений состояния, например, уравнения PRSV, в химическую область, свойства химических систем по-прежнему рассчитываются главным образом с помощью моделей активности.
Модели активности по своей природе являются гораздо более эмпирическими по сравнению с методами расчета свойств, используемыми в области переработки углеводородов. Например, они не могут быть использованы с такой же надежностью, как уравнения состояния для обобщенного применения или экстраполяции на рабочие условия, где нет экспериментальных данных. Регулируемые параметры должны быть найдены на основе представительных экспериментальных данных, и их применение должно быть ограничено диапазоном средних давлений. Следовательно, при реализации этих моделей следует проявлять больше осторожности.
Константа равновесия Ki для компонента i определяется с помощью коэффициента летучести паровой фазы и коэффициента активности жидкой фазы по следующему уравнению:
Ki = |
yi |
|
|
|
xi |
|
(A.7) |
||
|
|
|||
|
γ |
|
f o |
|
|
i |
|
||
= |
|
i |
|
|
Pφi |
|
|||
|
|
|||
где yi = мольная доля компонента I в паровой фазе xi = мольная доля компонента I в жидкой фазе
γi = коэффициент активности жидкой фазы компонента I fio = летучесть компонента I при нормальных условиях

А - 14 Методы расчета свойств
P = давление в системе
φi = коэффициент летучести паровой фазы компонента i
Для идеальных растворов коэффициент активности равен единице, а для большинства химических (неидеальных) систем такая аппроксимация некорректна. Разнородные по своей природе химические продукты обычно не только проявляют большие отклонения от идеального раствора, но при этом отклонение сильно зависит от состава. Для учета этой неидеальности были созданы модели активности для расчета коэффициентов активности компонентов в жидкой фазе. Выведенные корреляции были основаны на
функции избыточной энергии Гиббса, которая определяется как разность действительной энергии Гиббса смеси и функции Гиббса идеального раствора при той же температуре и при том же давлении.
Для многокомпонентной смеси, состоящей из ni молей компонента i, суммарная избыточная свободная энергия Гиббса представляется следующим образом:
G E = RT∑(ni ln γi ) |
(А.8) |
где γi - коэффициент активности компонента i.
Индивидуальные коэффициенты активности для любой системы могут быть получены из выражения для функции избыточной энергии Гиббса и уравнения Гиббса-Дюгема. Первые модели, такие как модели Маргулиса и Ван-Лаара, представляли собой эмпирические оценки функции Гиббса, что ограничивало их применение, но более поздние модели, такие, как модели Вильсона, NRTL и UNIQUAC, использовали концепцию локального состава, что увеличило их надежность. Все эти модели используют концепцию параметров бинарного взаимодействия и требуют увязки с экспериментальными данными.
Поскольку модели Маргулиса и Ван-Лаара менее сложны по сравнению с моделями Вильсона, NRTL и UNIQUAC, они требуют меньше времени процессора для расчета фазового равновесия. Однако, это более старые, более эмпирические по своей природе модели, и они обычно дают худшие результаты для неидеальных смесей, таких, как системы спиртыуглеводороды, особенно для разбавленных растворов. Модель Чен-Нулла обеспечивает возможность объединять различные модели активности в пределах согласованной термодинамической схемы. Каждая пара может быть представлена с помощью модели, которая наилучшим образом описывает ее поведение. Ниже в таблице приводятся рекомендации по использованию моделей для различных областей применения. (Более подробно о моделях активности смотри в работах "Свойства газов и жидкостей"8 и "Молекулярная термодинамика равновесия жидких сред"9).
|
Системы |
|
Маргуле |
Ван- |
Вильсо |
|
NRTL |
|
|
UNIQUAC |
|
|
|
|
|
|
|
||||||
|
|
|
с |
Лаар |
н |
|
|
|
|
|
|
|
Бинарные систмы |
A |
A |
A |
|
A |
|
A |
|||
|
|
|
|
|
|
|
|
|
|||
|
Многокомпонентные |
LA |
LA |
A |
|
A |
|
A |
|||
|
системы |
|
|
|
|
|
|
|
|
|
|
|
Азеотропные системы |
A |
A |
A |
|
A |
|
A |
|||
|
Равновесие жидкость- |
A |
A |
N/A |
|
A |
|
A |
|||
|
жидкость |
|
|
|
|
|
|
|
|
|
|
|
Разбавленные системы |
? |
? |
A |
|
A |
|
A |
|||
|
Ассоциирующие системы |
? |
? |
A |
|
A |
|
A |
|||
|
Полимеры |
N/A |
N/A |
N/A |
|
N/A |
|
A |
|||
|
Экстраполяция |
? |
? |
G |
|
G |
|
G |
|||
|
|
|
|
|
|
|
|
|
|||
|
A = применимо; N/A = не применимо; |
? = применение под вопросом; |
|
|
|
||||||
|
G = хорошо применимо; LA = применение ограничено |
|
|
|
|
|
|
||||

Методы расчета свойств А - 15
Неидеальность паровой фазы может быть учтена для каждой модели активности путем выбора уравнения состояния Редлиха-Квонга (RK), ПенгаРобинсона (PR) или SRK в качестве модели паровой фазы. Если для паровой фазы применяется одно из уравнений состояния, то для коррекции жидкой фазы всегда используется стандартная форма корректирующего коэффициента Пойнтинга. Если в паровой фазе происходит процесс димеризации, в качестве модели паровой фазы используется вириальное уравнение состояния.
Бинарные параметры, требующиеся для моделей активности, были подобраны методом регрессии на основе данных паро-жидкостного равновесия, взятых из DECHEMA, Chemistry Data Series12. В библиотеке ХАЙСИС в настоящее время имеется свыше 16000 подобранных бинарных пар. Кроме того, хранятся структуры всех библиотечных компонентов, для которых применимы расчеты по UNIFAC. В этом случае поправкой Пойнтинга на жидкую фазу пренебрегают.
Все бинарные параметры, хранящиеся в библиотеке ХАЙСИС, были рассчитаны методом регрессии на основе модели идеального газа для паровой фазы.
Если Вы пользуетесь встроенными бинарными параметрами ХАЙСИС, следует применять модель идеального газа. Все модели активности, за исключением уравнения Вильсона, автоматически рассчитывают три фазы, если известен правильный набор энергетических параметров. Значения упругости паров, используемые при расчете фугитивности в стандартном состоянии, определялись с помощью модифицированного уравнения Антуанана с коэффициентами для чистых компонентов из библиотеки ХАЙСИС.
При расчете внутренних бинарных параметров ХАЙСИС данные трехфазного равновесия не используются.
Если выбранные компоненты проявляют склонность к димеризации в паровой фазе, то в качестве модели паровой фазы следует выбрать вириальное уравнение состояния. ХАЙСИС содержит вычисленные параметры для многих карбоксильных кислот, а если необходимые параметры отсутствуют, может рассчитать их на основе данных о чистых компонентах. Подробно о вириальном уравнении состояния рассказывается в разделе А.3.3, посвященном моделям активности паровой фазы.
Общие замечания
Двойственные модели для расчета химических систем с помощью моделей активности не могут быть использованы с той же степенью гибкости и надежности, как и уравнения состояния для углеводородных систем. Следует предусмотреть некоторые способы проверки, чтобы удостовериться в надежности расчета свойств.
•Проверьте пакет свойств, выбранный для рассматриваемой системы, и посмотрите, насколько он соответствует упругости паров чистых компонентов. Хотя рассчитанные значения упругости паров чистых компонентов должны быть, как правило, приемлемыми, следует помнить, что кривая упругости пара описывает широкий диапазон температур. Повышенная точность может быть получена путем подбора параметров с помощью регрессии в требуемом диапазоне температур.
•Автоматический расчет с помощью UNIFAC энергетических параметров в ХАЙСИС является очень полезным средством и имеется для всех моделей активности. Однако, этим следует пользоваться с осторожностью. Стандартные рассчитанные значения ХАЙСИС, весьма вероятно, обеспечат лучшие результаты для бинарных систем, чем параметры, генерируемые UNIFAC. Как правило, параметры,

А - 16 Методы расчета свойств
генерируемые UNIFAC, следует использовать в последнюю очередь, лишь как последнюю возможность.
•Когда это возможно, всегда используйте экспериментальные данные для подбора энергетических параметров с помощью регрессии. Энергетические параметры, которые хранятся в системе, были получены регрессией экспериментальных данных. Однако можно получить более точные значения, если проводить регрессию в узком диапазоне рабочих условий. Параметры, подобранные с помощью регрессии, основаны на данных, полученных при атмосферном давлении. Экстраполяцией до более высоких или низких значений давления следует пользоваться с осторожностью.
•Проверьте точность модели для азеотропных систем. Для описания азеотропной системы с приемлемой точностью может потребоваться дополнительная аппроксимация. Проверьте не только температуру, но и составы.
•Если предполагаются условия трехфазной системы, может потребоваться дополнительная аппроксимация параметров для надежного описания условий равновесия VLL (пар-жидкость-жидкость).
•Улучшение согласованности данных по равновесию может быть достигнуто включением зависимости энергетических параметров от температуры. Однако, в зависимости от достоверности или рабочего диапазона, это может привести к вводящим в заблуждение результатам при экстраполяции за пределами аппроксимированного диапазона температур.
По умолчанию ХАЙСИС подбирает с помощью регрессии только параметры aij, в то время как параметры bij устанавливаются равными нулю, то есть член aij принимается независимым от температуры. Зависимость от температуры может быть учтена заданием значения члена bij. Матрицу значений bij можно вызвать, нажав селективную кнопку Bij (обратите внимание: все бинарные параметры - нули или пробелы.)
Неизвестные коэффициенты активности рассчитываются по UNIFAC для температуры, указанной в поле Расчетная температура UNIFAC для всех пар компонент, выбранных заранее.
При использовании уравнения NRTL, обобщенного уравнения NRTL или расширенного уравнения NRTL доступны более двух матриц. Второй доступной матрицей является матрица коэффициентов Bij, а третьей - матрица αij, причем αij = αji. Для любой пары компонентов aij имеется соответствующее значение α.
Отсутствие растворимости
Эта опция предназначена для плохо растворимых друг в друге жидких фаз, таких, как вода и углеводороды. В этой системе углеводородные компоненты относительно нерастворимы в водной фазе, а растворимость воды в углеводородной фазе может быть вполне заметной. Ограниченную взаимную растворимость можно рассчитать с помощью любой из четырех моделей активности, упомянутых выше, за исключением уравнения Вильсона.
Модель Вильсона не описывает равновесие жидкость-жидкость.
Эту опцию можно использовать для произвольных сочетаний компонент. Если нажать кнопку Строка в столбце, компонент строки будет нерастворим в компоненте столбца. Если нажать кнопку Столбец в строке, компонент столбца будет нерастворим в компоненте строки. Если нажать кнопку Все в строке, все компоненты будут нерастворимы в компоненте строки. ХАЙСИС заменит имеющиеся бинарные коэффициенты на рассчитанные значения. Обратите внимание, что рассчитываются как aij,

Методы расчета свойств А - 17
так и bij. Эти параметры получены регрессией данных по взаимной
растворимости углеводородов n-C5, n-C6, n-C7 и n-C8 и H2O в температурном интервале от 313 К до 473 К.
Чен-Нулл
Модель Чен-Нулла предусматривает совместимую структуру применения разных существующих моделей активности для отдельных пар. Этот способ позволяет использовать наилучшую модель для каждой пары компонентов.
Модель требует три набора коэффициентов для каждой пары компонентов, соответственно с помощью матриц A, B и C. Смотрите следующие разделы, где объяснены условия применения каждой модели.
Форма уравнения Чен-Нулла
По модели Чен-Нулла обобщенное многокомпонентное уравнение выглядит следующим образом:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
∑A j,i x j |
∑R j,i |
x j |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
∑A j,k x j |
∑R j,k x j |
|
|||||||||||||
2 ln ΓiL = |
|
|
j |
|
j |
|
+ ∑xk |
|
j |
|
|
j |
|
. |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
∑V j,i |
|
k |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
∑S j,i x j |
x j |
|
|
|
∑S j,k x j |
∑V j,k x j |
(А.9) |
||||||||||
|
|
|
j |
|
j |
|
|
|
|
j |
|
|
j |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Ai,k |
+ |
Ri,k |
|
|
- |
Si,k |
|
|
|
- |
V i,k |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
∑R j,k x j |
∑S j,k x j |
|
|
|
|
|
|||||||||||
|
∑A j,k x j |
|
|
|
∑V j,k x j |
|
|
|
||||||||||||
|
|
j |
|
j |
|
|
|
j |
|
|
|
|
j |
|
|
|
|
|
||
Каждый параметр этого уравнения специально определен для каждой из доступных моделей активности.
Описание параметров
Уравнение регулярного раствора выглядит следующим образом:
|
|
ν L (δ |
i |
−δ |
j |
)2 |
|
|
A |
|
|
|
|
|
|
|
|
|
|
A |
= |
i |
|
|
R |
= |
i, j |
V |
i, j |
= |
R |
S |
i, j |
= |
R |
i, j |
(А.10) |
||
i, j |
|
RT( o K ) |
|
i, j |
|
Aj,i |
|
|
i, j |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
δi - это параметр растворимости в (кал/см3)1/2 и υiL - объем жидкости на линии насыщения в см3/моль, рассчитанные по уравнению:
|
|
|
|
νL =ν |
ω,i |
(5.7 + 3T |
) |
|
|
|
|
|
|
|
|
(А.11) |
|||||||
|
|
|
|
|
i |
|
|
|
|
|
r,i |
|
|
|
|
|
|
|
|
|
|
|
|
Уравнения Ван Лаара, Маргулиса и Скатчарда-Хамера используют |
|||||||||||||||||||||||
следующие параметры: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уранение |
Aij |
|
|
|
|
|
Rij |
|
|
|
|
Sij |
Vij |
|
|||||||||
Ван Лаара |
|
|
ln γi∞, j |
|
|
|
|
Ai , j |
|
|
|
R |
|
|
R |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
Aj ,i |
|
|
i , j |
|
|
|
i , j |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Маргулиса |
|
|
2ln γi∞, j |
|
|
|
|
Ai , j |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
ln γ |
∞ |
|
|
|
|
1 |
|
|
1 |
|
|
|
||||||||
|
|
|
i, j |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
1 |
+ |
|
|
|
|
A |
j ,i |
|
|
|
|
|
|
|||||||||
|
|
∞ |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
ln γ j,i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Скатчарда- |
|
|
2ln γi∞, j |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Хамера |
|
|
|
|
|
|
|
|
Ai , j |
|
|
νi∞ |
|
|
|
νi∞ |
|
|
|||||
|
|
ln γ |
∞ |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
i, j |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
∞ |
|
∞ |
|
||||||||||
|
|
|
|
|
|
|
Aj ,i |
|
|
|
|
|
|||||||||||
|
|
1 + |
|
|
|
|
|
|
|
νj |
|
|
νj |
|
|||||||||
|
|
|
∞ |
|
|
|
|
|
|
||||||||||||||
|
|
|
ln γ j,i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||

А - 18 |
Методы расчета свойств |
|
||
|
В этих уравнениях: |
|
||
|
ln γ i,∞j = ai, j + |
bi, j |
+ cij T |
(А.12) |
|
|
|||
|
|
T |
|
|
где температура (T) задана в K.
Заметьте, что эти уравнения отличаются от оригинальных уравнений Ван Лаара и Маргулиса, в которых используется соотношение a + bT. Однако поскольку в ХАЙСИС содержатся только значения aij, никаких проблем из-за
различия уравнений не возникает.
Если с помощью пакета регрессий ХАЙПРОП рассчитаны параметры взаимодействия для какой-либо модели, доступной в Чен-Нулл, эти параметры считать не удастся.
Уравнение NRTL для Чен-Нулла использует следующие параметры:
Ai, j = 2τi, jVi, j |
Ri, j =1 |
|
Vi, j = exp(−ci, jτi, j ) |
|
Si, j =1 |
τ i, j = ai, j + |
bi, j |
(А.13) |
|
T(K ) |
||||
|
|
|
Выражение для члена τ по Чен-Нуллу включает величину R из уравнения NRTL в значения aij и bij. Таким образом, значения, полученные из уравнения NRTL с помощью Чен-Нулла не совпадают со значениями из нормального уравнения NRTL. При выборе модели NRTL для бинарных пар aij будет пустым (по существу равным члену bij из нормального уравнения NRTL), а величине bij будет присвоено значение. Матрица Сij содержит величину α обычного уравнения NRTL и полагается симметричной.
Общее уравнение Чен-Нулл следующее:
A |
= a |
i, j |
+ |
bi, j |
R |
= |
Ai, j |
V |
i, j |
= C |
i, j |
S |
i, j |
= C |
i, j |
(А.14) |
|
|
|
|
|||||||||||||||
i, j |
|
|
T(K ) |
i, j |
|
Aj,i |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Во всех случаях: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
Ai,i = 0 |
|
|
|
|
|
|
|
(А.15) |
|
|
|
|
|
|
Ri,i |
= Si,i |
= V i,i |
= 1 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
За исключением варианта регулярного раствора (Regular Solution) во всех
моделях могут быть использованы 6 констант: ai,j, aj,i, bi,j, bj,i, ci,j и cj,i для каждой пары компонентов. Для всех моделей, если константы неизвестны,
они могут быть рассчитаны по методу UNIFAC VLE или LLE, с помощью опции Нерастворимы или с использованием коэффициентов закона Генри для соответствующих компонентов. Для основного уравнения Чен-Нулла члены cij принимаются равными 1.
Расширенный и обобщенный методы NRTL
Эти методы построены на базы модели NRTL. В отличие от «базовой» модели NRTL в этих методах для описания коэффициентов активности компонентов используется большее количество параметров. Методы применимы к системам, обладающим следующими особенностями:
•значительные различия в температурах кипения компонент
•необходимость одновременно рассчитывать равновесие пар-жидкость и жидкость-жидкость (VLE и LLE) при значительной разности температур кипения или концентрации компонент
Для обобщенной модели NRTL можно выбрать формат для вычисления величин τij и aij.

Методы расчета свойств А - 19
Варианты τij и aij
τ |
i, j |
= A |
|
+ |
|
Bij |
+ |
Cij |
|
+ F T +G |
ij |
ln(T) |
|||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
ij |
|
|
T |
T 2 |
|
|
|
ij |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
αij |
|
= Alp1ij |
+ Alp2ij T |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
A + Bij |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
τi, j |
= |
|
ij |
|
T |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
αij = Alp1ij |
|
|
|
|
|
|
||||||||||
|
τ |
i, j |
= A |
|
+ |
Bij |
|
+ F T +G |
ij |
ln(T) |
|||||||||||||
|
|
|
|
||||||||||||||||||||
|
|
|
|
ij |
|
|
T |
|
|
|
|
ij |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
αij |
|
= Alp1ij |
+ Alp2ij T |
|
|
|
|||||||||||||
|
|
|
|
τ |
i, |
j |
= A |
|
+ B |
ij |
t + |
Cij |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
ij |
|
|
|
|
|
|
|
T |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
αij |
|
= Alp1ij |
+ Alp2ij T |
|
|
|
|||||||||||||
где: Т - в К, t - в С
τi, j = Aij + BTij
αij = Alp1ij
Различные варианты уравнений можно увидеть в падающем списке на закладке Бинарные коэффициенты в окне Пакет свойств.
В зависимости от выбранной Вами формы уравнения, Вы можете задать различные энергетические параметры компонент. При использовании обобщенной модели NRTL на закладке Бинарные коэффициенты имеются селективные кнопки, обеспечивающие доступ к матрицам Aij, Bij, Cij, Fij, Gij, Alp1ij и Alp2ij.
Расширенная модель NRTL позволяет вводить коэффициенты матриц Aij, Bij, Cij, Fij, Gij, Alp1ij и Alp2ij с помощью соответствующих селективных кнопок. В этом случае нет возможности выбирать формат для τij и aij, используется следующий формат:
τ |
i, j |
= A |
+ B t + |
Cij |
|
|
|
||||
|
ij |
ij |
T |
(А.16) |
|
|
|
|
|
αij = Alp1ij + Alp2ij Tг
где T- температура в К, а t - температура в С.
Уравнение Маргулиса
Уравнение Маргулиса было первым, построенным на основе избыточной энергии Гиббса. Это уравнение не имеет теоретической основы, но оно полезно для быстрых расчетов и интерполяции данных. ХАЙСИС использует расширенное многокомпонентное уравнение Маргулиса, имеющее до четырех регулируемых параметров на бинарную пару.
Это уравнение не следует применять для экстраполяции за пределами диапазона, для которого были аппроксимированы энергетические параметры.
Четыре регулируемых параметра уравнения Маргулиса в ХАЙСИС - это члены aij и aji (не зависящие от температуры), bij и bji (зависящие от температуры). В уравнении будут использоваться значения параметров, хранящиеся в ХАЙСИС, или другие значения, заданные пользователем для более точного описания имеющихся экспериментальных данных.

А - 20 Методы расчета свойств
Модель коэффициентов активности Маргулиса представлена следующим уравнением:
|
i |
[ |
|
i ] |
2 |
[ |
i |
i |
i |
i ] |
|
ln γ |
|
= 10. |
− x |
|
|
A |
+ 2x |
(B |
− A ) |
(А.17) |
где: γI = коэффициент активности компонента i xi =мольная доля компонента i
j=n |
|
|
(a |
ij |
+ b T ) |
|||||
Ai = ∑ |
x j |
|
|
|
ij |
|
|
|||
|
(1.0 − xi ) |
|
||||||||
j=1 |
|
|
|
|
|
|||||
j=n |
|
(a |
ji |
+ b |
ji |
T ) |
||||
Bi = ∑ |
x j |
|
|
|
|
|
||||
|
(1.0 − xi ) |
|||||||||
j=1 |
|
|
|
|||||||
T = температура (K)
n = общее число компонентов
aij =не зависящие от температуры энергетические параметры компонентов i и j
bij = зависящие от температуры энергетические параметры компонентов i и j [1/K]
aji = не зависящие от температуры энергетические параметры компонентов j и i
bji = зависящие от температуры энергетические параметры компонентов j и i [1/K]
Уравнение NRTL
Это уравнение NRTL (Non-Random-Two-Liquid), предложенное Реноном и Праузницем в 1968 году, является модификацией уравнения Вильсона. Оно использует статистическую механику и теорию жидкой ячейки для отображения структуры жидкости. Эта концепция в сочетании с моделью локального состава дает уравнение, способное представлять различные типы равновесия пар-жидкость, жидкость-жидкость, пар-жидкость-жидкость.
Подобно уравнению Вильсона, уравнение NRTL термодинамически корректно и может быть применено к трехкомпонентным системам и системам более высокого порядка, используя параметры, вычисленные методом регрессии по данным бинарного равновесия. Точность уравнения сравнима с точностью уравнения Вильсона для систем с парожидкостным равновесием.
Уравнение NRTL в ХАЙСИС содержит пять регулируемых параметров (зависящих и не зависящих от температуры). Уравнение NRTL сочетает достоинства уравнений Вильсона и Ван-Лаара:
•подобно уравнению Ван-Лаара, оно не требует чрезмерно большого времени процессора и может достаточно хорошо представлять равновесие жидкость-жидкость.
•в отличие от уравнения Ван-Лаара, оно может применяться для разбавленных систем и углеводородно-спиртовых смесей, хотя уравнение Вильсона лучше описывает углеводородно-спиртовые системы.
Из-за математической структуры уравнения NRTL оно может давать ложные зоны расслаивания.

Методы расчета свойств А - 21
Уравнение NRTL в ХАЙСИС имеет следующий вид:
|
j=n |
|
|
|
|
m=n |
|
|
|
∑τji x jGji |
|
|
|
|
|||
|
j=n |
xjGij |
|
|
∑τmj xm Gmj |
|
||
ln γ i = |
j=1 |
+ ∑ |
|
τij - |
m=1 |
|
(А.18) |
|
|
|
|
|
|
||||
k=n |
k=n |
k=n |
||||||
|
∑xk Gki |
j=1 |
|
|
|
∑xk Gkj |
|
|
|
|
∑xk Gkj |
|
|
|
|||
|
k=1 |
|
k=1 |
|
|
k=1 |
|
|
где: γi = коэффициент активности компонента i
Gij = exp[−τijαij ]
τ = aij + bij T ij RT
xi = мольная доля компонента i T = температура (K)
n = общее число компонентов
aij =не зависящие от температуры энергетические параметры компонентов i и j (cal/gmol)
bij = зависящие от температуры энергетические параметры компонентов i и j (cal/gmol-K)
αij = не рандомизированная константа бинарного взаимодействия заметьте, что αij = αji для всех бинарных пар
Пять регулируемых параметров уравнения NRTL в ХАЙСИС - это члены aij,
aji, bij, bji и αij. В расчетах используются значения параметров, хранящиеся в ХАЙСИС, или другие значения, заданные пользователем, позволяющие лучше описать конкретную смесь.
Уравнение UNIQUAC
Уравнение UNIQUAC (UNIversal QuAsi Chemical), предложенное Абрамсом и Праузницем в 1975 году, использует статистическую механику и квазихимическую теорию Гуггенхайма для представления структуры жидкости. Уравнение может представлять различные типы равновесия (жидкость-жидкость, пар-жидкость, пар-жидкость-жидкость) с точностью, сравнимой с уравнением NRTL, но не требует нерандомизированный фактор. Уравнение UNIQAC значительно более детальное и развитое по сравнению со всеми другими моделями активности. Его главное достоинство состоит в том, что может быть получено хорошее представление как паро-жидкостного равновесия, так и равновесия жидкость-жидкость для большого диапазона неэлектролитных смесей на основе всего двух параметров на бинарную систему. Найденные параметры обычно слабо зависят от температуры, что повышает достоверность экстраполяции.
Уравнение UNIQUAC использует концепцию локального состава, предложенную Вильсоном. Поскольку основной переменной для концентрации является поверхностная доля, а не мольная доля, уравнение может применяться для систем, содержащих молекулы самых разных размеров и форм, например, полимерные растворы. Уравнение UNIQUAC может быть использовано для любого диапазона смесей, содержащих воду, спирты, нитрилы, амины, эфиры, кетоны, альдегиды, галогенуглеводороды и углеводороды.
ХАЙСИС содержит следующую четырехпараметрическую расширенную форму уравнения UNIQUAC. Четыре регулируемых параметра в уравнении UNIQUAC в ХАЙСИС - это члены aij и aji (не зависящие от температуры), bij и bji (зависящие от температуры). Уравнение будет использовать значения

А - 22 Методы расчета свойств
параметров, хранящиеся в ХАЙСИС, или любые значения, заданные пользователем, позволяющие лучше описать конкретную смесь.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
j=n |
|
|
|
|
|
|
|
j=n |
|
|
|
|
|
j=n |
|
θ j τij |
|
|
|
|
|
|
Φ |
i |
|
|
|
|
θ |
i |
|
|
|
Φ |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ln γ |
i |
= ln |
|
|
+0.5Zq |
i |
ln |
|
|
+ L |
− |
|
|
∑ |
L |
j |
x |
j |
+q |
i |
(10. −ln |
∑ |
θ |
j |
τ |
ji |
) −q |
i ∑ |
|
|
|
(А.1 |
|||
x |
|
Φ |
x |
|
k =n |
||||||||||||||||||||||||||||||
|
|
i |
|
|
|
|
i |
|
i |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
j=1 |
|
|
|
|
|
|
|
j=1 |
|
|
|
|
|
j=1 |
|
∑θk τkj |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k =1 |
|
|
где: γi = коэффициент активности компонента i xi = мольная доля компонента i
T = температура (K)
n = общее число компонентов
Lj = 0.5Z(rj-qj)-rj+1
θ |
|
= |
qi xi |
|
|
|
|
|
|
i |
∑q j x j |
|
|
|
|||||
|
|
|
|
|
|||||
|
|
|
|
a |
ij |
+ b T |
|||
τ ij = exp− |
|
|
ij |
|
|||||
|
|
RT |
|||||||
|
|
|
|
|
|
|
|||
Z = 10.0 координирующее число
aij =не зависящие от температуры энергетические параметры компонентов i и j(cal/gmol)
bij = зависящие от температуры энергетические параметры компонентов i и j (cal/gmol-K)
qi = поверхностный параметр Ван-дер-Ваальса - Awi /(2.5e9) Aw = поверхность Ван-дер-Ваальса
ri = объемный параметр Ван-дер-Ваальса - Vwi /(15.17) Vw = объем Ван-дер-Ваальса
Уравнение Ван-Лаара
Уравнение Ван-Лаара было первым уравнением, имеющим физический смысл, которое описывало избыточную энергию Гиббса. Уравнение ВанЛаара в ХАЙСИС является модифицированной формой уравнения, описанного в работе "Фазовое равновесие в технологических расчетах" Нулла. Это уравнение хорошо описывает многие системы, особенно равновесие жидкость-жидкость. Оно может применяться для систем, проявляющих положительные или отрицательные отклонения от закона Рауля, однако оно не может рассчитывать минимум и максимум коэффициента активности. Поэтому это уравнение обычно плохо срабатывает для систем, содержащих галогенуглеводороды и спирты. Вследствие эмпирического характера уравнения следует соблюдать осторожность при анализе многокомпонентных систем. Кроме того, оно обладает тенденцией предсказывать существование двух жидких фаз, когда они не существуют.
Уравнение Ван-Лаара также дает плохие результаты для разбавленных систем и не может представлять многие общепринятые системы, такие, как смеси спиртов и углеводородов, с приемлемой точностью.
Уравнение Ван-Лаара имеет некоторые преимущества по сравнению с другими моделями активности, а именно: оно требует меньше затрат времени процессора и может описывать системы с ограниченной растворимостью, а также трехфазное равновесие. ХАЙСИС использует следующую расширенную многокомпонентную форму уравнения Ван-Лаара:
ln γ i = Ai [10. − zi ]2 (10. + Ei zi )

Методы расчета свойств А - 23
где: γi = коэффициент активности компонента i xi = мольная доля компонента i
j=n |
|
|
(a |
ij |
+ b T ) |
|||||
Ai = ∑ |
x j |
|
|
|
ij |
|
|
|||
|
(1.0 − xi ) |
|
||||||||
j=1 |
|
|
|
|
|
|||||
j=n |
|
(a |
ji |
+ b |
ji |
T ) |
||||
Bi = ∑ |
x j |
|
|
|
|
|
||||
|
(1.0 − xi ) |
|||||||||
j=1 |
|
|
|
|||||||
Ei = -4.0 если AiBi<0.0, иначе 0.0
zi = [ + Ai xi − ]
Ai xi Bi (10. x i )
T = температура (K)
n =общее число компонентов
aij =не зависящие от температуры энергетические параметры компонентов i и j
bij = зависящие от температуры энергетические параметры компонентов i и j [1/K]
aji = не зависящие от температуры энергетические параметры компонентов j и i
bji = зависящие от температуры энергетические параметры компонентов j и i [1/K]
Четыре регулируемых параметра уравнения Ван-Лаара в ХАЙСИC - это величины aij, aji, bij и bji. При расчете используются значения параметров, хранящиеся в ХАЙСИМ, или заданные пользователем значения, позволяющие лучше описать конкретную смесь.
Уравнение Вильсона
Уравнение Вильсона, предложенное Вильсоном в 1964 году, было первым уравнением, описывающим коэффициент активности, в котором применялась модель локального состава для получения выражения избыточной энергии Гиббса. Оно предлагает последовательный термодинамический подход к расчету многокомпонентной смеси на основе данных бинарного равновесия. Наш опыт показывает, что уравнение Вильсона позволяет достаточно надежно рассчитывать системы вне области, в которой были получены энергетические параметры (экстраполяция).
Уравнение Вильсона неприменимо для описания равновесия жидкостьжидкость.
Хотя уравнение Вильсона является более сложным и требует больше затрат времени процессора по сравнению с уравнениями Ван-Лаара и Маргулиса, оно может удовлетворительно представлять почти все неидеальные жидкостные растворы, за исключением электролитов и растворов, проявляющих ограниченную растворимость. Уравнение Вильсона отлично рассчитывает трехкомпонентные равновесные смеси, используя параметры, подобранные регрессией только на основе бинарных данных. Уравнение Вильсона дает такие же результаты, что и уравнения Маргулиса и Ван-Лаара для слабо-неидеальных систем, но по мере возрастания неидеальности систем уравнение Вильсона будет описывать эти системы все с большей точностью.
Уравнение Вильсона в ХАЙСИC требует от двух до четырех регулируемых параметров для бинарной смеси. Четыре регулируемых параметра уравнения Вильсона в ХАЙСИC - это члены aij и aji (не зависящие от температуры), bij и bji (зависящие от температуры). В зависимости от

А - 24 Методы расчета свойств
имеющейся информации два последних параметра могут быть приравнены нулю.
Задание всех четырех параметров равными нулю не сводит систему к идеальному раствору, отклонение от идеальности возникает вследствие разницы в молекулярных размерах.
Хотя уравнение Вильсона содержит члены для учета температурной зависимости, следует быть осторожным при экстраполяции. Модель активности Вильсона в ХАЙСИС имеет следующий вид:
|
|
|
|
|
|
j=n |
k =n |
|
x |
A |
|
|
|
||||
ln γ i =10. − ln ∑x j Aij − ∑ |
|
k |
ki |
|
|
j=n |
|
||||
j=1 |
k =1 |
∑x j Akj |
|
||
|
|
|
|
|
|
|
|
j=1 |
|
|
|
где: γi = коэффициент активности компонента i
|
V |
j |
|
(a |
ij |
+ b T |
|
Aij = |
|
exp − |
|
ij |
|
||
Vi |
|
|
RT |
||||
|
|
|
|
|
|||
xi = мольная доля компонента i T = температура (K)
n = общее число компонентов
aij =не зависящие от температуры энергетические параметры компонентов i и j (cal/gmol)
bij = зависящие от температуры энергетические параметры компонентов i и j (cal/gmol-K)
Vi =мольный объем жидкого чистого компонента i в m3/kgmol (litres/gmol)
Уравнение использует либо параметры, которые имеются в ХАЙСИС (по умолчанию), либо параметры, введенные пользователем для адекватного описания конкретной системы.
Закон Генри
Закон Генри нельзя выбрать явным образом в качестве термодинамического пакета. Однако, при использовании моделей активности при наличии в списке компонент «неконденсирующихся» веществ, закон Генри будет применяться автоматически.
Следующие компоненты в этом случае рассматриваются как «неконденсирующиеся»:
Компонент |
Имя в ХАЙСИС |
CH4 |
Methane |
C2H6 |
Ethane |
C2H4 |
Ethylene |
C2H2 |
Acetylene |
H2 |
Hyrogen |
He |
Helium |
Ar |
Argon |
|
|
N2 |
Nitrogen |
O2 |
Oxygen |
NO |
NO |
H2S |
H2S |

Методы расчета свойств А - 25
CO2 |
CO2 |
CO |
CO |
Расширенное уравнение закона Генри используется в ХАЙСИС для моделирования системы раствор/растворитель в случае разбавленных растворов. «Неконденсирующимися» считаются компоненты критическая температура, которых ниже температуры моделируемой системы. Уравнение имеет следующий вид:
ln Hij = A + |
B |
+C ln(T) + DT |
(А.22) |
|
T |
||||
|
|
|
где: i = растворяющийся или «неконденсирующийся» компонент j = растворитель или конденсирующий компонент
Hij = коэффициент Генри для компонент i и j, кПа A = задается в матрице параметров как aij
B = задается в матрице параметров как aji C = задается в матрице параметров как bij D = задается в матрице параметров как bji T = температура в градусах К
Ниже приведен пример использования закона Генри. В качестве термодинамического пакета выбран NRTL. В пакете свойств имеются три компонента, один из которых, этан, является «неконденсирующимся». На закладке Бинарные коэффициенты в окне Пакет свойств Вы можете увидеть коэффициенты закона Генри для взаимодействия этана с другими компонентами. Если нажата селективная кнопка Aij, Вы видите и можете редактировать коэффициенты A и В. Если нажата селективная кнопка Вij, Вы видите и можете редактировать коэффициенты C и D.
C2 является «неконденсирующимся» |
Коэффициент В для |
Коэффициент D для |
||
компонентом. Закон Генри используется |
взаимодействия С2 и H2O |
взаимодействия С2 и H2O |
||
для определения параметров |
|
|
|
|
взаимодействия между С2 и |
|
|
|
|
остальными компонентами пакета |
|
|
|
|
свойств. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В ХАЙСИС нет подобранного заранее коэффициента A для взаимодействия этан/этанол.
ХАЙСИС может оценить его или можно задать собственное значение.
Коэффициент A для |
Параметры |
взаимодействия С2 и |
взаимодействия |
H2O |
для пары |
|
H2O/этанол |
Коэффициент C для взаимодействия С2 и H2O
Если в ХАЙСИС нет подобранных заранее коэффициентов закона Генри и нет данных, ХАЙСИС может рассчитать недостающие коэффициенты. Чтобы рассчитать коэффициент (A или В), выберите селективную кнопку Aij, выберите пару компонент и нажмите кнопку Выбранная пара. Коэффициенты получаются регрессией величин фугитивностей, рассчитанных с помощью уравнений Чао-Сидера/Праузнитца-Шера для фугитивностей стандартных состояний и регулярных растворов. Чтобы задать собственные коэффициенты, введите их непосредственно в матрицы
Aij и Bij.

А - 26 Методы расчета свойств
Коэффициенты взаимодействия между «неконденсирующимися» компонентами при расчете парожидкостного равновесия не учитываются.
A.3.3 Опции моделей активности для паровой фазы
Можно использовать различные модели расчета паровой фазы вместе с выбранной моделью активности. Выбор зависит от особенностей Вашей системы. При работе с системой с умеренным давлением (до 5 атм) модель идеального газа дает удовлетворительные результаты. Имеются следующие модели:
Идеальный газ
Уравнение идеального газа используется для расчета паровой фазы. Модель работает при низких давлениях и при незначительном межмолекулярном взаимодействии компонентов паровой фазы.
Пенг-Робинсон, SRK и RK
Для моделирования неидеального поведения паровой фазы с моделями активности могут быть использованы уравнения PR, SRK или RK. Модели паровой фазы PR и SRK применимы в тех же случаях, что уравнения состояния PR и SRK (смотрите раздел А.3.1).
При выборе одного из этих вариантов (PR, SRK или RK) в качестве модели паровой фазы следует убедиться, что параметры бинарного взаимодействия, используемые для моделей активности, окажутся применимыми для выбранной модели паровой фазы. Имейте в виду, что все бинарные параметры в библиотеке ХАЙСИС получены регрессией на основе модели идеального газа.
Для задач, где приходится моделировать работу компрессоров или турбин, модели PR и SRK могут оказаться предпочтительней моделей RK и идеального газа. При использовании моделей PR и SRK рассчитанные значения мощности окажутся более точными, если с помощью выбранной модели паровой фазы разумно рассчитываются легкие компоненты.
Вириальное уравнение
Вириальное уравнение позволяет лучше описывать фугитивность паровой фазы систем, проявляющих сильное взаимодействие в паровой фазе. Это типично для систем, содержащих карбоксильные кислоты или другие компоненты, проявляющие тенденцию к образованию стабильных водородных связей в паровой фазе. В этом случае коэффициент фугитивности может сильно отличаться от идеальности, даже при низких и средних давлениях.
ХАЙСИС рекомендует использовать этот вариант расчета в задачах с органическими кислотами (муравьиная, уксусная, пропионовая, масляная и др.).
Если в потоке присутствует одна из перечисленных кислот, то всю смесь следует рассматривать с учетом димеризации молекул в паровой фазе. Степень димеризации каждого компонента зависит от его ассоциативного

Методы расчета свойств А - 27
параметра, а также от бинарных параметров этого компонента с другими веществами.
ХАЙСИС содержит коэффициенты температурной зависимости для карбоксильных кислот. Вы можете изменить принятые по умолчанию коэффициенты ассоциативности (ij) или сольватации (ii), которые приводятся в литературе13.
Если необходимо рассчитать вириальные коэффициенты, в ХАЙСИС имеются корреляции, использующие следующие свойства чистых компонентов:
•критическая температура
•критическое давление
•дипольный момент
•радиус вращения
•параметр ассоциативности
•параметр ассоциативности для каждой бинарной пары
Эта опция ограничена системами с умеренной плотностью, как правило меньше половины критической плотности. Вириальное уравнение пригодно в следующей области:
|
|
m |
|
|
T |
∑yi Pci |
|
P < |
i=1 |
(А.23) |
|
2 |
m |
||
|
∑yi Tci |
|
i=1
A.3.4 Полуэмпирические методы
Методы Чао-Сидера3 и Грейсона-Стрида6 являются старыми полуэмпирическими методами. Корреляция GS представляет расширение метода CS, в котором особое внимание уделяется водороду. В ХАЙСИС используются лишь данные по равновесию, полученные с помощью этих методов, расчет энтальпии и энтропии жидкости и пара проводится по ЛиКеслеру. Эти результаты оказываются лучше по сравнению с корреляциями CS/GS. Этот метод также одобрен и рекомендуется для применения в руководстве API.
Ниже в таблице дается диапазон применения этих методов.
Метод |
Температура |
Давление |
CS |
-18 до 260 C |
<10,000 kPa |
|
|
|
GS |
-18 до 425 C |
< 20,000 kPa |
|
|
|
Условия применимости
Для всех углеводородов (кроме |
0.5 < Tri < 1.3 и Prmixture < 0.8 |
CH4): |
|
Если присутствуют CH4 или H2 |
• средне-мольная Tr < 0.93 |
|
• мольная доля СH4 < 0.3 |
|
• мольная доля растворенных газов < 0.2 |
При расчете констант |
|
равновесия: |
мольная доля ароматики в жидкой фазе < |
Парафины и олефины |
0.5 |
Ароматика |
мольная доля ароматики в жидкой фазе > |
|
0.5 |
Корреляция GS рекомендуется для моделирования систем тяжелых углеводородов с высоким содержанием водорода (например, установки

А - 28 Методы расчета свойств
гидроочистки). Корреляция GS может также применяться для моделирования отбензинивающих установок и вакуумной перегонки тяжелых фракций. Коэффициенты фугитивности паровой фазы рассчитываются по уравнению состояния Редлиха-Квонга. Коэффициенты фугитивности чистых жидкостей рассчитываются по принципу соответственных состояний. Модифицированные ацентрические факторы имеются в библиотеке ХАЙСИС для большинства компонентов. Включены специальные функции для расчета фугитивности в жидкой фазе для N2, CO2 и H2S. Эти функции ограничены углеводородными смесями с содержанием менее 5 % каждого из вышеуказанных компонентов. Подобно моделям упругости паров, вода рассчитывается с помощью сочетания таблиц для водяного пара и диаграмм растворимости в керосине из справочника API. Такой метод обработки воды не очень точен для газовых систем. Хотя для всех систем можно рассчитать трехфазное равновесие, следует отметить, что водяная фаза всегда рассматривается этими корреляциями как чистая вода.
A.3.5 Пакеты упругости пара
Модели для расчета констант равновесия К по упругости паров могут быть использованы для идеальных смесей при низком давлении. Сюда относятся углеводородные системы, такие, как смеси кетонов и спиртов, где поведение жидкой фазы приблизительно идеально. Кроме того, эти модели можно применять в качестве первых аппроксимаций для неидеальных систем.
Модель Ли-Кеслера применяется для расчета энтальпии и энтропии для всех моделей упругости паров и компонентов, за исключением воды, моделируемой отдельно с помощью пакета свойств водяного пара.
Все три метода расчета фазового равновесия исходят из предположения, что водная фаза представляет собой чистую воду, а растворимость воды в углеводородах описывается уравнением растворимости воды в керосине в соответствии с данными руководства
API (Рисунок 9А1.4)
Расчет фугитивности стандартного состояния проведен на основе имеющихся в ХАЙСИС коэффициентов для модифицированного уравнения Антуана. Коэффициенты упругости паров для псевдокомпонентов могут быть введены или вычислены по корреляции Ли-Кеслера для углеводородов, корреляции Гомеца-Тодоса для химических соединений или по уравнению Рейделя.
Имеются следующие пакеты упругости пара: модифицированное уравнение
Антуана, модель Брауна (BK10) и таблицы Эссо.
Ниже даны приблизительные пределы применения каждой модели упругости паров.
Модель |
Температура |
Давление |
Уравнение Антуана |
< 1.6 Tc i |
< 700 kPa (100 psia) |
Модель Брауна |
0 F < 1.6 Tc i |
< 700 kPa (100 psia) |
Таблицы Эссо |
< 1.6 Tc i |
< 700 kPa (100 psia) |
Модифицированное уравнение Антуана
ХАЙСИC использует ту же форму уравнения Антуана, которая принята в банке термодинамических данных DIPPR.
ln Pvap = A+ |
B |
+ D ln T + E T F |
(А.24) |
|
T + C |
||||
|
|
|

Методы расчета свойств А - 29
где A,B,C,D,E и F - рассчитанные коэффициенты. Коэффициенты для уравнения Антуана имеются для всех компонентов библиотеки ХАЙСИС. Коэффициенты упругости паров для псевдокомпонентов могут быть заданы или вычислены из корреляции Ли-Кеслера для углеводородов, корреляции Гомеца-Тодоса для химических соединений или уравнения Рейделя.
Все расчеты энтальпии и энтропии производятся с помощью модели ЛиКеслера.
Эта модель применяется для идеальных систем при низком давлении. Для углеводородных компонентов, для которых не заданы коэффициенты упругости пара, модель непосредственно использует упругость паров по ЛиКеслеру. Таким образом, с помощью этого уравнения можно моделировать атмосферные и вакуумные колонны. При применении этого метода для сверхкритических компонентов рекомендуется заменить коэффициенты упругости паров коэффициентами Генри. Изменить коэффициенты упругости пара можно только для компонентов, заданных как гипотетические.
Модель Брауна К10
Эта модель применяется только для систем тяжелых углеводородов при низком давлении. В модели применяется метод сходимости давления Брауна, где при заданной нормальной температуре кипения компонента константа равновесия К рассчитывается при температуре системы и давлении 0.7 кг/см2 (10 psia). Значение константы равновесия (К10) затем корректируется на требуемое давление с помощью диаграмм поправки на давление. Значения К для компонентов, не включенных в эти диаграммы, рассчитываются при давлении 10 фунтов/кв.дюйм (psia) с помощью модифицированного уравнения Антуана и корректируются на условия системы с помощью диаграмм корректировки давления.
При использовании этой модели в случае наличия больших количеств кислых газов или легких углеводородов точность снижается. Все расчеты для трех фаз выполняются на основе допущения, что водная фаза - это чистая вода, и что растворимость воды в углеводородной фазе может быть описана с помощью уравнения растворимости в керосине из справочника
API (Рисунок 9A 1.4).
Для расчета энтальпии и энтропии всех компонентов, за исключением воды, которая рассчитывается по таблицам водяного пара, применяется модель Ли-Кеслера.
Табличная модель Эссо
Эта модель применяется только для углеводородных систем при низком давлении. В модели используется модификация уравнения упругости паров Максвелла-Боннела в следующем виде:
|
|
Log Pvap = ∑ Ai xi |
(А.25) |
|
где: |
Ai = подобранные константы |
|
||
|
|
i |
|
|
|
|
Tb - 0.0002867 Tbi |
|
|
|
xi = |
T |
|
|
|
748.1 - 0.2145 Tbi |
|
||
|
|
|
||
Tbi = нормальная температура кипения, скорректированная по К=12 Т = абсолютная температура
Для систем тяжелых углеводородов результаты будут сравнимы с модифицированным уравнением Антуана, поскольку поправка на давление
А - 30 Методы расчета свойств
не применяется. Для неуглеводородных компонентов константа равновесия рассчитывается с помощью уравнения Антуана. Точность снижается при наличии большого количества кислых газов или легких углеводородов. Расчеты всех трех фаз выполняются при допущении, что водная фаза - это чистая вода, и что растворимость воды в углеводородной фазе может быть описана с помощью уравнения растворимости в керосине из справочника
API (Рисунок 9A 1.4).
Для расчета энтальпии и энтропии всех компонентов, за исключением воды, которая рассчитывается по таблицам водяного пара, применяется модель Ли-Кеслера.
A.3.6 Прочие пакеты
Пакет свойств аминов
Пакет аминов содержит термодинамические модели для расчета аминовых установок. Пакет разработан компанией D.B. Robinson & Associates и носит название AMSIM. Пакет свойств аминов может быть поставлен совместно с ХАЙСИС и даст доступ к надежному пакету свойств, предназначенному для моделирования аминовых установок.
При использовании Аминового пакета паровая фаза моделируется с помощью PR.
База данных химических и физических свойств ограничена аминами и следующими компонентами:
Класс компонентов |
Компоненты |
Кислые газы |
CO2, H2S, COS, CS2 |
Углеводороды |
CH4 - C7H16 |
Олефины |
C2=, C3= |
Меркаптаны |
M-Mercaptan, E-Mercaptan |
Неуглеводороды |
H2, N2, O2, CO, H2O |
В пакет свойств включены равновесные параметры растворимости кислых газов и кинетические параметры для водных растворов алканоламинов в реакциях с H2S и CO2. Аминовый пакет разработан на основе большого объема экспериментальных данных. Это собственные данные D.B. Robinson & Associates, и данные нескольких неопубликованных источников и многочисленных технических справочных материалов.
Этот метод не позволяет использовать гипотетические компоненты.
Ниже в таблице приведены ограничения, которые следует иметь в виду при использовании этого пакета.
|
Алканоламины |
|
|
Концентрация |
|
Парциальное |
|
Температур |
|
|
|
|
|
|
|
||||
|
|
|
|
алканоламина, |
|
давление кислого |
|
ы (С) |
|
|
|
|
|
(Вес %) |
|
газа, (кг/см2) |
|
|
|
|
Monoethanolamine, MEA |
0 - 30 |
|
7.0e-7 - 21.0 |
25 - 130 |
|
|||
|
Diethanolamine, DEA |
0 - 50 |
|
7.0e-7 - 21.0 |
25 - 130 |
|
|||
|
Triethanolamine, TEA |
0 - 50 |
|
7.0e-7 - 21.0 |
25 - 130 |
|
|||
|
Methyldiethanolamine, |
0 - 50 |
|
7.0e-7 - 21.0 |
25 - 130 |
|
|||
|
MDEA* |
|
|
|
|
|
|
|
|
|
Diglycolamine, DGA |
50 - 70 |
|
7.0e-7 - 21.0 |
25 - 130 |
|
|||
|
DIsoPropanolAmine, |
0 - 40 |
|
7.0e-7 - 21.0 |
25 - 130 |
|
|||
|
DIsoA |
|
|
|
|
|
|
|
|

Методы расчета свойств А - 31
* В смесях аминов DEA/MDEA и MEA/MDEA обычно основным компонентом является MDEA, поэтому для таких смесей следует использовать MDEA
Данные на расходы H2S и CO2 более, чем 1.0 моль кислого газа/моль алканоламина не скоррелированы.
Абсорбция H2S и CO2 водными растворами алканоламина включает экзотермические реакции. Тепловые эффекты являются важным фактором в процессах аминовой очистки и надлежащим образом учтены в пакете свойств аминов. Корреляции для учета теплоты растворения являются функциями состава и типа амина. Корреляции были построены на основе имеющихся опубликованных данных или на основе данных растворимости с помощью уравнения Гиббса-Гельмгольца.
Пакет аминов включает специальную модель расчета эффективности тарелок, что позволяет рассчитывать колонны на основе реальных тарелок. Модель эффективности тарелок рассчитывает значения КПД для компонентов H2S и CO2, исходя из заданных размеров тарелки и вычисленных условий внутри колонны. Индивидуальный КПД для компонента является функцией давления, температуры, состава фаз, расходов, физических свойств, механической конструкции тарелки и ее размеров, а также кинетических параметров и параметров массопередачи.
Поскольку эффекты кинетики и массопередачи в первую очередь определяют селективность поглощения H2S аминовыми растворами, их необходимо учесть в значениях эффективности тарелок. В Главе 8 - Колонна в томе Модульные операции описано, как задать и рассчитать эффективность тарелок.
Пакет водяного пара
При выборе пакета водяного пара имеется два варианта:
•ASME Steam
•NBS Steam.
Оба эти пакета свойств относятся только к одному компоненту - H2O.
Таблицы пара ASME-1967 могут быть получены при выборе пакета водяного пара ASME-Steam. Ограничения этого пакета совпадают с ограничениями исходных таблиц ASME, то есть он применим при давлении ниже 1050 кг/см2 и в температурном интервале от 0 до 800°C. Основной справочный материал - "Thermodynamic and Transport Properties of Steam" - The American Society of Mechanical Engineers - Prepared by C.A. Meyer, R.B. McClintock, G.J. Silvestri and R.C. Spencer Jr11.
При выборе пункта меню NBS_Steam выводятся таблицы водяного пара NBS-1984, которые лучше описывают область вблизи критической точки.
MBWR
В ХАЙСИС используется 32-членное модифицированное уравнение Бенедикта-Вебба-Рубина. Это уравнение может быть записано в следующем виде:
|
|
32 |
|
|
|
|
P = RTρ+∑Ni X i |
|
(А.26) |
|
|
i=1 |
|
|
где: |
|
|
|
|
X1=ρ2T |
X8=ρ3/T |
X15=ρ6/T2 |
X22=ρ5F/T2 |
X29=ρ11F/T3 |
X2=ρ2T1/2 |
X9=ρ3/T2 |
X16=ρ7/T |
X23=ρ5F/T4 |
X30=ρ13F/T2 |
Подробнее об эффективности тарелок см. Раздел 2 – Колонна.
X3=ρ2 |
X10=ρ4T |
X17=ρ8/T |
X24=ρ7F/T2 |
X31=ρ13F/T3 |

А - 32 Методы расчета свойств
X4=ρ2/T |
X11=ρ4 |
X18=ρ8/T2 |
X25=ρ7F/T3 |
X32=ρ13F/T4 |
X5=ρ2/T2 |
X12=ρ4/T |
X19=ρ9/T2 |
X26=ρ9F/T2 |
|
X6=ρ3T |
X13=ρ5 |
X20=ρ3F/T2 |
X27=ρ9F/T4 |
|
X7=ρ3 |
X14=ρ6/T |
X21=ρ3F/T3 |
X28=ρ11F/T2 |
|
F=exp(-0.0056 r2)
Модифицированное уравнение Бенедикта-Вебера-Рубина используется только для чистых компонентов:

Методы расчета свойств А - 33
Компонент |
Температура, К |
Максимальное давление, |
|
|
МПа |
Ar |
84-400 |
100 |
CH4 |
91-600 |
200 |
C2H4 |
104-400 |
40 |
C2H6 |
90-600 |
70 |
C3H8 |
85-600 |
100 |
i-C4 |
114-600 |
35 |
n-C4 |
135-500 |
70 |
CO |
68-1000 |
30 |
CO2 |
217-1000 |
100 |
D2 |
29-423 |
320 |
H2 |
14-400 |
120 |
o-H2 |
14-400 |
120 |
p-H2 |
14-400 |
120 |
He |
0.8-01500 |
200 |
N2 |
63-1900 |
1000 |
O2 |
54-400 |
120 |
Xe |
161-1300 |
100 |
Смесь различных форм водорода также допустима. Диапазон использования этих компонентов смотри в таблице.
A.4 Расчет энтальпии и энтропии
Расчет энтальпии и энтропии проводится в ХАЙСИС на основе следующих точных термодинамических уравнений:
H - H ID |
1 |
|
V |
|
|
∂P |
|
|
|
|
||||||||
|
|
|
= Z -1+ |
|
|
|
|
∫∞ |
T |
|
- P dV |
(А.27) |
||||||
RT |
|
|
RT |
|
||||||||||||||
|
|
|
|
|
|
|
∂T V |
|
|
|
||||||||
S - |
ID |
|
|
|
|
P |
|
V |
|
1 |
|
|
∂ |
|
1 |
|
|
|
|
S° |
|
|
|
|
|
|
|
P |
|
|
|||||||
|
|
=lnZ -ln |
|
|
|
|
+ ∫∞ |
|
|
|
|
- |
|
dV |
(А.28) |
|||
R |
|
Po |
|
|
|
V |
||||||||||||
|
|
|
|
|
R |
|
∂T V |
|
|
|||||||||
где HID – базовая энтальпия идеального газа, используемая ХАЙСИС, равна энтальпии образования идеального газа при 25 С.
SID - базовая энтропия идеального газа, используемая ХАЙСИС, равна энтропии образования идеального газа при 25 С.
Когда речь идет о полуэмпирических моделях и моделях упругости паров, программа учитывает наличие жидкой водной фазы и определяет растворимость воды в углеводородах на основе модели растворимости керосина в воде.
А - 34 Методы расчета свойств
A.4.1 Уравнения состояния
Уравнение состояния Пенга-Робинса имеет вид:
H - H ID |
|
1 |
|
|
|
|
|
da |
|
V + ( 20.5 |
+ 1)b |
|
||||
|
|
= Z - 1 - |
|
|
|
|
a - T |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||||
RT |
|
|
|
|
|
|
ln |
|
|
|||||||
|
|
21.5 bRT |
|
|
dt |
|
V + ( 20.5 - 1)b |
|
||||||||
S - S°ID |
=ln(Z - B) -ln |
P |
+ |
|
A |
|
T da |
|
Z +( 20.5 |
+1)B |
|
|||||
|
|
|
|
|
|
|
|
ln |
|
|
|
|||||
R |
Po |
21.5 |
|
|
|
|
|
|||||||||
|
|
|
|
B a dT |
|
Z - ( 20.5 - 1)B |
|
|||||||||
где:
N N
a = ∑∑xi x j (ai a j )0.5 (1 − kij )
i=1 j=1
(А.29)
(А.30)
(А.31)
Для уравнения состояния SRK:
H - H ID |
1 |
|
|
|
|
|
|
da |
|
b |
|
|
|||||||
|
|
= Z - 1 - |
|
|
|
a - T |
|
|
|
ln 1+ |
|
|
|
|
|
||||
RT |
|
bRT |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
dT |
|
|
V |
|
|
||||||||
S - S°ID |
=ln(Z - B) -ln |
P |
+ |
A |
T da |
1+ |
|
B |
|||||||||||
|
|
|
|
|
|
|
ln |
|
|
|
|||||||||
R |
P |
o |
B |
|
|
|
|||||||||||||
|
|
|
|
|
a dT |
|
|
|
|
Z |
|||||||||
Величины A и B определяются следующим образом:
(А.32)
(А.33)
|
Пенг-Робинсон |
Соав-Редлих-Квонг |
bi |
0.077796 |
RTci |
0.08664 |
RTci |
|
Pci |
Pci |
|
|||
ai |
aci αi |
|
aci αi |
|
|
|
|
(RT )2 |
|
(RT ) 2 |
|
aci |
0.457235 |
ci |
0.42748 |
ci |
|
Pci |
Pci |
||||
|
|
α |
i |
|
1+m (1−T 0.5 ) |
|
1+m (1−T 0.5 ) |
|||
|
|
i |
ri |
|
|
i |
ri |
|
mi |
|
|
0.37646 +154226.ωi −0.26992ωi2 |
0.48 +1574.ωi −0176.ωi2 |
||||
где: |
N |
N |
|
|
N |
|
|
|
|
|
|
|
|
|
|||
|
|
a = ∑∑xi x j ( ai a j |
)0.5 (1 - kij ) |
b = ∑xi bi |
|
|
||
|
|
i=1 j=1 |
|
|
i=1 |
|
|
|
Обозначения: R |
|
= идеальная газовая постоянная |
||||||
|
|
|
H |
|
= энтальпия |
|
|
|
|
|
|
S |
|
= энтропия |
|
|
|
Индексы: |
ID |
|
= идеальный газ |
|
|
|||
|
|
|
o |
|
= эталонное состояние |
|
||
|
|
|
|
|
|
|||

Методы расчета свойств А - 35
PRSV
Уравнение состояния PRSV представляет собой модификацию уравнения состояния Пенга-Робинсона. Вводится новый член κ, как показано ниже:
(A.34)
αi = [1+κi (1- T 0r.5 ) ]2
κi = κ0i +κ1i (1+T 0ri.5 )(0.7 - T ri )
κ0i = 0.378893+1.4897153ωi - 0.17131848ωi2 +0.0196554ωi3
Подстановка данного выражения для αi в уравнения, определяющие члены A и B, даст Вам уравнение состояния PRSV.
A.4.2 Модели активности
Энтальпия и энтропия жидкой фазы в моделях активности рассчитывается по корреляциям Каветта:
если Tri < 1:
|
H L - H ID |
|
|
∆ H°i L(sb) |
|
∆ H°i L (sp) |
||||
|
|
|
= max |
|
|
, |
|
|
||
|
|
Tci |
T ci |
|||||||
|
Tci |
|
|
|
|
|||||
если Tri ≥1 : |
|
|
|
|
|
|
|
|||
|
H L - H ID |
|
∆ H°L (sp) |
|
|
|
||||
|
|
= |
|
|
|
|
|
|
||
|
T ci |
|
|
|
||||||
|
T ci |
|
|
|
|
|||||
где: |
|
|
|
|
|
|
|
|||
|
∆ H°i L (sb) |
|
|
|
1-a3( T ri-0.1) |
|
||||
|
|
|
|
= a1 + a2 (1 - T ri ) |
|
|
|
|||
|
T ci |
|
|
|
||||||
|
|
|
|
|
|
|
|
|||
∆ H°i L (sp) = max(0,b1 + b2 T2ri + b3 T 3ri + b4 T 4ri + b5 Pri T2ri )
T ci
(А.35)
(А.36)
(А.37)
(А.38)
где a1, a2, и a3 представляют собой функции параметров Каветта, вычисленные на основе одного экспериментального значения теплоты парообразования.
Энтальпия и энтропия паровой фазы зависит от того, какая модель выбирается для паровой фазы:
Идеальный газ:
|
|
|
|
|
H = H ID |
|
|
|
|
|
|
|
|
|
|
|
|
(А.39) |
||
|
|
|
ID |
|
T 2 |
CvdT |
|
|
|
|
V 2 |
|
|
|
|
|
||||
|
S = S° |
|
= ∫ |
|
|
+ RlnV 1 |
|
|
|
|
(А.40) |
|||||||||
|
T |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Редлих-Квонг: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
H - |
H |
ID |
|
1.5a |
|
|
|
|
b |
|
|
|
||||||
|
|
|
|
|
= Z - 1 - |
bRT |
ln 1+ |
|
|
|
|
(А.41) |
||||||||
|
|
RT |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|||||||
|
S - S°ID |
|
|
|
|
|
|
P |
|
|
A |
|
|
B |
|
|||||
|
|
|
|
=ln(Z - B) -ln |
|
|
- |
|
|
ln 1+ |
|
|
(А.42) |
|||||||
|
|
RT |
P° |
2B |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Z |
|
||||||||
Вириальное уравнение:

А - 36 Методы расчета свойств
H - H ID |
= - |
T |
|
|
dB |
+(Z - 1) |
|
|
(А.43) |
||||
RT |
|
V - B |
dT |
|
|
||||||||
S - SiD |
|
|
RT |
|
dB |
|
V |
+ Rln |
V |
|
|||
|
= - |
|
|
|
- Rln |
|
|
(А.44) |
|||||
R |
V - B |
dT |
V - B |
V o |
|||||||||
где В = второй вириальный коэффициент смеси.
A.4.3 Вариант Ли-Кеслера
Метод Ли-Кеслера представляет собой попытку расширить предложенный Питцером метод для интервала температур ниже, чем 0.8 Tr. Ли и Кеслер модифицировали метод Питцера, введя фактор сжимаемости:
Z = Z°+ |
ω |
( Zr - Z° ) |
(А.45) |
|
ωr |
||||
|
|
|
где: Zo - фактор сжимаемости простой жидкости Zr - фактор сжимаемости эталонной жидкости
Они выбрали сокращенную форму уравнения состояния BWR для представления как Zo, так и Zr:
Z = 1+ |
B |
+ |
C |
+ |
D |
+ |
|
C |
|
β |
|||||||
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
V r V r2 |
|
|
V r5 |
|
Tr3 V r2 |
|
|||||||||||
где: |
|
V |
Pc |
|
|
|
|
|
|
||||||||
|
|
V r = |
|
|
|
|
|
|
|||||||||
|
|
RTc |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
B = b1 - |
b2 |
- |
|
b3 |
- |
b4 |
|
|
|
||||||||
|
Tr2 |
Tr4 |
|
|
|||||||||||||
|
|
|
|
Tr |
|
|
|
|
|||||||||
|
C = c1 - |
c2 |
+ C3 |
|
|
||||||||||||
|
|
|
|
||||||||||||||
|
|
|
|
|
|
Tr |
|
|
|
Tr3 |
|
|
|||||
D = d1 + d2
Tr
|
γ |
|
γ |
|
|
|
- |
|
e-( |
|
) |
(А.46) |
|
|
V r2 |
|||||
V r2 |
||||||
|
|
|
|
|
Константы в этих уравнениях были определены на основе экспериментальных данных по сжимаемости и энтальпии. Были определены два набора констант, один - для простой жидкости (ωo=0) и второй - для эталонной жидкости (ωr=0.3978, n-октан).
Изменение энтальпии и энтропии рассчитывается следующим образом:
|
|
|
|
|
|
|
b2 + 2 |
b3 |
+ 3 |
b4 |
|
|
|
c2 - 3 |
c3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
ID |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
H - H |
|
|
|
2 |
2 |
|
|
|
|
|
|
d2 |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
T r |
|
|
T r |
|
- |
|
|
|
|
|
Tr |
|
+ |
|
|
|
+ 3E |
|
|
||||||||||
|
|
|
= Tr Z - 1 - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(А.47) |
|||||||||
RT c |
|
|
|
|
|
|
Tr V r |
|
|
|
|
2T r V r2 |
|
5Tr V r5 |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S - S°ID |
|
|
|
|
|
|
|
|
b1 + |
b3 |
+ 2 |
b4 |
|
|
|
c1 |
- 2 |
c3 |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
P |
|
T r2 |
T r3 |
T r3 |
- |
|
d1 |
|
+ 2E |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
=lnZ -ln |
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
(А.48) |
||||
|
R |
|
|
|
|
|
|
|
|
|
V r |
|
|
|
|
|
|
2V r2 |
|
|
5V r2 |
|
|
|||||||||||||||||
|
|
|
|
P° |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
c4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ |
|
-( |
γ |
|
|
|
) |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
E = |
2T r3 |
|
|
β |
+1 - |
β |
+1+ |
V r2 |
e |
|
V r2 |
|
|
|
|
|
|
|
(А.49) |
|||||||||||||||||
|
|
|
|
|
γ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Для смесей критические свойства рассчитываются следующим образом:

Методы расчета свойств А - 37
|
|
|
|
|
N |
||
|
|
|
|
ω = ∑x1ω1 |
|||
|
|
|
|
|
i=1 |
||
|
|
Zci = 0.2905 - 0.0851ωi |
|||||
|
|
|
|
V ci = |
Zci RT ci |
|
|
|
|
|
|
Pci |
|||
|
|
|
|
|
|||
|
|
|
1 |
N N |
|
|
|
|
V c = |
∑∑xi x j (V 1/ci 3 +V 1/cj 3 )3 |
|||||
|
|
||||||
|
|
|
8 i=1 j=1 |
|
|
||
|
1 |
N |
|
N |
|
|
|
T c = |
∑∑xi x j (V 1/ci 3 +V 1/cj 3 )3( T ci T cj )0.5 |
||||||
|
|||||||
|
8V c i=1 j=1 |
|
|
||||
Pc = (0.2905 - 0.085ω ) RT c
V c
Коэффициенты фугитивности
Соав-Редлих-Квонг
|
|
|
Pb |
bi |
|
a |
|
1 |
|
|
N |
|
|
|
|
|
b |
||
ln φ |
|
|
|
|
2ai0.5 |
∑ |
x j a0.5j |
|
bi |
||||||||||
i |
= -ln Z - |
|
+ (Z - 1) |
|
- |
|
|
|
|
(1 - kij ) - |
|
|
ln 1+ |
|
(А.50) |
||||
|
|
|
|
|
|
||||||||||||||
|
|
RT |
|
b |
|
bRT |
|
|
|
|
b |
|
V |
|
|||||
|
|
|
|
|
a |
|
|
j=1 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пенг-Робинсон
ln φi = -ln Z - RTPb + (Z
|
bi |
|
|
a |
|
1 |
|
|
N |
|
|
|
|
V + ( 20.5 |
+ 1)b |
|||
- 1) |
- |
|
|
|
2 ai0.5 |
∑x j a0.5j |
|
|
bi |
|||||||||
|
|
|
|
|
|
|
(1 - kij ) |
- |
|
ln |
|
|
|
|||||
b |
|
1.5 |
bRT |
|
b |
V - ( 2 |
0.5 |
- 1)b |
||||||||||
|
2 |
|
a |
|
|
j=1 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(А.51)
A.5 Физические и транспортные свойства
К физическим и транспортным свойствам, которые рассчитывает ХАЙСИС для определенной фазы, относятся вязкость, плотность, теплопроводность и поверхностное натяжение. Модели, используемые для расчета транспортных свойств, были заранее выбраны так, чтобы обеспечить наилучшее соответствие рассматриваемой химической системе. Например, модель состояний, предложенная Эли и Ханли, применяется для расчета вязкости легких углеводородов (НТК < 70 С), метод Тью - для тяжелых углеводородов, и модификация метода Летсоу-Стила - для расчета вязкости жидкости в неидеальных химических системах. Полное описание моделей, применяемых для расчета транспортных свойств, можно найти в справочной литературе, указанной в каждом подразделе. Все эти модели были модифицированы фирмой ХАЙПРОТЕХ для повышения точности расчетов.
В случае многофазных потоков транспортные свойства объединенной фазы теряют смысл, поэтому против соответствующих свойств выводится сообщение <empty> (пусто), хотя свойства каждой отдельной фазы известны. Исключение составляют операции типа труба и теплообменник. Для трехфазных потоков ХАЙСИС определяет кажущиеся свойства объединенной жидкой фазы на основе эмпирических правил смешения.

А - 38 Методы расчета свойств
A.5.1 Плотность жидкости
Удельный объем жидкости, находящейся на линии насыщения, определяется с помощью уравнения соответственных состояний Ханкинсона и Томпсона, дающего явную зависимость жидкого объема чистого компонента от его приведенной температуры, и второго параметра, названного характеристическим объемом. Этот метод был принят Американским нефтяным институтом в качестве стандарта. Для компонентов, имеющихся в библиотеке ХАЙСИС, параметры чистых компонентов, требующиеся для расчетов плотности жидкости в соответствующем состоянии (COSTALD), берутся из исходных таблиц, опубликованных Ханкинсоном и Томпсоном, и из справочника API. Параметры гипотетических компонентов рассчитываются на основе плотности API и обобщенного уравнения Лу. Хотя метод COSTALD был разработан для жидкостей, находящихся на линии насыщения, его можно применить и для расчета плотностей переохлажденных жидкостей, то есть при давлении выше давления паров, используя поправочный коэффициент Чу и Праузница для находящихся под давлением сред. Модель COSTALD была модифицирована с целью увеличения ее точности при расчете плотностей систем, где псевдоприведенная температура ниже 1.0. При более высоких температурах для расчета плотности жидкости применяется коэффициент сжимаемости по уравнению состояния.
Плотность псевдокомпонентов, сгенерированных на шаге характеризации нефти, рассчитывается по внутренним корреляциям или на основе введенных кривых плотностей. При известной общей плотности образца, плотность псевдокомпонентов подгоняются таким образом, чтобы
ρобщая = |
1.0 |
|
(А.52) |
|
∑ |
xi |
|
||
|
ρ |
|
|
|
|
|
i° |
|
|
Характеристический объем каждого псевдокомпонента рассчитывается с помощью подобранных плотностей и физических свойств. Затем рассчитанные характеристические объемы модифицируются таким образом, чтобы общая плотность, рассчитанная по уравнению COSTALD, соответствовала бы плотности, рассчитанной на основе плотностей отдельных компонентов. В результате этого, данный объем будет содержать одну и ту же массу, независимо от того, производился ли расчет по сумме плотностей компонентов или по уравнению COSTALD.
A.5.2 Плотность пара
Плотность всех паровых систем при заданной температуре и давлении рассчитывается с помощью коэффициента сжимаемости, определяемого по уравнению состояния или по соответствующей модели паровой фазы для моделей активности.
A.5.3 Вязкость
ХАЙСИС автоматически выбирает модель, наиболее подходящую для расчета вязкости фаз рассматриваемой системы. Выбирается одна из трех моделей, имеющихся в ХАЙСИМ: модификация метода NBS (Эли и Ханли), модель Тью или модификация корреляции Летсоу-Стила. ХАЙСИС выбирает модель на основе следующих критериев:

Методы расчета свойств А - 39
Химические системы |
Паровая фаза |
Жидкая фаза |
|
Лег. углеводороды (НК<70 |
Модиф. Эли & Ханли |
Модиф. Эли & Ханли |
|
С) |
|
|
|
Тяж. углеводороды (НК>70 |
Модиф. Эли & Ханли |
Тью |
|
С) |
|
|
|
Неидеальные хим. |
Модиф. Эли & Ханли |
Модиф. Летсоу-Стил |
|
системы |
|
|
Все модели основаны на принципе соответственных состояний и были модифицированы для получения более надежных результатов. Эти модели выбраны потому, что они показали самые надежные результаты для указанных химических систем. Оказалось, что при расчете вязкости легких углеводородных жидких и паровых фаз наиболее надежные результаты дает модифицированный нами метод Эли-Ханли; вязкость тяжелых углеводородных жидкостей более эффективно описывается моделью Тью, а вязкость химических систем более точно рассчитывается с помощью модифицированного нами метода Летсоу-Стила.
Полное описание исходной модели соответственных состояний (NBS), используемой для расчета вязкости, представлено Эли и Ханли в их публикации. Исходная модель была модифицирована для устранения итеративной процедуры расчета коэффициентов формы системы. Обобщенные модели коэффициента формы Лича и Леланда были заменены специфическими моделями компонентов. ХАЙСИС строит диаграмму PVT (давление-объем-температура) для каждого компонента и подбирает путем регрессии константы коэффициента формы таким образом, что диаграмма PVT может быть воспроизведена с помощью эталонной среды. Следует отметить, что диаграмма давление-объем- температура строится с помощью модели COSTALD для жидкой области. Константы коэффициента формы рассчитываются таким образом, чтобы при использовании эталонной среды диаграмма PVT воспроизводилась правильно.
Константы коэффициента формы для всех библиотечных компонент уже подобраны с помощью регрессии и хранятся в библиотеке чистых компонент. Для псевдокомпонент эти константы подбираются с помощью регрессии на основе рассчитанных значений вязкости, которые в свою очередь определяются исходя из базовых и критических свойств псевдокомпонент.
Для псевдокомпонент, созданных нефтяным пакетом, константы автоматически рассчитываются программой таким образом, чтобы разумно описывать кинематическую и динамическую вязкость смеси.
Общая модель использует метан в качестве эталонной среды и применима для широкого диапазона неполярных жидких смесей в промышленности переработки углеводородного сырья. Точность при расчете нефтей с высоким содержанием ароматики или нафтенов будет выше, если имеются кривые вязкости, поскольку в систему заложены методы свойств чистых компонентов для средних нефтей. Эта модель, кроме того, обрабатывает воду, кислые газы и некоторые другие газы.
Хотя модифицированная модель NBS хорошо описывает эти системы, оказалось, что метод Тью дает лучшие результаты по вязкости тяжелых углеводородных жидкостей. Модель Тью9, кроме того, основана на принципах соответственных состояний, но она вводит корреляцию вязкости для н-алканов в качестве эталонной среды вместо метана. Полное описание этой модели представлено в работе Тью "Внутренне согласованная корреляция для расчета вязкости жидких нефтяных фракций"15.
Для химических систем модель NBS, модифицированная Эли и Ханли, применяется для расчета вязкости паровой фазы, в то время как модифицированная Летсоу и Стилом форма модели применяется для расчета вязкости жидкостей. Этот метод также основан на принципах соответственных состояний и дает удовлетворительные результаты.

А - 40 Методы расчета свойств
Константы коэффициента формы, имеющиеся в библиотеке чистых компонент, рассчитаны на основе имеющихся данных по вязкости в широком диапазоне рабочих условий. В среднем это дает хорошие результаты в широком диапазоне, однако можно обеспечить большую точность в более узком диапазоне рабочих условий, используя табличный пакет (он описан в главе 2 - Пакет свойств).
A.5.4 Правила смешения жидких фаз при расчете вязкости
Расчет кажущейся вязкости смесей типа несмешивающихся между собой углеводородов и воды производится с помощью представленных ниже правил смешения:
•Если объемная доля углеводородной фазы равна или превышает 0.5, применяется следующее уравнение17:
|
µeff = µoil e3.6(1-voil ) |
(А.53) |
где: |
µeff = кажущаяся вязкость |
|
|
µoil = вязкость углеводородной фазы |
|
|
υoil = объемная доля углеводородной фазы |
|
•Если объемная доля углеводородной фазы меньше 0.33,то применяется следующее уравнение18:
|
|
µ |
oil |
+ 0.4 |
µ |
H |
2O |
|
|
|
|
µeff = 1+ 2.5 voil |
|
|
|
|
|
|
|
µH 2O |
(А.54) |
||
|
µ + µ |
|
2O |
||||||||
|
|
|
|
|
|
|
|
||||
|
|
oil |
H |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
где: µeff = кажущаяся вязкость
µoil = вязкость углеводородной фазы µh2o = вязкость водной фазы
υoil = объемная доля углеводородной фазы
•Если объемная доля углеводородной фазы между 0.33 и 0.5, кажущаяся вязкость объединенной жидкой фазы рассчитывается как величина, средневзешенная между значениями, полученными по уравнениям (А.53)
и (А.54).
Остальные свойства псевдофазы рассчитываются следующим образом:
mweff = ∑xi mwi |
(молекулярный вес) |
|
ρeff = 1/∑ (xi /ρi ) |
(плотность смеси) |
(А.55) |
Cpeff = ∑xi Cpi |
(удельная теплоемкость смеси) |
|
A.5.5 Теплопроводность
Как и при расчете вязкости, для расчета теплопроводности жидкой и паровой фаз применяется ряд различных моделей и специальных корреляций. Соображения Рейда, Праузница и Полинга18 были использованы в качестве общего руководства при определении того, какая модель лучше всего подходит для каждого класса компонентов.
Для углеводородных систем обычно применяется метод соответственных состояний, предложенный Эли и Ханлеем4. Для этого метода требуются молекулярный вес, ацентричный фактор и идеальная теплоемкость для каждого компонента. Эти параметры имеются в табличном виде для всех библиотечных компонентов и могут быть введены или рассчитаны для

Методы расчета свойств А - 41
гипотетических компонентов. Рекомендуется задавать все эти параметры для неуглеводородных гипотетических компонентов с тем, чтобы обеспечить надежность коэффициентов теплопроводности и изменения энтальпии.
Используются те же модификации метода, что и при расчете вязкости. Коэффициенты формы, рассчитываемые в программах расчета вязкости, применяются непосредственно в уравнениях теплопроводности. Точность метода будет зависеть от согласованности исходной диаграммы PVT.
Для расчета теплопроводности паровой фазы применяются методы МизикаТодоса и Чанга16. Влияние высокого давления на теплопроводность учитывается в методе Чанга и др.
Для расчета теплопроводности жидкой фазы используются следующие методы:
•для чистой воды - таблицы водяного пара
•вода + DEG – специальный метод, разработанный для этих двух компонентов
•вода, DEG, C1, C2, C3, 3M-3EC5, c3=, TEG, EG, He, H2, C2H4, NH3 –
используется полином
•для углеводородов с MW > 140 и Tr < 0.8 – используется модифицированный метод Миссенарда и Рейделя16.
•для спиртов, эфиров и остальных углеводородов, используется метод Латини16.
•для остальных, метод Сато-Рейделя
Теплопроводность жидкой фазы рассчитывается на основе следующего правила смешения:
|
∑xi λi |
1/ 3 |
|
3 |
λmix = |
|
|
(А.56) |
|
|
i |
|
|
|
где λmix - теплопроводность жидкой смеси
λi - теплопроводность жидкости i
xi - мольная доля компонента i
Так же, как и при расчете вязкости, теплопроводность для двух жидких фаз определяется приближенно с помощью эмпирических правил смешения путем генерации единой жидкой фазы. Теплопроводность несмешиваемых бинарных жидких фаз рассчитывается с помощью следующего уравнения15:
где |
- теплопроводность комбинированной жидкой фазы |
 - теплопроводность жидкой фазы i при температуре Т
- теплопроводность жидкой фазы i при температуре Т
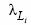 - теплопроводность жидкой фазы j при температуре Т
- теплопроводность жидкой фазы j при температуре Т
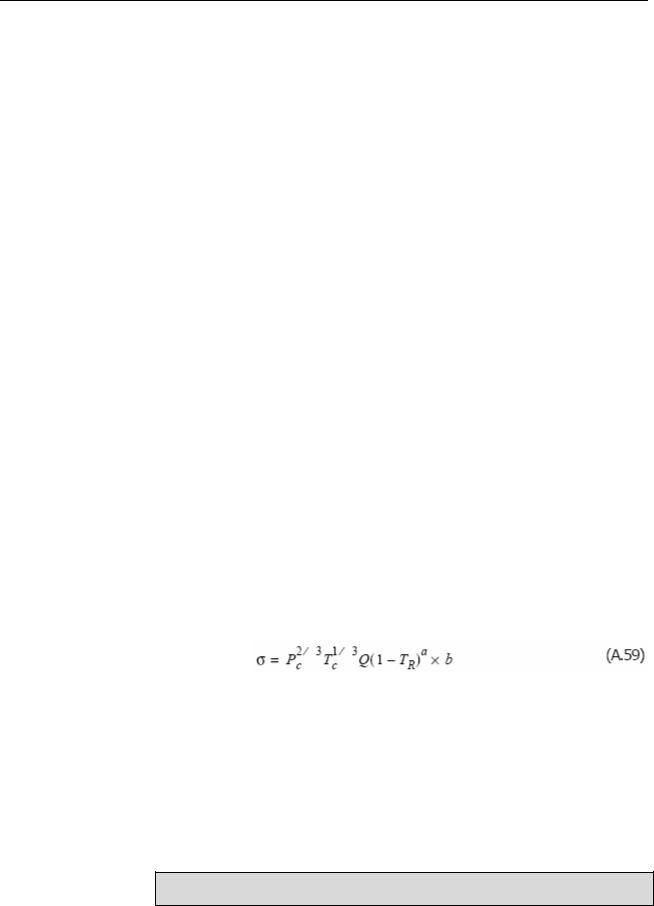
А - 42 Методы расчета свойств
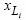 - мольная доля жидкой фазы i
- мольная доля жидкой фазы i
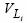 - мольный объем жидкой фазы i
- мольный объем жидкой фазы i
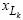 - мольная доля жидкой фазы k
- мольная доля жидкой фазы k
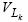 - мольный объем жидкой фазы k
- мольный объем жидкой фазы k
Для систем, состоящих из двух жидких фаз, используется уравнение:
λ Lmix |
= φ12 λ L |
+ 2φ1φ2 λ12 |
+ φ22 λ L |
(А.58) |
|
1 |
|
2 |
|
где: λLmix = кажущаяся теплопроводность объединенной жидкой фазы
λL1 = теплопроводность 1 жидкой фазы
λL2 = теплопроводность 2 жидкой фазы
φ |
1 |
= |
|
x1V 1 |
|
2 |
|||||
|
|
||||
|
|
|
∑xiVi |
||
|
|
|
|
i=1 |
|
φ |
2 |
= |
|
x2V 2 |
|
2 |
|||||
|
|
||||
|
|
|
|
∑xiVi |
|
i=1
xi = мольная доля i компонента Vi = мольный объем i компонента
A.5.6 Поверхностное натяжение
Поверхностное натяжение углеводородных систем рассчитывается с помощью модифицированной формы уравнения Брока-Берда8. Уравнение представляет поверхностное натяжение, σ, как функцию приведенных и критических свойств компонента. Основная форма уравнения использовалась для определения путем регрессии параметров для каждого семейства компонентов.
где: σ = поверхностное натяжение (дин/см2)
Q = 0.1207[1.0 + TBR ln Pc /(1.0 - TBR )] - 0.281
a = параметр, подбираемый для каждого класса химических соединений
b = параметр, подбираемый для каждого класса химических соединений, зависящий от ацентрического фактора
(b = c0 + c1 ω + c2ω2 + c3 ω3 )
Для водных систем ХАЙСИC применяет полиномиальную зависимость для расчета поверхностного натяжения.
ХАЙСИC рассчитывает поверхностное натяжение только на границе паржидкость.

Методы расчета свойств А - 43
A.5.7 Теплоемкость
Теплоемкость при постоянном давлении Сp вычисляется на основе термодинамически корректных значений Сv с помощью следующего соотношения:
Cp – Cv = -T*(dV/dT)2/(dV/dT) |
(A.60) |
Если по этому уравнению Сp определить не удается, программа переходит к полуидеальному методу расчета Cp/Cv, определяя эту величину как Cp/(Cp- R). Полученные приближенные значения справедливы только для идеального газа. Последний метод используется программой в следующих случаях:
•если уравнение (А.60) не дает удовлетворительных результатов
•поток содержит твердый компонент
•если dV/dP < 1e-12
•если Cp/Cv < 0.1 или Cp/Cv >20
A.6 Расчет объемных расходов
Программа ХАЙСИС позволяет интерпретировать и рассчитывать широкий набор данных, касающихся расходов потоков. В качестве спецификаций потоков пользователь может ввести различные варианты расходов. Рассчитываются расходы как потоков целиком, так и отдельных фаз и компонент, причем результаты могут быть получены в любых единицах (мольных массовых или объемных). Недостатком такого разнообразия является возможность ошибки в интерпретации различных вариантов расходов, особенно когда речь идет об объемных расходах.
В следующем разделе перечислены все имеющиеся варианты расходов потоков, для объемных расходов всякий раз указывается, каким образом вычислялась плотность. Для объемных расходов, которые нельзя задать системе как спецификации потока, поясняется, каким образом преобразовать имеющиеся величины в массовые расходы.
A.6.1 Имеющиеся варианты расходов
В ХАЙСИС имеется много вариантов различных расходов. Однако, только некоторые из них могут задаваться как спецификации потоков.
Имеющиеся варианты расходов
В ХАЙСИС используются следующие варианты расходов (в специализированных окнах, рабочих таблицах, PFD, в выходных таблицах):
•Мольный расход
•Массовый расход
•Стандартный идеальный объемный расход жидкости
•Объемный расход жидкости при стандартный условиях
•Действительный объемный расход
•Стандартный расход газа
•Действительный расход газа

А - 44 Методы расчета свойств
Варианты расходов, используемые как спецификации
Следующие варианты расходов могут быть использованы как спецификации потоков:
|
|
• |
Мольный расход |
|
|
|
• |
Массовый расход |
|
|
|
• |
Объемный расход жидкости |
|
За базовое состояние |
|
A.6.2 Плотность пара и жидкости |
||
при расчете объемного |
|
|||
расхода принимается |
|
|||
15°С и 1 атм (60°F и 1 |
|
Все вычисления объемных расходов потоков основываются на плотности. |
||
атм). |
|
|||
|
|
ХАЙСИС использует следующие типы плотности: |
||
|
|
|
|
|
|
|
Плотность |
Описание |
|
|
|
Плотность |
Рассчитывается на основе правил идеального смешения |
|
|
|
идеальной жидкости |
идеальных плотностей чистых компонентов при 60°F. |
|
Действительные |
|
Стандартная |
Рассчитывается с помощью существующих методов при |
|
плотности |
|
плотность жидкости |
стандартном базовом состоянии. |
|
рассчитываются при |
|
Действительная |
Рассчитывается с помощью существующих методов при |
|
температуре и |
|
плотность жидкости |
текущих условиях потока (P и T). |
|
давлении потока. |
|
|
|
|
|
Стандартная |
Определяется непосредственно из уравнения идеального |
||
|
|
плотность пара |
газа. |
|
|
|
Действительная |
Рассчитывается с помощью существующих методов при |
|
|
|
плотность пара |
текущих условиях потока (P и T). |
|
Расчет стандартной и действительной плотности жидкости
Стандартная и действительная плотность жидкости рассчитывается при соответствующих Т и Р на основе внутренних методов для выбранного термодинамического пакета. Расходы, полученные на основе этих плотностей, автоматически учитывают все эффекты смешения, возникающие из-за неидеальности систем. Таким образом, эти объемные расходы не являются условными величинами, а соответствуют реальной действительности.
Расчет стандартной массовой плотности идеальной жидкости
В отличие от точных вычислений, стандартная плотность идеальной жидкости не учитывает эффектов изменения объема при смешении. Расход, рассчитанный на основе этой плотности, также не учитывает эффектов смешения. Плотность идеальной жидкости вычисляется следующим образом:
(А.61)
где: xi = мольная доля i компонента
ρiIdeal = плотность идеальной жидкости чистого компонента
В библиотеке чистых компонентов ХАЙСИС имеются плотности идеальной жидкости для всех чистых компонентов. Эти значения были определены одним из трех способов, в зависимости от характеристик компонентов:

Методы расчета свойств А - 45
1Для всех компонентов, которые являются жидкостями при 15°С и 1 атм, в базе данных хранятся значения плотности компонентов при 15°С и 1 атм.
2Для всех компонентов, которые могут быть сжижены при 15°С и давлении выше 1 атм, в базе данных хранятся значения плотности компонентов при 15°С и давлении насыщения.
3Для всех компонентов, которые не могут быть сжижены при 15°С при любом давлении (критическая температура компонента не превышает 15°С), в базе данных хранятся табличные значения эквивалентной плотности жидкости. Эти плотности были получены экспериментальным путем заменой углеводородных компонент растворенными неконденсирующимися компонентами.
Для всех гипотетических компонент стандартная плотность жидкости будет использоваться при вычислении плотности идеальной жидкости. Если плотность не задана, используется величина, рассчитанная системой. Особое внимание уделено расчету стандартной плотности жидкости для псевдокомпонентов, которые генерируются программой в нефтяном пакете. Расчет корректируется таким образом, чтобы суммарная плотность соответствовала бы заданной плотности образца.
A.6.3 Вычисление расходов
Различные типы расходов вычисляются на основе известного мольного расхода:
Мольный расход
Общий мольный расход = Мольный расходПотока |
(A.62) |
Массовый расход
Массовый расход =Общий мольный расход×Мол.весПотока |
(А.63) |
Стандартный объемный расход идеальной жидкости
Стандартный идеальный объемный расход жидкости рассчитывается на основе идеальной плотности потока, поэтому является условной величиной:
Объем.расход жидкости = |
Мольный расход x Мол.весПотока |
(А.64) |
Идеальная плотность |
||
|
Потока |
|
Объемный расход жидкости при стандартных условиях
Этот объемный расход жидкости рассчитывается на основе плотности потока при стандартных условиях и будет отражать эффект изменения объема при смешении:
Станд.объем.расход жидкости = |
Мольный расход x Мол.весПотока |
(А.65) |
|
Станд.плотность жидкости |
|||
|
Даже если поток полностью паровой, для него также будет рассчитан стандартный объемный расход идеальной жидкости.

А - 46 Методы расчета свойств
Действительный объемный расход
Действительный объемный расход рассчитывается на основе плотности среды при условиях потока (Р и Т) и будет отражать эффект изменения объема при смешении:
Дейст.объем.расход = |
Мольный расход x Мол.весПотока |
(А.66) |
|
Дейст.плотностьПотока |
|||
|
|
Стандартный расход газа
Стандартный расход газа рассчитывается с помощью мольного объема идеального газа при стандартных условиях. Он однозначно определяется исходя из мольного расхода, поскольку:
•1 фунтомоль идеального газа при 60°F и 1 атм занимает 379.46 футов3
•1 Кмоль идеального газа при 15°С и 1 атм занимает 23.644 м3
Действительный расход газа
Действительный объемный расход газа рассчитывается на основе плотности пара при условиях потока (Р и Т) и будет отражать эффект изменения объема при смешении:
Дейст.расход газа = |
Мольный расход x Мол.вес |
(А.67) |
|
Плотность |
|||
|
|
A.6.4 Объемные расходы как спецификации
Если требуется задать объемный расход потока не на основе идеальной плотности, а при текущих или стандартных условиях, следует воспользоваться одной из следующих процедур:
Объемный расход жидкости при стандартных условиях
1Задайте состав потока.
2Используя стандартную плотность жидкости, рассчитанную системой, рассчитайте массовый расход потока.
3Задайте массовый расход как спецификацию потока.
Действительный объемный расход жидкости
1Задайте состав и текущие условия потока (Р и Т).
2Используя плотность жидкости, рассчитанную системой, рассчитайте массовый расход потока.
3Задайте массовый расход как спецификацию потока.

Методы расчета свойств А - 47
A.7 Расчет фазового равновесия
Расчеты трехфазного равновесия выполняются для всех уравнений состояния и моделей активностей, за исключением уравнения Вильсона, которое пригодно только для расчетов пар-жидкость. Точно также Аминовый пакет и пакет водяного пара пригодны только для двухфазных расчетов.
ХАЙСИС имеет внутренние правила, позволяющие определить, когда и какого типа расчет фазового равновесия должен быть проведен. Это основано на концепции степеней свободы: как только известны состав потока и два параметра из набора - доля пара, температура, давление, энтальпия или энтропия, один из которых должен быть температура или давление, поток считается определенным. Как только ХАЙСИC узнает, что поток термодинамически определен, автоматически в фоновом режиме производится расчет равновесия. Вам не требуется указывать, что расчет равновесия должен быть выполнен.
Свойства могут быть либо заданы пользователем, либо рассчитаны какимнибудь модульным оператором. Заданные пользователем величины должны рассматриваться как независимые параметры. Все остальные свойства потока рассматриваются как зависимые и рассчитываются ХАЙСИС.
Таким же образом ХАЙСИС может определить, когда поток переопределен. Например, если пользователь указал три параметра потока и состав, ХАЙСИC выдаст предупреждение о том, что информация об этом потоке избыточна. Это также относится к потокам, в которых противоречие возникло в результате расчетов системы. Например, если температура и давление потока были заданы в рабочей таблице, а ХАЙСИC получит другую температуру того же потока из баланса энтальпий какой-либо модульной операции, система выдаст предупреждение о противоречии при расчете энтальпии.
ХАЙСИС автоматически проводит расчеты фазового равновесия каждый раз, как только система определит, что необходимая для расчета информация известна. Эта информация может быть задана пользователем или рассчитана системой.
В зависимости от того, какая информация о потоке известна, ХАЙСИС рассчитывает различные типы фазового равновесия: T-P, T-VF, T-H, T-S, P- VF, P-H или P-S.
Переменные, заданные пользователем (они показываются голубым цветом), могут быть изменены самим пользователем или операциями типа
Рецикл, Подбор или Электронная таблица.
Если был проведен расчет фазового состояния потока, ХАЙСИС будет знать все значения свойств этого потока (термодинамические, физические и транспортные свойства).
A.7.1 Расчет испарения при заданных T- P
Независимыми параметрами этого расчета являются температура и давление системы, а зависимыми параметрами являются доля пара, энтальпия и энтропия.
С помощью уравнений состояния и моделей активности выполняются точные расчеты для определения сосуществования несмешиваемых жидких фаз и результирующего распределения компонентов. Расчеты проводятся методом минимизации свободной энергии Гиббса. Для моделей упругости пара или полуэмпирических моделей распределение компонентов между водой и углеводородной фазой основано на данных о растворимости в керосине (Рисунок 9A1.4, API Data Book) .
Если смесь является однофазной при заданных условиях, пакет свойств рассчитывает изотермическую сжимаемость (dv/dp), чтобы определить, является ли среда жидкостью или паром. Средам в зоне плотной фазы присваиваются свойства той фазы, которая наилучшим образом отражает их состояние в этот момент.

А - 48 Методы расчета свойств
Твердые компоненты относятся к жидкой фазе двухфазной смеси и к тяжелой водной фазе трехфазных систем. Поэтому когда выполняется расчет сепаратора при заданных Т и Р, паровая фаза будет идентична независимо от наличия твердых веществ.
Будьте осторожны при задании твердых компонент в системах, которые в остальных отношениях являются парами: небольшие количества твердой фазы могут "спровоцировать" появление жидкости.
A.7.2 Расчет испарения при заданной доле пара
Доля пара и либо температура, либо давление являются независимыми параметрами при этом типе расчета. Этот тип расчета включает весь возможный диапазон изменения параметров, включая температуру (давление) начала кипения и точку росы. Для расчета упругости паров потока известного состава просто укажите, что доля пара (Vapour_Fraction) потока равна 0.0 и задайте температуру, при которой нужно рассчитать упругость паров. Для расчета точки росы укажите, что доля пара (Vapour_Fraction) потока равна 1.0 и задайте температуру или давление, при которых нужно рассчитать точку росы. Как и для других расчетов фазового равновесия, не требуется задавать начальные приближения.
Следует отметить, что доля пара указывается в мольных единицах. То есть доля пара (VF) представляет собой количество молей пара по отношению к общему количеству молей. Величина (1.0-VF) представляет собой содержание всех остальных фаз в потоке (жидкой или твердой).
Все твердые вещества окажутся в жидкой фазе.
Точка росы
Если задается доля пара, равная 1.0, и известна температура или давление, система будет рассчитывать другой зависимый параметр (Р или Т). Если температура является вторым независимым параметром, ХАЙСИС рассчитает давление точки росы. Аналогично, если давление является независимым параметром, то будет рассчитана температура точки росы. Параметры точки росы при ретроградной конденсации можно рассчитать, задав -1.0 в качестве значения доли пара. Следует отметить, что точка росы, являющаяся ретроградной по отношению к температуре, может быть нормальной по отношению к давлению и наоборот.
Начало кипения / упругость паров
Если задана доля пара, равная нулю, система проведет расчет начала кипения. При этом, когда задана одна из переменных (температура или давление), программа рассчитает вторую. Аналогично расчету точки росы, если температура известна, ХАЙСИС рассчитает давление начала кипения и наоборот, при известном давлении система рассчитает температуру начала кипения. Например, установив температуру в 100°С, Вы получите давление начала кипения при этой температуре, которое является истинной упругостью паров при 100°С.
Упругость паров и давление начала кипения являются синонимами.

Методы расчета свойств А - 49
Расчет фазового равновесия при заданной доле пара
Расчет начала кипения и точки росы являются частными задачами расчета фазового равновесия. Температура и давление могут быть рассчитаны для любого значения доли пара от 0.0 до 1.0, если задать долю пара и один независимый параметр. Если система сообщает, что не может определить свойства системы при заданных параметрах, это означает, что паровая фаза не существует в данных условиях. Например заданное давление выше крикоденбара или температура лежит вправо от крикодентерма на фазовой диаграмме P-T.
ХАЙСИС рассчитает условия ретроградной конденсации, если заданная доля пара представляет собой отрицательное число.
A.7.3 Расчет равновесия при заданной энтальпии
При известной энтальпии и температуре или давлении потока термодинамический пакет рассчитает неизвестные зависимые параметры. Хотя энтальпию потока нельзя задать непосредственно, она всегда рассчитывается в результате сведения энергетических балансов, выполненных такими модульными операциями, как Клапан, Теплообменник и Смеситель.
Если ХАЙСИС сообщает, что не может определить свойства системы при заданных параметрах, это означает, что встретился внутренний предел по температуре или давлению. Поскольку эти пределы заданы весьма широко, скорее всего это свидетельствует о задании, прямо или косвенно, неверных исходных данных.
A.7.4 Расчет равновесия при заданной удельной энтропии
При заданной удельной энтропии и температуре или давлении потока термодинамический пакет рассчитает неизвестные зависимые параметры.
A.7.5 Расчет равновесия в пакете Электролиты
Расчет равновесия в пакте Электролиты отличается от расчета равновесия
вдругих термодинамических пакетах, поскольку необходимо учесть специфику поведения водных растворов электролитов. Пакет Электролиты
вХАЙСИС представляет собой интерфейс к программе расчета электролитов фирмы OLI Systems.
В пакете Электролиты проводится одновременный расчет как фазового равновесия, так и равновесия протекающих в потоке реакций. Подробнее о моделях и реакциях, используемых при расчете равновесия, смотри HYSYS Electrolytes OLI.

А- 50 Методы расчета свойств
Впакете Электролиты проводится следующие варианты расчета фазового равновесия:
•TP (температура - давление)
•PH (давление - энтальпия)
•TH (температура - энтальпия)
•PV (давление - объем)
•TV (температура - объем)
Поскольку расчет фазового равновесия проводится одновременно с расчетом реакций, мольный расход и состав потока может отличаться от заданного. Имейте ввиду, для электролитных потоков сохраняется масса и энергия, в то время как в других пакетах, у потока сохраняется количество молей, масса и энергия.
Существуют ограничения на результаты расчета равновесия. Чтобы результаты считались разумными, необходимо, чтобы были выполнены следующие условия:
•Содержание воды в водной фазе должно быть больше 0.65
•Температура должна быть от 0 до 300˚С
•Давление должно быть от 0 до 1500 атм
•Ионная сила должна быть от 0 до 30 моль/кг-H2O
A.7.6 Вода
Вода может обрабатываться по-разному, в зависимости от применяемого уравнения. Уравнения PR и PRSV были модифицированы для точного расчета присутствия воды, а полуэмпирические модели и модели упругости паров рассматривают воду как отдельную фазу, применяя корреляции для водяного пара.
В этих уравнениях принимается, что вода образует идеальную частично смешивающуюся смесь с углеводородами, и значение константы равновесия К этой смеси рассчитывается следующим образом:
|
Kw = po / (xs P) |
(А.68) |
где: |
po = давление паров воды из Таблиц водяного пара |
|
|
P = давление в системе |
|
xs = растворимость воды в углеводородной фазе при условиях насыщения.
Значения xs рассчитываются с помощью данных по растворимости керосина, представленных на рис.9A 1.4 Справочника API19. Такой подход обычно является оправданным при работе с системами тяжелых углеводородов. Однако он не рекомендуется для газовых систем.
Для трехфазных систем только уравнения состояния PR, PRSV и модели активности допускают компоненты, отличные от воды, во второй жидкой фазе. Особые соображения были применены для учета растворимости гликолей и метанола. Для систем кислых газов используется параметр взаимодействия, зависящий температуры, соответствующий растворимости кислого компонента в водной фазе.
Растворимость углеводородов в воде учитывается уравнением состояния PR, но может быть несколько заниженной. Это объясняется тем, что для кубического уравнения состояния, для того, чтобы описать растворимость углеводородов в воде, следует задавать сильно отличающиеся параметры взаимодействия. Для уравнения состояния PR последний случай рассматривался как более критический. Второй бинарный параметр

Методы расчета свойств А - 51
взаимодействия в уравнении PRSV позволяет лучше рассчитать растворимость.
В моделях активности ограниченна взаимная растворимость воды и углеводородов в каждой фазе может быть учтена с помощью опции нерастворимости (смотри в данной главе раздел А.3.2, посвященный моделям активности). ХАЙСИС при необходимости генерирует параметры взаимодействия для каждой модели активности (за исключением модели Вильсона), которые были получены на основе растворимости воды в жидкой углеводородной фазе и углеводородов в водной фазе, исходя из данных по растворимости, упомянутых выше.
Заметим, что уравнения Пенга-Робинсона и SRK всегда помещают воду в тяжелую жидкую фазу в трехфазном потоке. Таким образом, водная фаза всегда попадет вниз трехфазного сепаратора, даже если легкая жидкая фаза (углеводородная) отсутствует. Твердые вещества всегда появляются во второй жидкой фазе.
A.7.7 Расчеты для сверхкритических состояний
Если среда находится в сверхкритическом состоянии, ХАЙСИС показывает долю пара как 0 или 1. Теоретически, это значение не имеет физического смысла, поскольку в сверхкритическом состоянии не различимы паровая и жидкая фазы. Однако важно определить, является ли среда похожей на жидкость или на пар, так как некоторые свойства в ХАЙСИС определяются на основе знания фазовой модели. Другими словами, идентификацию фазы стоит провести, чтобы решить какую модель следует использовать для расчета свойств.
В ХАЙСИС все результаты расчета фазового равновесия подвергаются анализу с помощью функции идентификации типа фазы. В разных термодинамических пакетах используются разные методы идентификации.
Например, для PR, SRK, SourPR, SourSRK в сверхкритическом состоянии используются следующие критерии:
1Если фактор сжимаемости (Z) > 0.3 и изотермический фактор сжимаемости > 0.75, доля пара принимается равной 1.
2Если Z > 0.75 и сумма концентраций легких компонентов (NBP < 230K) больше суммы концентраций тяжелых компонентов, доля пара принимается равной 1.
Апротивном случае, доля пара принимается равной 0 и среда рассматривается как жидкость.
A.7.8 Твердая фаза
ХАЙСИС не производит проверку на образование твердой фазы чистых компонентов при расчете фазового равновесия, однако условия начала выпадения твердых CO2 и гидратов могут быть рассчитаны с помощью утилит (смотри главу 14 - Утилиты в книге Модульные операции).
Твердые материалы, такие, как катализатор или кокс, задаются как компоненты твердого типа, определяемые пользователем. Пакет свойств ХАЙСИС учитывает эти компоненты при расчете следующих величин: суммарного расхода и состава потока (мольного, массового и объемного), доли пара, энтропии, энтальпии, удельной теплоемкости, плотности, молекулярного веса, коэффициента сжимаемости и различных критических свойств. Транспортные свойства рассчитываются без учета твердой фазы.
Подробнее см. Раздел
14 - Утилиты в книге
Модульные операции.

А - 52 Методы расчета свойств
Подробнее см. Раздел
3 – Гипотетические компоненты.
Обозначения фаз
F – питание
V – пар
L – жидкость
S - твердый
Заметьте, что твердые вещества всегда присутствуют во второй жидкой фазе (в водной).
Твердая фаза не участвует в расчетах парожидкостного равновесия (VLE). Ее упругость паров принимается равной нулю. Однако, поскольку наличие твердой фазы увеличивает энтальпию, она влияет на расчет теплового баланса. Таким образом, хотя результаты изотермического испарения будут одинаковыми, независимо от присутствия или отсутствия таких компонентов, результаты расчета фазового равновесия при заданной энтальпии будут меняться в зависимости от присутствия твердой фазы.
A.7.9 Информация о потоках
Когда фазовое равновесие для потока рассчитано, выводимая информация зависит от того, какие фазы имеются в потоке. Следующая таблица показывает, какие свойства рассчитываются для каждой фазы.
Свойство потока |
Рассчитывается для фазы |
|
||
Мольная доля пара |
F |
V |
L |
S |
Массовая доля пара |
F |
V |
L |
S |
Объемная доля пара |
F |
V |
L |
S |
Температура |
F |
V |
L |
S |
Мольный расход |
F |
V |
L |
S |
Массовый расход |
F |
V |
L |
S |
Объемный расход жидкости |
F |
V |
L |
S |
Объемный расход |
F |
V |
L |
S |
Стандартный расход газа |
F |
V |
L |
S |
Стандартный объемный расход |
F |
|
L |
S |
Теплосодержание |
F |
V |
L |
S |
Мольная энтальпия |
F |
V |
L |
S |
Массовая энтальпия |
F |
V |
L |
S |
Мольная энтропия |
F |
V |
L |
S |
Массовая энтропия |
F |
V |
L |
S |
Мольный объем |
F |
V |
L |
S |
Мольная плотность |
F |
V |
L |
S |
Массовая плотность |
F |
V |
L |
S |
Стандартная массовая плотность |
FD |
|
L |
S |
жидкости |
|
|
|
|
Мольная теплоемкость |
F |
V |
L |
S |
Массовая теплоемкость |
F |
V |
L |
S |
СР/СV |
F |
V |
L |
S |
Теплопроводность |
FB,D |
V |
L |
|
Вязкость |
FB,D |
V |
L |
|
Кинематическая вязкость |
FB,D |
V |
L |
|
Поверхностное натяжение |
FB |
|
L |
|
Молекулярный вес |
F |
V |
L |
S |
Фактор сжимаемости |
FB |
V |
L |
S |
относительная плотность (по воздуху) |
FB |
V |
|
|
Фактор Ватсона К (UOP) |
F |
V |
L |
S |
Мольная доля компонента |
F |
V |
L |
S |
Массовая доля компонента |
F |
V |
L |
S |
Объемная доля компонента |
F |
V |
L |
S |
Мольный расход компонента |
F |
V |
L |
S |
Массовый расход компонента |
F |
V |
L |
S |
Объемный расход компонента |
F |
V |
L |
S |

|
|
|
|
|
Методы расчета свойств А - 53 |
|
|
|
|
|
|
|
|
|
Значение К (x/y) |
|
|
|
|
|
|
Нижняя теплота сгорания |
|
|
|
|
|
|
Массовая нижняя теплота сгорания |
|
|
|
|
|
|
Мольная доля жидкости |
F |
V |
L |
S |
|
|
Мольная доля легкой жидкости |
F |
V |
L |
S |
|
|
Мольная доля тяжелой жидкости |
F |
V |
L |
S |
|
|
Мольная теплота испарения |
FC |
V |
L |
|
|
|
Массовая теплота испарения |
FC |
V |
L |
|
|
|
Парциальное давление CO2 |
F |
V |
L |
S |
|
Обозначения:
B - для суммарной фазы свойство вычисляется только в случае однофазных потоков,
С - для суммарной фазы свойство вычисляется только когда поток содержит паровую и/или жидкую фазы,
D - для суммарной фазы свойство вычисляется только когда поток содержит несколько жидких фаз
A.8 Литература
1API Publication 955, A New Correlation of NH3, CO2 and H2S Volatility Data From Aqueous Sour Water Systems, March 1978.
2API Technical Data Book, Petroleum Refining, Fig. 9A1.4, p. 9-15, 5th Edition (1978).
3Chao, K. D. and Seader, J. D., A.I.Ch.E. Journal, pp. 598-605,December 1961.
4Ely, J.F. and Hanley, H.J.M., "A Computer Program for the Prediction of Viscosity and Thermal Conductivity in Hydrocarbon Mixtures", NBS Technical Note 1039.
5Gambill, W.R., Chem. Eng., March 9, 1959.
6Grayson, H. G. and Streed, G. W., "Vapour-Liquid Equilibria for High Temperature, High Pressure Systems", 6th World Petroleum Congress, West Germany, June 1963.
7Hankinson, R.W. and Thompson, G.H., A.I.Ch.E. Journal, 25, No. 4, p. 653 (1979).
8Hayden, J.G. and O’Connell, J.P., Ind. Eng. Chem., Process Des. Dev. 14, 209 (1975).
9Jacobsen, R.T and Stewart, R.B., 1973. "Thermodynamic Properties of Nitrogen Including Liquid and Vapour Phases from 63 K to 2000K with Pressure to 10 000 Bar." J. Phys. Chem. Reference Data, 2: 757-790.
10Kabadi, V.N., and Danner, R.P. A Modified Soave-Redlich-Kwong Equation of State for Water-Hydrocarbon Phase Equilibria, Ind. Eng. Chem. Process Des. Dev. 1985, Volume 24, No. 3, pp 537-541.
11Keenan, J. H. and Keyes, F. G., Thermodynamic Properties of Steam, Wiley and Sons (1959).
12Knapp, H., et al., "Vapor-Liquid Equilibria for Mixtures of Low Boiling Substances", Chemistry Data Series Vol. VI, DECHEMA, 1989.
13Passut, C. A.; Danner, R. P., “Development of a Four-Parameter Corresponding States Method: Vapour Pressure Prediction”, Thermodynamics - Data and Correlations, AIChE Symposium Series; p. 30-36, No. 140, Vol. 70.
14Peng, D. Y. and Robinson, D. B., "A Two Constant Equation of State", I.E.C. Fundamentals, 15, pp. 59-64 (1976).
15Perry, R. H.; Green, D. W.; “Perry’s Chemical Engineers’ Handbook Sixth Edition”, McGraw-Hill Inc., (1984).

А - 54 Методы расчета свойств
16 Prausnitz, J.M., Lichtenthaler, R.N., Azevedo, E.G., "Molecular Thermodynamics of Fluid Phase Equilibria", 2nd. Ed., McGraw-Hill, Inc. 1986.
17 Reid, C.R., Prausnitz, J.M., and Sherwood, T.K., "The Properties of Gases and Liquids", McGraw-Hill Book Company, 1977.
18 Reid, R.C., Prausnitz, J.M., and Poling, B.E., "The Properties of Gases & Liquids", McGraw-Hill, Inc., 1987.
19 Soave, G., Chem Engr. Sci., 27, No. 6, p. 1197 (1972).
20 Stryjek, R., Vera, J.H., J. Can. Chem. Eng., 64, p. 334, April 1986. 21 Twu, C.H., I.E.C. Proc Des & Dev, 24, p. 1287 (1985).
22 Woelflin, W., "Viscosity of Crude-Oil Emulsions", presented at the spring meeting, Pacific Coast District, Division of Production, Los Angeles, Calif., Mar. 10, 1942.
23 Zudkevitch, D., Joffee, J. "Correlation and Prediction of Vapor-Liquid Equilibria with the Redlich-Kwong Equation of State", AIChE Journal, Volume 16, No. 1, January pp. 112-119.

Методы расчета нефтяных смесей Б - 1
Б Методы расчета нефтяных смесей
Б.1 |
Введение................................................................................................. |
2 |
|
Б.2 |
Методика характеризации................................................................... |
2 |
|
Б.2.1 |
Построение рабочих кривых........................................................... |
2 |
|
Б.2.2 |
Анализ газовой части...................................................................... |
3 |
|
Б.2.3 Автоматический расчет газовой части .......................................... |
5 |
||
Б.2.4 Разбивка кривой ИТК на псевдокомпоненты................................. |
5 |
||
Б.2.5 Графическое определение свойств компонентов......................... |
6 |
||
Б.2.6 Расчет критических свойств компонентов..................................... |
6 |
||
Б.2.7 |
Корреляции....................................................................................... |
6 |
|
Б.3 |
Литература.............................................................................................. |
8 |
|
