
- •ОБщая и неорганическая химИя Свойства элементов побочных подгрупп
- •Свойства элементов побочных подгрупп Общие сведения
- •Лабораторная работа № 7. Свойства элементовVii а группы. Галогены
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 8.III в группа. Подгруппа скандия
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 9. IV в группа. Подгруппа титана
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 10. V в группа. Подгруппа ванадия
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 11. VI в группа. Подгруппа хрома
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 12. VII в группа. Подгруппа марганца
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. VIII в группа. Подгруппа железа
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 14. I в группа. Подгруппа меди
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 15. II в группа. Подгруппа цинка
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Литература
- •Содержание
Выполнение работы
Опыт 1. Получение галогенов (выполнять в вытяжном шкафу!).
А. Получение хлора. В пробирку с газоотводной трубкой (или в маленькую колбу Вюрца) поместить немногоMnO2и добавить несколько капель концентрированной соляной кислоты. Пробирку закрыть пробкой. Образующийся хлор пропустить через растворKIи через воду. Отметить изменения в пробирках с водой и иодидом калия.
Б. Получение брома. В пробирку с газоотводной трубкой (или в маленькую колбу Вюрца) поместить немногоMnO2, сухогоKBr, добавить несколько капель 50 %-ной серной кислоты пробирку закрыть пробкой и осторожно нагреть. Выделяющийся бром можно собрать в пробирку с иодидом калия и в пробирку с раствором щелочи, куда добавлена 1 капля фенолфталеина (отметить изменение окраски индикатора).
В. Получение йода.В пробирку с газоотводной трубкой поместить немногоMnO2, сухогоKI, добавить несколько капель 50 % серной кислоты пробирку закрыть пробкой и осторожно нагреть. Выделяющийся йод можно собрать в пробирку, содержащую раствор крахмала – отметить изменение цвета раствора.
Опыт 2. Доказательство неполярной молекулярной структуры галогенов.
А.В три пробирки отобрать пробы (3–5 капель) хлорной, бромной и йодной воды. Прибавить в каждую пробиркуCCl4илиCHCl3и сильно встряхнуть. Отметить окраску органического вещества.
Б.По нескольку кристаллов йода добавить в пробирки с тетрахлоридом углерода, бензолом и разбавленным раствором гидроксида натрия. Отметить окраску растворов.
Примечание: галогены, как вещества неполярные лучше будут растворяться в неполярных органических растворителях, на что указывает изменение окраски органической фазы.
Опыт 3. Сублимация (возгонка) йода.В широкую пробирку с боковым штуцером для отвода газов поместить несколько кристаллов йода. Пробирку плотно закрыть резиновой пробкой, в которую вставлена пробирка поменьше. В маленькую пробирку налить холодную воду или положить кусочки льда. Осторожно нагреть дно большой пробирки. Из темно-фиолетовых паров йода на стенках маленькой пробирки будут осаждаться черно-фиолетовые кристаллы с металлическим блеском.
Опыт 4. Окислительно-восстановительные реакции галогенов.
А. Окисление иодида. В одну пробирку поместить несколько капель 0,1 М раствора бромида калия, в другую – то же количество иодида калия. В каждую пробирку прилить 3–4 капли хлороформа или четыреххлористого углерода и 2–3 капли хлорной воды. Отметить изменение окраски органического растворителя. Затем к пробирке с растворомKIприбавить еще некоторое количество хлорной воды. Фиолетовой окрашивание органической фазы исчезает. Окраска становится желтой из-за образованияICl3. При еще большем избытке хлорной воды образуется бесцветный иотат-ион и желтая окраска исчезает.
Б. Окисление Fe (II) в Fe (III).В одну пробирку налить 4–5 капель бромной воды, во вторую – 3 капли раствора перманганата калия. Добавить в каждую пробирку по две капли 20 %-ной серной кислоты и прилить по 3–4 капли раствора сульфата железа (II). Отметить обесцвечивание растворов. Убедиться в образовании ионовFe3+с помощью качественной реакции с родаидом аммония, при добавлении которого должен образоваться растворимый комплекс красного цвета.
Опыт 5. Различие в окислительно-восстановительных свойствах галогенов.
А.В одну пробирку поместить раствор иодида калия, в другую – бромида калия. В каждую пробирку прилить разбавленную серную кислоту,CCl4илиCHCl3и раствор нитрита натрия. Отметить изменение окраски органического растворителя в случаеKI.
Б.В пробирку
поместить 4 капли раствора иодида калия
и столько же бромида калия. Добавить
немного серной кислоты и органический
растворитель (хлороформ илиCCl4).
Приливать по каплям раствор перманганата
калия. В первую очередь будет окисляться
иод – органическая фаза окрасится в
фиолетовый цвет. При дальнейшем добавлении
перманганата калия произойдет окисление
бромид-иона доBr2,
который переводит иод в бесцветный![]() :
:
I2 + 5Br2 + 6H2O = 2HIO3 + 10HBr.
В ходе этой реакции красно-фиолетовая окраска органического растворителя ослабевает, а избыточный бром окрашивает ее в желтый цвет.
Опыт 6. Реакции диспропорционирования.В 3 пробирки отобрать по нескольку капель хлорной, бромной и иодной воды. В каждую пробирку прилить раствор гидроксида натрия. По изменению цвета раствора можно судить о степени диспропорцонирования.
Опыт 7. Получение галогеноводородов.
А.Получение HCl. В пробирку с газоотводной трубкой (или в маленькую колбу Вюрца) поместить 0,5 гNaClи 2 мл концентрированнойH2SO4. Пробирку осторожно нагреть. Газ собрать в пробирку с водой. Проверить рН раствора при помощи индикаторной бумаги. В полученный раствор положить кусочек цинка или магния. Что произойдет?
Б.Получение HBr. В пробирку с газоотводной трубкой поместить (или в маленькую колбу Вюрца) 0,5 гKBrи 2 мл концентрированнойH2SO4. Пробирку осторожно нагреть. Газ собрать в пробирку с водой. Проверить рН раствора при помощи индикаторной бумаги. В полученный раствор положить кусочек цинка или магния. Что произойдет?
В.Получение HI. В пробирку с газоотводной трубкой поместить 0,5 гKIи 2 мл концентрированнойH3РO4. Газ собрать в пробирку с водой. Проверить рН раствора при помощи индикаторной бумаги. Будет ли цинк растворяться вHI?
Опыт 8. Свойства фторидов
А. Кислотно-основные реакции фторид-иона. Растворить немного фторида натрия в воде и определить рН раствора при помощи индикаторной бумаги. Раствор сохранить для других опытов.
Б. Осаждение фторид-иона. В две пробирки налить немного раствора фторида натрия. В одну пробирку прилить раствор хлорида кальция, в другую – хлорид бария. Образовавшиеся осадки фторидов кальция и бария растворить в соляной или разбавленной азотной кислотах (при необходимости содержимое пробирки можно осторожно! нагреть).
В. Влияние старения осадков на их растворимость. В центрифужных пробирках получить еще раз осадки фторидов кальция и бария, как было указано в опытеБ. Растворы с осадками нагреть до кипения. Осадки отделить центрифугованием, остатки раствора убрать полоской фильтровальной бумаги. Осадки подсушить осторожным нагреванием на горелке и дать постоять несколько минут (можно оставить до конца урока). Прибавить к осадкам разбавленные растворы соляной или азотной кислоты. Нагреть. Сделать выводы о старении осадков и о влиянии старения на их растворимость.
Примечание: в концентрированных кислотах, при нагревании прокаленные осадки фторидов будут медленно растворяться, благодаря протеканию гетерогенной реакции. Происходит вытеснение легколетучего фтористого водорода.
Г. Свойства фторид-иона как лиганда.
Реакция с
ализаринциркониевым лаком. К
нескольким каплям раствора нитрата
цирконияZr(NO3)4приливают 3–4 капли 2 н. раствора
соляной кислоты и 1 каплю раствора
ализарина (0,1%). Раствор окрашивается в
красный цвет, вызванный образованием
ализаринциркониевого лака:
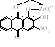
К полученной смеси добавить несколько капель фторида натрия – произойдет переход окраски в желтую, что соответствует цвету свободного ализарина в кислой среде. Цирконий образует с ионами фтора комплекс [ZrF6]2−, который в водном растворе бесцветный. Прочность фторидного комплекса циркония больше, чем ализаринового. Ализариновый комплекс разрушается, что сопровождается изменением цвета раствора.
Реакция с роданидным комплексом железа. В пробирку поместить несколько капель соли железа (III) и добавить 2–3 капли роданида калия или аммония. К образовавшемуся темно-красному раствору роданида железа прилить немного фторида натрия.Fe(CNS)3разрушается. Образуется более прочный фторидный комплекс железа [FeF6]3−. Раствор при этом практически обесцвечивается.
Опыт 9. Изучение растворимости галогенидов.
А. Образование галогенидов серебра. В 4 пробирки налить растворы фторида натрия, хлорида калия, бромида калия и иодида калия. В каждую пробирку добавить по 1–2 капли раствора нитрата серебра.
Б. Образование галогенидов свинца. В 4 пробирки налить раствор 0,1 М нитрата свинца (II) и слегка их подкислить (добавить по 1 капле 0,1 н. азотной кислоты, рН=3,5–4). В пробирку 1 добавить по каплям 0,1 М раствор фторида натрия до образования осадка фторида свинца, записав при этом количество капельNaF. Опыт повторить в других пробирках с хлоридом натрия, бромидом натрия и иодидом натрия, каждый раз записывая число капель.
Примечание: в ряду F–Cl–Br–Iпроисходит постепенное уменьшение растворимости солей, что объясняется различной поляризуемостью ионов. Кроме того, меняется и тип структуры от ионной (PbF2) до более ковалентной молекулярного типа (PbI2).
В. Образование смешанных солей галогенидов. К раствору 0,1 М фторида натрия добавить несколько капель концентрированного раствора карбоната натрия и индикатор бромфеноловый синий, который окрашивается в синий цвет. Добавлением 1 М раствора азотной кислоты довести рН раствора до 3,2–3,4 (изменение окраски раствора на зеленую). К полученному раствору прибавить немного 0,8 М бромида калия и после этого по каплям несколько миллилитров 1,6 М нитрата свинца (II). Через 1 минуту после выпадения осадка при сильном перемешивании добавить по каплям еще несколько миллилитров 0,8 М бромида калия. ОсадокPbBrFстановится крупнокристаллическим, а желтое окрашивание индикатора указывает на понижение рН. С помощью 15 % раствора ацетата натрия довести рН до 3,5–3,7 (изменение цвета индикатора на зеленый). Осадок отделить центрифугированием, промыть, растворить в разбавленной азотной кислоте и к раствору добавить несколько капель нитрата серебра: выпадет бромид серебра.
Примечание: опыт можно проводить и с хлоридом калия.
Г. Образование комплексных галогенидов ртути. В три пробирки поместить 3–4 капли раствора нитрата ртути (II), подкислить его 2,5 М азотной кислотой. Затем в одну пробирку прилить раствор хлорида калия, в другую – бромид калия, в третью – иодид калия. Наблюдать образование осадков галогенидов ртути, а затем их растворение в избытке осадителя.
Опыт 10. Сравнение восстановительных свойств галогенидов
А. Восстановление серной кислоты галогеноводородами. В три пробирки раздельно внести по 1/4 шпателя хлорида, бромида и иодида калия или натрия и по 2–3 капли концентрированной серной кислоты (плотность 1,84 г/см3). Наблюдать в начале реакции выделение белого дыма в каждой пробирке. На образование каких веществ это указывает? Отметить последующее появление бурых паров брома и иода в соответствующих пробирках. По запаху (осторожно!) определить выделение диоксида серы во второй пробирке и сероводорода – в третьей.
Описать наблюдаемые явления и написать уравнения каждой реакции в две фазы: 1) реакций обмена, протекающих с образованием соответствующих галогеноводородов и 2) реакций восстановления избытка серной кислоты бромоводородом и иодоводородом. Протекала ли реакция восстановления серной кислоты хлороводородом? Как изменяются восстановительные свойства в ряду HF, HC1, НВг, HI? Чем это объясняется?
Б. Восстановление дихромата калия.В три пробирки внести по 2–4 капли дихромата калия, подкисленного 2 н. серной кислотой 3–4 капли. Добавить по 2–3 капли в первую пробирку раствора иодида калия, во вторую – столько же какого-либо бромида и в третью – хлорида натрия. Растворы перемешать чистой стеклянной палочкой. В каком случае восстановление дихромата не произошло?
Написать уравнения протекающих реакций, учитывая, что дихромат калия, восстанавливаясь, переходит в сульфат хрома (III). Как изменялась при этом степени окисления соответствующих галогенов?
В. Восстановление хлорида железа (III).Проделать опыт, аналогичный опытуБ, заменив раствор дихромата калия раствором хлорида железа (III).
В каком случае произошло восстановление FeCl3и соответственно окисление галогена? Как изменяется восстановительная способность отрицательных ионов галогенов? Расположить их в ряд по возрастающей восстановительной активности.
