
10, 11, 12 вопрос
.doc
Вопрос 10
Химический потенциал
1)Для закрытых систем, в которых совершается только механическая работа, свободная энергия системы (энергия Гиббса G и энергия Гельмгольца F) зависит только от внешних условий. Если в системе протекают химические реакции или происходит обмен с окружающей средой веществом, сопровождающиеся изменением состава системы, то G и F будут зависеть и от состава системы:
G = f(p, T, n1, n2, …, nk),
F = f(V, T, n1, n2, …, nk),
где n1, n2, …, nk – число моль 1-го, 2-го, …, k-го компонентов.
При р, Т = const изменение энергии Гиббса (полезная работа) системы обусловлено только изменением состава системы:
![]() (1)
(1)
Введем обозначение:
 ,
,
где μi – химический потенциал i-го компонента.
Аналогично,
 .
.
Таким образом, химический потенциал характеризует изменение свободной энергии системы (G или F) при изменении количества i-го компонента на бесконечно малую величину при постоянстве соответствующих внешних параметрах и количествах всех остальных компонентов.
Свободная энергия – это общее свойство системы, химический потенциал характеризует свойства отдельного компонента, входящего в систему.
При р, Т = const уравнение (1) запишется:
![]() ,
,
![]() .
(2)
.
(2)
Это уравнение выражает связь между общим свойством системы и свойствами каждого ее компонента. Проинтегрируем уравнение, приняв i = const:
![]() .
.
Для индивидуального вещества
G
= n
или ![]() ,
Дж/моль,
,
Дж/моль,
т.е. химический потенциал индивидуального вещества – это мольная энергия Гиббса.
При равновесии dG = 0, следовательно,
![]() . (3)
. (3)
Уравнение (3) – общее условие равновесия в системе с переменным составом при р, Т = const.
2) Выражения для химического потенциала компонента
|
Система |
Уравнение |
Примечание |
|
Индивидуальный идеальный газ |
|
0 – стандартный химический потенциал (при р = 1 атм), 0 = f(T); R – универсальная газовая постоянная, R = 8,31 Дж/(мольК); Т – температура, К; p – давление газа |
|
Смесь идеальных газов |
|
рi – парциальное давление газа, рi = xip; xi – мольная доля компонента; p – общее давление газовой смеси, p = рi;
|
|
|
||
|
Идеальный жидкий раствор |
|
xi – мольная доля компонента в растворе
|
|
Смесь реальных газов |
|
fi – парциальная фугитивность, или летучесть – фиктивное давление, подбираемое таким образом, чтобы сохранялась форма термодинамических уравнений (fiV = niRT); |
|
Реальный жидкий раствор |
|
ai – активность компонента, связана с концентрацией через коэффициент активности : В бесконечно разбавленных растворах γ → 1, аi → ci (хi или mi).
|
Существует два основных способа выбора стандартного состояния компонента реального жидкого раствора – симметричный и несимметричный.
Симметричный способ. Выбирается одинаковое стандартное состояние для растворителя и растворенного вещества – состояние чистого компонента при температуре раствора. Способ чаще применяется для растворов неэлектролитов.
Несимметричный способ. Выбирается различное стандартное состояние для растворителя и растворенного вещества. Для растворителя – как и в симметричном способе. Для растворенного вещества за стандартное выбирается состояние вещества в бесконечно разбавленном растворе. Способ наиболее часто используется в термодинамике растворов электролитов.
Вопрос 11
химическое равновесие
1)Протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (dG < 0, dF < 0). При достижении системой минимума свободной энергии устанавливается химическое равновесие, при котором dG = 0 и dF = 0.
Химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью.
Химическое равновесие подвижно – любое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение ее состояния.
2) Уравнение изотермы химической реакции
Рассмотрим условную реакцию, протекающую в идеальной газовой фазе при p, T = const:
аА + bВ = eЕ + lL.
Пусть в реакцию вступило бесконечно малое количество вещества А (dnA моль); с ним прореагировало dnB моль вещества В и образовалось dnE моль вещества E и dnL моль L. Изменения количества исходных веществ и продуктов реакции составили: –dnA, – dnB (количество исходных веществ уменьшается, поэтому знак «–»), dnE и dnL.
В результате этого самопроизвольного процесса изобарный потенциал системы G изменился на величину
![]() ,
,
![]() .
(1)
.
(1)
Выразим dnA, dnB, dnE, и dnL через коэффициенты уравнения реакции. Согласно уравнению:
с а моль вещества А реагирует b моль вещества В
с dnA моль dnB,
тогда
![]() .
.
Аналогично,
![]() ;
;
![]() .
.
Подставим в (1):
![]() .
.
Умножим левую и правую часть уравнения на а и разделим на dnA:
 .
.
Так
как химический потенциал равен мольной
энергии Гиббса
![]() ,
то
,
то
![]() . (2)
. (2)
Применим выражение для химического потенциала компонента идеальной газовой смеси:
![]() .
.
Химический потенциал вещества А равен
![]() ,
,
и т.д. для других компонентов.
Подставим в (2):
 ,
,
 , (3)
, (3)
где
![]() – изменение энергии Гиббса в стандартных
условиях
– изменение энергии Гиббса в стандартных
условиях
Уравнение (3) – уравнение изотермы химической реакции.
При равновесии ΔG = 0, парциальные давления компонентов становятся равновесными и из уравнения изотермы (3) следует, что
 .
(4)
.
(4)
Так как правая часть уравнения (4) зависит только от температуры и природы реагентов, то и левая часть есть постоянная величина при Т = const.
Введем обозначение:
 , (5)
, (5)
где Кр – термодинамическая константа равновесия. Нижний индекс «р» означает, что константа равновесия выражена через парциальные давления компонентов.
Уравнение (5) выражает известный закон действия масс: отношение произведения равновесных парциальных давлений продуктов реакции, взятых в степенях, равных стехиометрическим коэффициентам к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная.
Тогда
![]()
![]() .
.
Подставим в (3):
 . (6)
. (6)
Если известна константа равновесия реакции и парциальные давления (или концентрации) реагентов с помощью уравнения (6) можно оценить знак G и сделать вывод о направлении самопроизвольного процесса: реакция будет протекать самопроизвольно, если
 ,
,
т.к. при этом G < 0.
В зависимости от вида системы, в которой протекает реакция (идеальная, реальная) константу равновесия выражают через парциальные давления Kp, концентрации Kc, мольные доли Kx, активности Ka, фугитивности Kf:
 ,
,  и
т.п.
и
т.п.
Парциальное давление газа pi связано с его мольной долей xi и молярной концентрацией ci соотношением
![]() ,
,
где p – общее давление реакционной смеси, p = pi.
Тогда
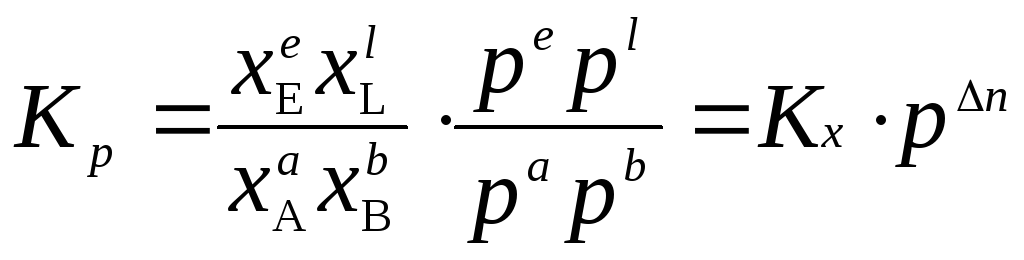 ,
,
где n = e + l – (a + b) – разность между стехиометрическими коэффициентами газообразных продуктов реакции и исходных веществ.
Аналогично,
![]() .
.
Таким образом,
![]() .
.
Если n = 0, то
![]() .
.
Kp, Kc = f(T), а Kx = f(T, p).
Если химическая реакция протекает с участием конденсированных веществ (твердых или жидких), то закон действия масс записывается только для газообразных участников реакции. Например, для реакции
СаСО3(тв) = СаО(тв) + СО2(г)
![]() .
.
Вопрос 12
Влияние условий проведения реакции
на смещение химического равновесия
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если оказать на систему какое-либо внешнее воздействие, равновесие нарушается; в системе возникает самопроизвольный процесс, продолжающийся до установления равновесия уже при новых условиях.
- Влияние концентрации реагирующих веществ.
Если в равновесную реакционную смесь добавить исходное вещество, начнется самопроизвольный процесс, направленный в сторону его расходования и образования продуктов реакции. Такой же процесс будет протекать, если уменьшить концентрацию продуктов реакции, например, удалять их из реактора.
- Влияние давления (для реакций, идущих в газовой фазе).
Давление влияет на положение равновесия только для реакций, протекающих с участием газообразных веществ. Направление смещения равновесия будет определяться знаком Δn:
– если реакция идет с увеличением объема, т.е. Δn > 0, повышение давления сместит равновесие в сторону исходных веществ, выход продуктов сократится;
– для реакций, протекающих с уменьшением объема (Δn < 0), повышение давления будет способствовать увеличению выхода продуктов реакции.
Влияние давления на равновесные системы, в составе которых нет газов, пренебрежимо мало.
- Влияние температуры на химическое равновесие
Воспользуемся уравнениями:
![]() ,
,
![]() .
.
Совместным решением этих уравнений получим:
![]() ,
,
![]() .
.
Полученное выражение продифференцируем по температуре:
![]() (7)
(7)
Уравнение (7) – уравнение изобары Вант-Гоффа – характеризует влияние температуры на константу химического равновесия.
Анализ уравнения.
Для экзотермических реакций Н < 0, следовательно,
![]() .
.
Это означает, что с повышением температуры константа равновесия экзотермической реакции уменьшается и равновесие смещается в сторону образования исходных веществ. Выход продуктов реакции сокращается.
Для эндотермических реакций H > 0, следовательно,
![]() .
.
Это означает, что с повышением температуры константа равновесия эндотермической реакции возрастает и равновесие смещается в сторону увеличения выхода продуктов реакции.
Действие рассмотренных факторов обобщает принцип смещения равновесия, называемый также принципом Ле Шателье – Брауна:
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
