
- •Дисциплина: Физическая химия
- •Работа расширения идеального газа.
- •Теплоемкость при постоянном давлении и объеме и связь между ними.
- •Температурная зависимость теплоемкости от температуры.
- •Применение первого закона термодинамики к химическим процессам.
- •Связь между qp и qv.
- •Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ (на примере реакции).
- •4. Зависимость теплового эффекта от температуры. Уравнение Кирхгоффа в дифференциальной и интегральной форме. Зависимость теплового эффекта от температуры.
- •5. Обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Второй закон термодинамики, его формулировки и математическое выражение. Цикл Карно. Обратимые и необратимые процессы
- •Второй закон термодинамики, его формулировки
- •Цикл Карно
- •Расчет изменения энтропии при различных термодинамических процессах и при протекании химических реакций.
- •Свободная и связанная энергия.
- •7. Основные соотношения между термодинамическими функциями. Уравнение Гиббса-Гельмгольца.
- •Уравнение Гиббса – Гельмгольца
- •Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения.
- •Интегрирование уравнения Клаузиуса - Клапейрона и его анализ.
- •Признаки равновесных состояний.
- •Закон действующих масс. Вывод константы равновесия для гомогенной реакции.
- •Связь между различными формами выражения констант равновесия.
- •Химическое сродство как мера реакционноспособности системы. Изотерма Вант-Гоффа.
- •Нормальное химическое сродство.
- •11. Зависимость константы равновесия от температуры. Уравнение изобары Вант-Гоффа в дифференциальной и интегральной формах. Уравнение изохоры Вант-Гоффа в дифференциальной и интегральной формах.
- •Метод Темкина–Шварцмана
- •13. Термодинамика и законы разбавленных растворов. Понижение давления пара растворителя над раствором. Закон Рауля.
- •14. Растворимость газов в жидкостях. Закон Генри. Зависимость растворимости газов от различных факторов.
- •15. Замерзание и кипение растворов. Криоскопия и эбуллиоскопия.
Уравнение Гиббса – Гельмгольца
Рассмотрим
изохорно-изотермическую систему (Т =
const; V = const) и воспользуемся для характеристики
этой системы функцией F = U – T·S. Так как
 ,
то, подставив это значение в уравнение
функции свободной энергии, получим
,
то, подставив это значение в уравнение
функции свободной энергии, получим .
.
Рассмотрим
изотермический переход системы из
начального состояния в конечное, для
которых
 ;
; .
.
Но

и
 ,
,
поэтому
 (1)
(1)
или
 .
.
Анализируя
протекание процесса в изобарно-изотермических
условиях (Т = const; р = const), путем аналогичных
рассуждений придем к выводу, что (2)
(2)
или
 .
.
Уравнения (1) и (2) выражают величину максимальной работы через тепловой эффект реакции и называются уравнениями Гиббса-Гельмгольца.
Из уравнений
видно, что теплота может служить мерой
химического сродства только при Т = 00 К
или при
 ,
т. е. при независимости величины работы
от температуры.
,
т. е. при независимости величины работы
от температуры.
8. Применение второго закона термодинамики к фазовым превращениям. Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения. Интегрирование уравнения Клаузиуса - Клапейрона и его анализ.
Применение второго закона термодинамики к фазовым превращениям.
Процессы перехода системы из одной фазы в другую называется фазовыми превращениями. К ним относятся процессы плавления, кристаллизации, испарения, кипения, конденсации, сублимации (возгонки) и полиморфные превращения.
Температура фазового превращения не зависит от количества равновесных фаз и является величиной постоянной (Т = const). Зависимость температуры фазового перехода от давления была установлена Клапейроном (1834 г.) и обоснована Клаузиусом (1850 г.).
Дифференциальная форма уравнения Клапейрона-Клаузиуса имеет вид:
 ,
,
где Н ф.пр. - теплота (энтальпия) фазового превращения, Дж/моль; Т ф.пр. - температура фазового превращения; V1, V2 - объёмы разных фаз.
Уравнения Клапейрона-Клаузиуса для частных случаев фазовых превращении:
1) Для процессов испарения и конденсации:
 ,
,
где Нисп.- теплота испарения , Дж/моль; Vп - объём пара, л.; Vж - объём жидкости, л. ; Ткип - температура кипения, град.
2) Для процесса плавления и кристаллизации:
 ,
,
где Нпл.- скрытая теплота плавления, Дж/моль; Vтв- объём твердого тела , л.; Тпл.- температура плавления, град ;
3) Для процесса (сублимации) возгонки:
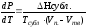 .
.
где Нсубл. - теплота возгонки, Дж/моль; Тсубл. - температура сублимации, град.
4) Для процесса полиморфного превращения:
 ,
,
где Н - теплота полиморфного превращения, Дж/моль;
Т - температура полиморфного превращения, град.
Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения.
Рассмотрим процесс фазового превращения на примере кипенияжидкости.
Испарение - это фазовый переход на границе раздела жидкость пар или жидкости.
Кипение - это процесс, когда парообразование происходит не только с поверхности но внутри жидкости путём образования пузырьков пара жидкости и их выделения. При этом давление в пузырьках пара, находящихся в равновесии с жидкостью, равно давлению пара над жидкостью.
Температура кипения - это температура, при которой давление насыщенного пара жидкости равно внешнему давлению:
Рнасыщ. пара = Рвнеш.
Нормальнойназывается температура кипения жидкости, измеренная при нормальном давлении.
Уравнение Клапейрона-Клаузиуса (5.2.) можно преобразовать, приняв следующие приближения:
1.
Поскольку Vп
>>
Vж
(например для воды мольный объем в
парообразном состоянии при нормальных
условиях равен Vп
=22400 см3,
а в жидком состоянии Vж
=
18 см3),
то в уравнении
 можно пренебречь величиной
можно пренебречь величиной и
принять, что
и
принять, что ;
;
2. При невысоких давлениях и температурах (вдали от критических) можно применять уравнение состояния идеального газа (уравнение Клапейрона-Менделеева ) и к реальным системам. Тогда
 ,
,
где R - универсальная газовая постоянная.
Подставив
уравнение в уравнение К-К
в уравнение К-К ,
получим:
,
получим:
 .
.
Это
уравнение после преобразования:

принимает
вид:
 .
.
Теплота испарения зависит от температуры: c повышением температуры она понижается, а с понижением - повышается; при критической температуре теплота испарения равна нулю.
При температурах, далёких от критической, изменения теплоты испарения малы и поэтому в небольшом интервале температур, теплоту испарения можно считать величиной постоянной: =const.
