- •Дисциплина: Физическая химия
- •Работа расширения идеального газа.
- •Теплоемкость при постоянном давлении и объеме и связь между ними.
- •Температурная зависимость теплоемкости от температуры.
- •Применение первого закона термодинамики к химическим процессам.
- •Связь между qp и qv.
- •Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ (на примере реакции).
- •4. Зависимость теплового эффекта от температуры. Уравнение Кирхгоффа в дифференциальной и интегральной форме. Зависимость теплового эффекта от температуры.
- •5. Обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Второй закон термодинамики, его формулировки и математическое выражение. Цикл Карно. Обратимые и необратимые процессы
- •Второй закон термодинамики, его формулировки
- •Цикл Карно
- •Расчет изменения энтропии при различных термодинамических процессах и при протекании химических реакций.
- •Свободная и связанная энергия.
- •7. Основные соотношения между термодинамическими функциями. Уравнение Гиббса-Гельмгольца.
- •Уравнение Гиббса – Гельмгольца
- •Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения.
- •Интегрирование уравнения Клаузиуса - Клапейрона и его анализ.
- •Признаки равновесных состояний.
- •Закон действующих масс. Вывод константы равновесия для гомогенной реакции.
- •Связь между различными формами выражения констант равновесия.
- •Химическое сродство как мера реакционноспособности системы. Изотерма Вант-Гоффа.
- •Нормальное химическое сродство.
- •11. Зависимость константы равновесия от температуры. Уравнение изобары Вант-Гоффа в дифференциальной и интегральной формах. Уравнение изохоры Вант-Гоффа в дифференциальной и интегральной формах.
- •Метод Темкина–Шварцмана
- •13. Термодинамика и законы разбавленных растворов. Понижение давления пара растворителя над раствором. Закон Рауля.
- •14. Растворимость газов в жидкостях. Закон Генри. Зависимость растворимости газов от различных факторов.
- •15. Замерзание и кипение растворов. Криоскопия и эбуллиоскопия.
Цикл Карно
Сущность ограничений, налагаемых вторым законом на превращение теплоты в работу, можно пояснить на примере действия идеальной машины (машина работает без трения и без потерь тепла, а под рабочим телом подразумевается идеальный газ), работающей по принципу обратимого цикла С. Карно (1824 г).
Рассматриваемый цикл состоит из четырех процессов:
1)
изотермического расширения;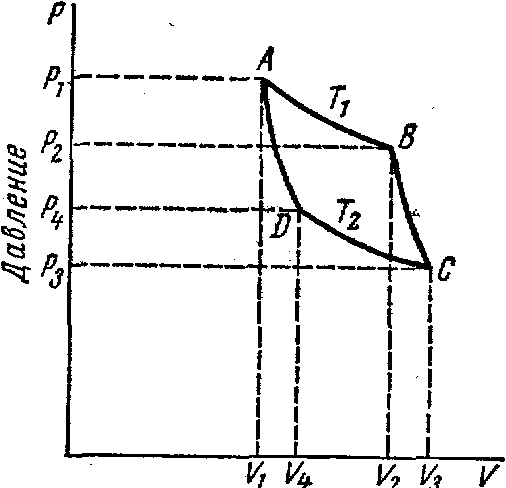
2) адиабатического расширения;
3) изотермического сжатия;
4) адиабатического сжатия газа.
Все процессы проводятся обратимо, в результате чего газ возвращается в исходное состояние. Пусть количество газа равно 1-ому молю. Начальное состояние характеризуется температурой Т1, давлением p1, объемом V1 (точка А на рис.).
В первом процессе газ изотермически и обратимо расширяется от объема V1 до объема V2. Допустим, что теплоотдатчик так велик, что его температура заметно не изменяется. В таком процессе газ производит работу расширения А1 целиком за счет поглощения теплоты Q1.
Тогда
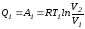 .
.
Прекратив
в точке В
подачу тепла, дадим газу адиабатически
расшириться. Работа А2,
совершаемая при таком расширении,
происходит целиком за счет уменьшения
внутренней энергии газа, т. е. понижения
его температуры. Последняя падает от
Т1
до Т2.
Объем газа в точке С
будет
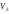 .
Изменение внутренней энергии в этих
условиях
.
Изменение внутренней энергии в этих
условиях
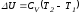 .
.
Работа
в этом процессе в точности равна убыли
внутренней
энергии
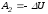 ,
откуда
,
откуда
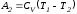 .
.
От точки С до точки D проводим изотермическое сжатие (теплота отводится в холодильник). При изотермическом сжатии внутренняя энергия газа не изменяется, ибо температура Т2 постоянна. Вся работа А3, затрачиваемая на сжатие, переходит в теплоту Q2, которая и отводится в холодильник. Таким образом,
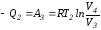 .
.
Последний
процесс - адиабатическое сжатие газа -
проведем следующим образом: отсоединим
газ от теплоприемника и сожмем его до
объема
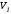 ,
т. е. вернем
,
т. е. вернем
газ в исходное состояние. В этом процессе внутренняя энергия газа возрастет на величину, равную затраченной работе сжатия А4:
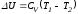 ;
;
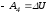 ,
,
т.е.
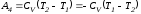 .
.
Так как процесс в целом является круговым, то внутренняя энергия газа в конечном состоянии равна таковой в начальном состоянии, и общее количество теплоты, полученное газом, равно общему количеству произведенной им работы
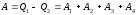 .
.
А2
и А4
равны по абсолютному значению, но
противоположны по знаку. Учитывая это,
получим:
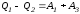 .
Подставив вместо А1
и А3
соответствующие им значения, получим:
.
Подставив вместо А1
и А3
соответствующие им значения, получим:
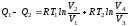 или
или
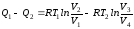 .
.
Используя
уравнение адиабаты
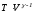 =
соnst,
где
=
соnst,
где
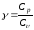 ,
можно доказать, что
,
можно доказать, что
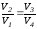 ,
,
тогда
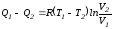 .
.
Разделив левую и правую части этого равенства на уравнение (2.1), будем иметь:
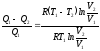 ;
;
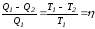 ,
,
где η – коэффициент полезного действия (К.П.Д.) тепловой машины.
Отсюда
видно, что коэффициент полезного действия
цикла
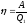 зависит
только от разности температур нагревателя
и холодильника. Так какТ2<Т1,
то
зависит
только от разности температур нагревателя
и холодильника. Так какТ2<Т1,
то
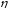 <1.
Следовательно, даже в идеальном случае
существует предел превращения теплоты
в работу.
<1.
Следовательно, даже в идеальном случае
существует предел превращения теплоты
в работу.
Можно доказать, что тепловая машина, работающая по любому реальному циклу, будет иметь коэффициент полезного действия меньше, чем работающая по циклу Карно.
6. Энтропия как мера неупорядоченности системы. Свободная и связанная энергия. Расчет изменения энтропии при различных термодинамических процессах и при протекании химических реакций.
Энтропия как мера неупорядоченности системы.
Энтропия (S)–это мера неупорядоченности движения материи или мера деградации (рассеянности) энергии.
Всякая система со временем переходит из неравновесного состояния в равновесное, в процессе такого перехода энтропия всегда увеличивается, а в состоянии равновесия имеет малое значение.
Размерность энтропии совпадает с размерностью теплоемкости, однако, теплоемкость и энтропия – не одно и тоже. Теплоемкость характеризует количество теплоты, необходимо для нагревания тела на 1 град, а энтропия характеризует количество рассеянной энергии, приходящийся на 1 град. Энтропия является величиной экстенсивной.