
- •Дисциплина: Физическая химия
- •Работа расширения идеального газа.
- •Теплоемкость при постоянном давлении и объеме и связь между ними.
- •Температурная зависимость теплоемкости от температуры.
- •Применение первого закона термодинамики к химическим процессам.
- •Связь между qp и qv.
- •Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ (на примере реакции).
- •4. Зависимость теплового эффекта от температуры. Уравнение Кирхгоффа в дифференциальной и интегральной форме. Зависимость теплового эффекта от температуры.
- •5. Обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Второй закон термодинамики, его формулировки и математическое выражение. Цикл Карно. Обратимые и необратимые процессы
- •Второй закон термодинамики, его формулировки
- •Цикл Карно
- •Расчет изменения энтропии при различных термодинамических процессах и при протекании химических реакций.
- •Свободная и связанная энергия.
- •7. Основные соотношения между термодинамическими функциями. Уравнение Гиббса-Гельмгольца.
- •Уравнение Гиббса – Гельмгольца
- •Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения.
- •Интегрирование уравнения Клаузиуса - Клапейрона и его анализ.
- •Признаки равновесных состояний.
- •Закон действующих масс. Вывод константы равновесия для гомогенной реакции.
- •Связь между различными формами выражения констант равновесия.
- •Химическое сродство как мера реакционноспособности системы. Изотерма Вант-Гоффа.
- •Нормальное химическое сродство.
- •11. Зависимость константы равновесия от температуры. Уравнение изобары Вант-Гоффа в дифференциальной и интегральной формах. Уравнение изохоры Вант-Гоффа в дифференциальной и интегральной формах.
- •Метод Темкина–Шварцмана
- •13. Термодинамика и законы разбавленных растворов. Понижение давления пара растворителя над раствором. Закон Рауля.
- •14. Растворимость газов в жидкостях. Закон Генри. Зависимость растворимости газов от различных факторов.
- •15. Замерзание и кипение растворов. Криоскопия и эбуллиоскопия.
Применение первого закона термодинамики к химическим процессам.
Закон
Гесса незаменим для расчета тех тепловых
эффектов, которые не могут быть измерены
калориметрическим путем. Например, при
реакции С
+ О2
в
качестве конечного продукта образуется
СО2,
а при неполном сгорании – СО и СО2.
Вследствие протекания реакции в двух
направлениях прямое определение теплоты
образования СО неосуществимо. Для
нахождения этого теплового эффекта
можно воспользоваться законом Гесса.
Образование двуокиси углерода может
быть осуществлено двумя путями (рис.).
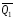 и
и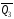 легко определяются опытным путем, а
легко определяются опытным путем, а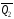 -
тепловой эффект образования СО – находят
при помощи закона Гесса
-
тепловой эффект образования СО – находят
при помощи закона Гесса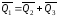 ,
,
откуда
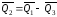 .
.
Связь между qp и qv.
Согласно
принятой в термодинамике системе знаков
отрицательному значению Qυ
соответствует выделение теплоты
(экзотермические реакции), а положительному
– поглощение (эндотермические реакции).
В термохимии, в силу исторических
традиций, часто применяется термохимическая
система знаков
для теплоты реакции (и теплоты растворения).
Положительной
считается теплота, выделившаяся
в результате реакции, а отрицательной
– поглощенная теплота.
Будем обозначать термохимическую
теплоту
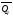 при
условии, что
при
условии, что
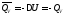 .
.
Стехиометрические
уравнения химической реакции, содержащие
в правой части тепловой эффект
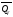 (или
(или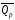 прир
= const),
называются термохимическими.
прир
= const),
называются термохимическими.
Кроме
указания на агрегатное или модификационное
состояние участников реакции, должны
указываться условия проведения реакции,
от которых также зависит тепловой эффект
реакции. В частности, тепловой эффект
 больше теплового эффекта
больше теплового эффекта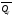 на величину работы расширенияА
= рΔu
= Δ νRT
газообразных участников реакции:
на величину работы расширенияА
= рΔu
= Δ νRT
газообразных участников реакции:
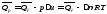 ,
,
где Δν- прирост числа молей газообразных веществ, рассчитанный по стехиометрическому уравнению.
Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ (на примере реакции).
Измерение тепловых эффектов возможно при соблюдении двух условий:
1) когда в системе протекает только одна реакция;
2) реакция протекает до конца достаточно быстро, так что теплота за время ее измерения не успевает рассеиваться в окружающую среду.
При расчетах тепловых эффектов химических реакций на основе закона Гесса особое значение имеют два вида тепловых эффектов – теплота образования и теплота сгорания.
Теплотой образования называется тепловой эффект реакции образования 1 моль данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при данной температуре. Например, теплота образования СаСО3 равна тепловому эффекту реакции образования карбоната кальция в данной его кристаллической модификации из металлического кальция, углерода (графит) и газообразного кислорода:
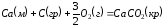 .
.
Теплоту
образования относят к одному молю
соединения при температуре 250С
и называют стандартной
теплотой образования
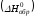 .
Тепловой эффект любой химической реакции
можно легко рассчитать, если известны
теплоты образования всех веществ,
участвующих в реакции. Из закона Гесса
следует, чтотепловой
эффект реакции равен разности между
теплотами образования всех веществ,
указанных в правой части уравнения, и
теплотами образования всех веществ,
указанных в левой части уравнения
реакции, взятых с соответствующими
стехиометрическими коэффициентами.
.
Тепловой эффект любой химической реакции
можно легко рассчитать, если известны
теплоты образования всех веществ,
участвующих в реакции. Из закона Гесса
следует, чтотепловой
эффект реакции равен разности между
теплотами образования всех веществ,
указанных в правой части уравнения, и
теплотами образования всех веществ,
указанных в левой части уравнения
реакции, взятых с соответствующими
стехиометрическими коэффициентами.
Например, дана реакция
bB
+ dD
= gG
+ rR
+
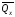 дж.
дж.
Обозначим
теплоты образования соответственно
через
 ,
,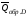 ,
,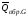 ,
, .
.
Тепловой эффект реакции
 ,
,
или в общем случае
 ;
;
 .
.
Теплотой сгорания называется тепловой эффект реакции окисления 1 моль данного соединения кислородом с образованием высших окислов соответствующих элементов. Для органических соединений теплотой сгорания называется тепловой эффект реакции полного сгорания данного соединения до углекислого газа, водяных паров и других продуктов.
Отнесенная
к 250С,
теплота сгорания называется стандартной
теплотой сгорания
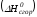 .
.
Если известны теплоты сгорания всех веществ, участвующих в реакции, то можно рассчитать тепловой эффект самой реакции.
Из закона Гесса следует, что тепловой эффект реакции равен разности между теплотами сгорания веществ, указанных в левой части уравнения, и теплотами сгорания веществ, указанных в правой части уравнения, взятых с соответствующими стехиометрическими коэффициентами.
Для
реакции bB
+ dD
= gG
+ rR
+
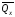 ,
если теплоты сгорания обозначим
соответственно
,
если теплоты сгорания обозначим
соответственно
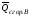 ,
,
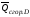 ,
,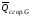 ,
,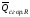 ,
,
тепловой
эффект
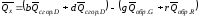 .
.
В
общем виде
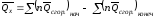 ;
;
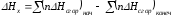 .
.
Заметим, что в обоих случаях теплоты образования и сгорания должны определяться в одинаковых условиях – или в изобарных, или изохорных. Изобарные и изохорные стандартные теплоты образования и сгорания многих соединений можно найти в справочниках.
Для приближенного расчета тепловых эффектов существует целый ряд эмпирических закономерностей. Например, для расчета теплот сгорания органических веществ применяется приближенная формула, предложенная Д. П. Коноваловым
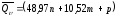 ккал/моль,
ккал/моль,
где n – число атомов кислорода, требующихся для полного сгорания данного вещества; m – число молей образующейся жидкой воды; р - поправочная величина, названная Коноваловым термической характеристикой. Постоянный коэффициент 48,97 выражает теплоту полного сгорания угля в расчете на один грамм-атом кислорода, а коэффициент 10,52 – теплоту конденсации образующихся водяных паров. Для соединения, имеющего эмпирическую формулу СхНуОz,
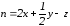 и
и
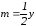 .
.
Для всех предельных органических соединений р = 0. Для непредельных соединений р ≠ 0. Значение этой величины является постоянным для всех членов данного гомологического ряда и растет с повышением непредельности; например, для соединений ацетиленового ряда р = 51.
