
- •Дисциплина: Физическая химия
- •Работа расширения идеального газа.
- •Теплоемкость при постоянном давлении и объеме и связь между ними.
- •Температурная зависимость теплоемкости от температуры.
- •Применение первого закона термодинамики к химическим процессам.
- •Связь между qp и qv.
- •Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ (на примере реакции).
- •4. Зависимость теплового эффекта от температуры. Уравнение Кирхгоффа в дифференциальной и интегральной форме. Зависимость теплового эффекта от температуры.
- •5. Обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Второй закон термодинамики, его формулировки и математическое выражение. Цикл Карно. Обратимые и необратимые процессы
- •Второй закон термодинамики, его формулировки
- •Цикл Карно
- •Расчет изменения энтропии при различных термодинамических процессах и при протекании химических реакций.
- •Свободная и связанная энергия.
- •7. Основные соотношения между термодинамическими функциями. Уравнение Гиббса-Гельмгольца.
- •Уравнение Гиббса – Гельмгольца
- •Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения.
- •Интегрирование уравнения Клаузиуса - Клапейрона и его анализ.
- •Признаки равновесных состояний.
- •Закон действующих масс. Вывод константы равновесия для гомогенной реакции.
- •Связь между различными формами выражения констант равновесия.
- •Химическое сродство как мера реакционноспособности системы. Изотерма Вант-Гоффа.
- •Нормальное химическое сродство.
- •11. Зависимость константы равновесия от температуры. Уравнение изобары Вант-Гоффа в дифференциальной и интегральной формах. Уравнение изохоры Вант-Гоффа в дифференциальной и интегральной формах.
- •Метод Темкина–Шварцмана
- •13. Термодинамика и законы разбавленных растворов. Понижение давления пара растворителя над раствором. Закон Рауля.
- •14. Растворимость газов в жидкостях. Закон Генри. Зависимость растворимости газов от различных факторов.
- •15. Замерзание и кипение растворов. Криоскопия и эбуллиоскопия.
Нормальное химическое сродство.
Для того, чтобы можно было сравнивать сродство различных веществ, было введено понятие нормального химического сродства. К уравнению нормального химического сродства легко перейти из уравнения изотермы Вант-Гоффа, если предположить, что исходные концентрации или исходные парциальные давления всех участников реакции равными единице, тогда уравнения изотермы Вант-Гоффа упростятся и убыль нормальной свободной энергии примет вид:
G0=Wр=RTlnKp,
F0=Wv=RTlnKc.
где G0иF0–нормальное химическое сродство или мера химического сродства. Сравнивая Wvи Wpразличных веществ, можно получить характеристику степени их удалённости от состояния равновесия при концентрации каждого из них Сi= 1 моль/л или парциальном давлении Рi= 1атм.
11. Зависимость константы равновесия от температуры. Уравнение изобары Вант-Гоффа в дифференциальной и интегральной формах. Уравнение изохоры Вант-Гоффа в дифференциальной и интегральной формах.
Зависимость константы химического равновесия от температуры выводится, во-первых, из уравнения нормального химического сродства:
- G0=Wр=RTlnKp,
и, во- вторых, из уравнения Гиббса-Гельмгольца:
G0Т = H0Т –TS0,
G0Т=H0Т–T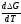 ,
,
удобно сочетающих первый и второй законы термодинамики применительно к обратимым изотермическим процессам, где Н0Т– тепловой эффект реакции, Дж/моль,S0– изменение энтропии, Дж/мольК.
Для нахождения зависимости константы химического равновесия от температуры возьмём производную по температуре из уравнения изотермы и подставив значение G и её производной по температуре в уравнение (4.22), получим уравнение:
-
RTlnKp=H0Т–RTlnKp–RT2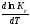 .
.
Сократив одинаковые члены уравнения и сделав соответствующие преобразования, получим:
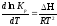 ,
(1)
,
(1)
где
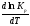 – температурный коэффициентконстанты
химического равновесия.
– температурный коэффициентконстанты
химического равновесия.
Выражение (1) называется уравнением изобары Вант-Гоффа в дифференциальной форме.
Если процесс протекает при постоянном объёме, то зависимость константы равновесия от температуры определяется уравнением изохоры Вант-Гоффа, которое выводится аналогичным образом:
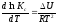 ,
,
где U– стандартное изменение внутренней энергии системы.
Для реакций, протекающих в неидеальных растворах, в уравнении изохоры Ксзаменяется на Ка(концентрация (с) заменяется на активность (а)), при этом получается:
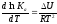 .
.
Анализ уравнений изобары и изохоры показывает, если реакция протекает с выделением теплоты (H < 0,U < 0), то температурный коэффициент константы равновесия меньше нуля:
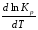 < 0;
< 0;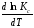 < 0;
< 0;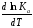 < 0.
< 0.
Следовательно, с повышением температуры константа равновесия экзотермических реакций уменьшается и равновесие смещается в сторону обратной реакции.
Если Н > 0 иU> 0 реакция протекает с поглощением тепла, т. е. является эндотермической, то:
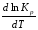 > 0;
> 0;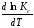 > 0;
> 0;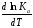 > 0.
> 0.
Это означает, что с ростом температуры константа равновесия эндотермической реакции всегда увеличивается и равновесие смещается в сторону прямой реакции (вправо). Отсюда вывод: экзотермические реакции необходимо проводить при пониженной, а эндотермические – при повышенной температуре, так как наибольшая полнота эндотермических реакций достигается при возможно более высоких температурах, а наибольшая полнота экзотермических реакций – при более низких температурах. И наконец, еслиН = 0, то константа равновесия Кр не зависит от температуры. Эти же выводы получаются изпринципа смещения равновесия Ле-Шателье-Брауна(1885-1886 гг.):
Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих состояние равновесия, то в системе усилится то из направлений процесса, течение которого ослабляет влияние произведённого воздействия, и положение равновесия сместится в том же направлении.
Так в реакции 3Н2+N2 2NH3 H0298= - 46,2 кДж/моль
при понижении температуры и повышении давления усиливается экзотермическая реакция синтеза аммиака, сопровождающаяся уменьшением объёма, так как только таким путём может быть ослаблен эффект внешнего воздействия.
Для использования уравнений Вант-Гоффа для практических расчётов следует проинтегрировать дифференциальные уравнения изобары и изохоры в пределах двух температур с учётом того, что тепловой эффект реакции в небольшом температурном интервале изменяется незначительно и его можно считать условно постоянным. При таком допуске интегрирование уравнения (1)
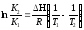 .
(2)
.
(2)
Уравнение (2) называется интегральной формой изобары Вант-Гоффа, оно позволяет: Во-первых, вычислить стандартный тепловой эффект реакцииН0по экспериментально найденным при двух температурах константам равновесия; Во-вторых, вычислить константу равновесия при заданной температуре, если известный стандартный тепловой эффект реакции и константа равновесия при стандартной температуре.
Интегральная
форма изобары Вант-Гоффа аналогично:

Более точное значение теплового эффекта реакции, учитывающее его зависимость теплоёмкости от температуры Т, рассчитывается по закону Кирхгофа:
Н0Т=Н0298+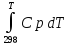 ,
,
где H0298- стандартная энтальпия, Дж/моль;Ср – изменение теплоёмкости веществ в процессе реакции.
Неопределённое интегрирование уравнения изобары Вант-Гоффа (4.27) даёт линейное уравнение:
 .
(3)
.
(3)
При переходе к десятичному логарифму получим:
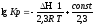 .
(4)
.
(4)
Обозначим постоянные слагаемые буквами А и В, тогда уравнение примет вид:
lnKp
=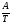 + B. (5)
+ B. (5)
Выражения
(3)-(5) удобны для графического анализа
процессов, так как зависимость в
координатах lnKp=f(1/T)
представляет собой прямую линию, где А
= -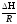 - угловой коэффициент прямой, а В =const- отрезок ординаты,
отсекаемой этой прямой и равныйlnKpпри 1/Т = 0.
- угловой коэффициент прямой, а В =const- отрезок ординаты,
отсекаемой этой прямой и равныйlnKpпри 1/Т = 0.
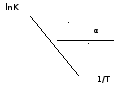

Рис. Зависимость логарифма константы равновесия от величины обратной температуры.
Из уравнения (5) и рисунка видно, что логарифм константы равновесия линейно зависит от обратного значения температуры, при этом, если Н < 0, реакция является экзотермической, прямая на графикеlnK=f(1/T) образует тупой угол и константа равновесия с ростом температуры увеличивается. И, наоборот, еслиН > 0, реакция является эндотермической, угол оказывается острым, константа равновесия увеличивается с понижением температуры.
12. Расчет равновесных состояний с помощью таблиц стандартных термодинамических величин и по методу Тёмкина-Шварцмана
Расчет химического равновесия с помощью таблиц стандартных термодинамических величин
В настоящее время при расчетах химических равновесий широко используют таблицы термодинамических величин, где приведены вычисленные с большой точностью термодинамические характеристики веществ в стандартном состоянии. Газы и растворы в стандартном состоянии считаются идеальными.
Расчет ΔG и Кр целесообразно разделить на два этапа:
1) Сначала вычисляют изменение изобарного потенциала реакции для условий, принятых за стандартные (температура 298, 150К; давление, под которым находится каждое из чистых веществ – 1 атм). Стандартные изменения энтальпии, изобарного потенциала и стандартную энтропию принято обозначать ΔН2980, ΔG2980 и ΔS2980. По величине и знаку ΔG2980 определяют возможность реакции. Если ΔG2980 >0 и абсолютное значение ΔG2980 очень велико, то реакция в стандартных условиях неосуществима и, следовательно, все другие расчеты не имеют смысла.
Обычно в таблицах представлены теплоты образования ΔН0 соединений из простых веществ. Очевидно, что ΔН0 простых веществ, находящихся в стандартном состоянии, равны нулю.
В таблицах приводится также - ΔG0 – убыль энергии Гиббса при образовании одного киломоля вещества из элементов, находящихся в стандартном состоянии. Для элементов в стандартном состоянии ΔG0 =0.
В термодинамических таблицах приводятся еще абсолютные значения энтропии ΔS0 веществ в стандартном состоянии.
Для иллюстрации рассчитаем в общем виде ΔН2980, ΔG2980 и ΔS2980 реакции.
NH3 + HCl ↔NH4Cl;
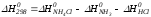 ,
,
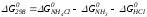 ,
,
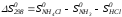 .
.
2) Затем от найденного значения ΔG2980 переходят к значению ΔGТ0 при температуре, отличной от температуры 2980 К; далее определяют константу равновесия, состав равновесной смеси и выход продуктов реакции.
В соответствии с уравнением (2.41) ΔGТ0 = ΔНТ0 - ТΔS 0 для перехода от ΔG2980 к ΔGТ0 необходимо пересчитать ΔН2980 на ΔНТ0 и ΔS2980 на ΔSТ 0для заданной температуры.
Чтобы определить значения термодинамических характеристик при других температурах и давлениях, надо использовать выведенные ранее соотношения.
