
- •Дисциплина: Физическая химия
- •Работа расширения идеального газа.
- •Теплоемкость при постоянном давлении и объеме и связь между ними.
- •Температурная зависимость теплоемкости от температуры.
- •Применение первого закона термодинамики к химическим процессам.
- •Связь между qp и qv.
- •Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ (на примере реакции).
- •4. Зависимость теплового эффекта от температуры. Уравнение Кирхгоффа в дифференциальной и интегральной форме. Зависимость теплового эффекта от температуры.
- •5. Обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Второй закон термодинамики, его формулировки и математическое выражение. Цикл Карно. Обратимые и необратимые процессы
- •Второй закон термодинамики, его формулировки
- •Цикл Карно
- •Расчет изменения энтропии при различных термодинамических процессах и при протекании химических реакций.
- •Свободная и связанная энергия.
- •7. Основные соотношения между термодинамическими функциями. Уравнение Гиббса-Гельмгольца.
- •Уравнение Гиббса – Гельмгольца
- •Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения.
- •Интегрирование уравнения Клаузиуса - Клапейрона и его анализ.
- •Признаки равновесных состояний.
- •Закон действующих масс. Вывод константы равновесия для гомогенной реакции.
- •Связь между различными формами выражения констант равновесия.
- •Химическое сродство как мера реакционноспособности системы. Изотерма Вант-Гоффа.
- •Нормальное химическое сродство.
- •11. Зависимость константы равновесия от температуры. Уравнение изобары Вант-Гоффа в дифференциальной и интегральной формах. Уравнение изохоры Вант-Гоффа в дифференциальной и интегральной формах.
- •Метод Темкина–Шварцмана
- •13. Термодинамика и законы разбавленных растворов. Понижение давления пара растворителя над раствором. Закон Рауля.
- •14. Растворимость газов в жидкостях. Закон Генри. Зависимость растворимости газов от различных факторов.
- •15. Замерзание и кипение растворов. Криоскопия и эбуллиоскопия.
Признаки равновесных состояний.
Истинное химическое равновесие характеризуется следующими признаками:
В момент равновесия скорости прямой и обратной реакции равны, а концентрации всех участников реакции остаются неизменными как угодно долго при постоянных внешних условиях.
Химическое равновесие подвижно, даже незначительное изменение внешних условий приводит к нарушению равновесного состояния и его сдвигу в ту или иную сторону.
К одному и тому же состоянию равновесия можно подойти с двух сторон.
В момент достижения равновесия запас свободной энергии системы (G, F) является минимальным, а энтропия – максимальной.
Закон действующих масс. Вывод константы равновесия для гомогенной реакции.
Многие химические реакции, в зависимости от условий, могут термодинамически протекать самопроизвольно как в прямом так и в обратном направлении. Состав равновесной реакционной смеси характеризуется тем, что концентрации исходных веществ и конечных продуктов находятся по отношению друг к другу в определённом динамическом равновесии.
Основным законом кинетики является закон действующих масс, открытый в 1867 г. К.Гульбергом и П.Вааге: Скорость односторонней химической реакции прямопропорциональна произведению концентрации реагирующих веществ, взятых в степенях, соответствующих стехиометрическим коэффициентам. Частная формулировка закона была дана Н. Н. Бекетовым в 1865 г. при изучении давления водорода на скорость вытеснения им металлов из их солей.
Химические реакции подразделяются на гомогенные и гетерогенные.
Гомогенными называются реакции, протекающие в одной фазе: в смеси газов, в жидком или иногда в твёрдом растворе.
Например:
CO (г) + Н2O (г) CO2 (г) + H2 (г) ,
CH3COOH (ж) + C2H5OH (ж) CH3COOC2H5 (ж) + H2O (ж) .
Гетерогенными называются реакции, протекающие на границе раздела двух фаз: твёрдое тело – жидкость, твёрдое тело – газ, твёрдое тело – твёрдое тело, жидкость – жидкость.
Например:
CaO (т) + CO2 (г) CaCO3 (г) ,
C (т) + O2 (г) CO2 (г) .
Рассмотрим обратимую гомогенную реакцию:
aA + bB dD + eE,
протекающую между веществами в изобарно-изотермических условиях (Р = const и Т = const).
Согласно закону действия масс скорости прямой (V1) и обратной (V2) реакции определяются уравнениями:
V1 = k1 CaA CbB,
V2 = k2 CdD CeE,
где k1 и k2 – константы скорости прямой и обратной реакций; CA , CB, CD , CЕ – равновесные концентрации участников реакции; a, b, e, d – стехиометрические коэффициенты; A, B, E, D – участники реакции.
В состоянии равновесия скорости прямой и обратной реакций одинаковы:
V1 = V2.
Имея равенство левых частей уравнения, приравниваем их правые части:
k1 CaA CbB = k2 CdD CeE.
Разносим в разные стороны константы скорости реакций и равновесные концентрации и получаем:
 .
.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Константа химического равновесия показывает во сколько раз скорость прямой реакции больше скорости обратной реакции:
Кравн
=
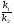 .
.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех участников реакции связаны между собой. Изменение концентрации любого из них вызывает изменение концентраций всех остальных; в результате устанавливаются другие концентрации, но константа равновесия данной химической реакции остаётся величиной неизменной.
Таким образом константа равновесия – это постоянная величина, равная отношению произведений равновесных концентраций конечных и исходных участников реакции, взятых в степенях, соответствующих стехиометрическим коэффициентам.
