
- •Дисциплина: Аналитическая химия и фхма
- •1. Основы качественного анализа. Аналитические реакции, их чувствительность и специфичность. Аналитическая классификация катионов и анионов. Дробный и систематический анализ.
- •2. Электролитическая диссоциация. Слабые и сильные электролиты. Константа диссоциации. Состояние сильных электролитов в растворе. Активность, коэффициент активности. Ионная сила раствора.
- •3. Ионное произведение воды, водородный показатель (рН). Расчет рН и рОн в растворах сильных и слабых кислот и оснований.
- •4.Равновесие в гетерогенной системе “осадок - раствор”. Произведение растворимости. Факторы, влияющие на растворимость осадков.
- •5.Равновесие в буферных растворах. Сущность буферного действия. Расчет рН буферных растворов. Буферная емкость.
- •6. Сущность и методы гравиметрического анализа. Свойства осадков механизм их образования и условия осаждения аморфных и кристаллических осадков.
- •7.Соосаждение, его виды. Факторы, влияющие на соосаждение. Очистка осадков от примесей. Осаждаемая и весовая форма, требования к ним.
- •1. Взаимодействующие вещества должны реагировать строго в стехиометрических соотношениях без каких-либо побочных реакций.
- •3. Реакция должна протекать быстро, чтобы в любой момент титрования равновесие устанавливалось практически мгновенно. Иногда для ускорения реакции растворы нагревают или вводят в них катализаторы.
- •I) по характеру реакции протекающие при титрования или по названию титранта
- •II) По способу выполнения различают прямое, обратное титрование и титрование заместителя (метод замещения, косвенное титрование).
- •10. Комплексонометрия: сущность метода, общая характеристика, область применения. Металл – индикаторы, механизм их действия.
- •12. Перманганатометрия: сущность метода, общая характеристика, область применения.
- •13.Йодометрия: сущность метода, общая характеристика, область применения. Условия проведения йодометрических определений.
- •14. Хроматометрия: сущность метода, общая характеристика, достоинства и недостатки. Применения хроматометрии для определения железа в рудах и сплавах.
5.Равновесие в буферных растворах. Сущность буферного действия. Расчет рН буферных растворов. Буферная емкость.
Если к воде или водным растворам сильных кислот и оснований и многих солей добавить небольшое количество сильной кислоты или сильного основания рН раствора сильно изменится.
Если к 1 литру воды (рН=7) прибавить 0,001 моль р-ра HCl (С HCl=10-3 моль/л), то рН раствора станет равное 3 (рН=3).
Во многих случаях при проведении анализа необходимо поддерживать рН на определенном уровне, для этого используют буферные растворы, в которых при добавлении небольшого количества сильной кислоты или сильного основания рН изменяется не значительно.
Буферные растворы регулируют концентрацию ионов Н+ и ОН- уменьшая влияние различных факторов изменения рН.
Как правило, буферные растворы состоят из слабой кислоты и ее соли (СН3СООН+СН3СООNa–ацетатный кислотный буферный раствор) или слабого основания и его соли (NH3·H2O+NH4Cl–аммиачный (аммонийный) щелочной раствор).
Расчет рН в буферных растворах
1) для кислотного буферного р-ра
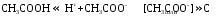

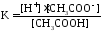
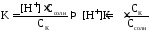
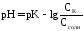
Если
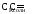 ,
тогдаpH=pK
,
тогдаpH=pK
2) для щелочного буферного р-ра
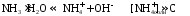
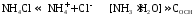
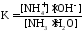

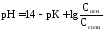
Если
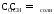 ,
тогдаpH=14-pK
,
тогдаpH=14-pK
Сущность буферного действия
При добавлении к буферному раствору небольшого количества сильной кислоты или щелочи, один из компонентов буферного раствора взаимодействует с добавленным реагентом, при этом концентрации компонентов изменяются, но их отношение, а особенно логарифм этого отношения изменяется незначительно.
Пример. Как изменяется рН ацетатного буферного раствора, содержащего по 1 моль/л каждого из компонентов:
а) при добавлении 0,1моль/л НСl;
б) при добавлении 0,1 моль/л NaOH.
Ск-ты=1моль/л, Ссоли=1 моль/л, С NaOH=0,1 моль/л, СHCl=0,1 моль/л, КК=1,8*10-5.
Рассчитаем рН исходного буферного р-ра:
рН=рК=-lg 1,8·10-5=4,75.
CH3COONa+HCl CH3COOH
+ NaCl.
CH3COOH
+ NaCl.
Концентрация соли уменьшается, концентрация кислоты увеличивается на столько, на сколько добавлено реагентов
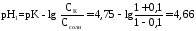
 .
.
CH3COOH+NaOH
 CH3COONa+H2O
CH3COONa+H2O
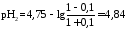
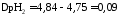
Буферная емкость
Способность буферного раствора поддерживать рН количественно характеризуется буферной емкостью (π).
π – это количество сильной кислоты или основания, которое следует добавить к 1 литру буферного раствора, чтобы его рН изменился на 1.
Буферная емкость зависит от качественного состава буферного раствора и от концентрации компонентов.
Чем больше концентрация, тем выше буферная емкость.
При прочих равных условиях максимальной буферной емкостью обладают растворы с одинаковой концентрацией компонентов.
 ;
;
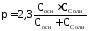
Наиболее часто в химическом анализе применяются следующие буферные растворы (рН приведено для одинаковой концентрации компонентов):
|
ацетатный |
СН3СООН + СН3СООNa |
рН = 4,75 |
|
аммиачный |
NH3·Н2О + NH4Cl |
рН = 9,25 |
|
формиатный |
НСООН + НСООNa |
рН = 3,75 |
|
корбанатный |
Na2CO3 + NaHCO3 |
рН = 10,32 |
|
фосфатный |
Na2HPO4 + NaH2PO4 |
рН = 6,6 |
Буферными являются растворы некоторых индивидуальных солей: Na2B4O7, (NH4)2CO3, (NH4)2S, т.к. эти соли обладают высокой степенью гидролиза и в их растворах образуются компоненты необходимые для осуществления буферного действия.
