
- •Водородная связь.
- •Химические свойства.
- •Хим. Свойства
- •Химические свойства магния.
- •Физические свойства кальция
- •Биологическая роль магния
- •Химические свойства кальция
- •Биологическая роль кальция
- •10В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10в в составе борной кислоты применяется в атомных реакторах для регулирования реактивности.
- •Химические свойства
- •Химические свойства:
№1.
1) Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга(1897), А. Ван-ден-Брука (1911), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.).
2) В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
3) Периодическая система элементов оказала большое влияние на последующее развитие химии. Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований.
Свободные места остались в таблице, потому что Менделеев был не только убежден, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы.
Точно так же периодическая система дала толчок к исправлению атомных масс некоторых элементов.
Именно на его основе были искусственно созданы трансурановые элементы.
Последующее развитие науки позволило, опираясь на периодический закон, гораздо глубже познать строение вещества,
Блестящее подтверждение нашли пророческие слова Менделеева:"Периодическому закону не грозит разрушение, а обещаются только надстройка и развитие".
№2
1) Эквивалент (Э) – это реальная ли условная частица вещества, которая может присоединять, замещать, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
При определении эквивалента вещества необходимо исходить из конкретной реакции.
2) закон Эквивалентов:
число эквивалентов участников процесса есть постоянная величина.
m1Э2=m2Э1
3) Эквивалентом окислителя (восстановителя) называется такое его количество, которое восстанавливаясь (окисляясь), присоединяет (высвобождает) 1 моль электронов.
№3
1) Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.
Термодинамика – наука о макросистемах.
Сейчас термодинамика описывает энергетические состояния и их изменения в системах, состоящих из огромного числа элементов (тела состоят из атомов!), находящихся в состоянии внутреннего равновесия. В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям.
В ней рассматриваются главным образом:
1) тепловые балансы процессов, включая тепловые эффекты физических и химических процессов;
2) фазовые равновесия для индивидуальных веществ и смесей;
3) химическое равновесие.
Тепловые балансы составляют на основе первого закона термодинамики. На основе второго и третьего законов проводят анализ фазового и химического равновесий.
2) Термодинамическая система – это ограниченная область пространства, занятая ее элементами. Термодинамич. система разделяется по агрегатному состоянию на гомогенные и гетерогенные системы.
Гомогенная система – система, в которой все макроскопические свойства в любых ее частях имеют одно и то же значение или непрерывно меняются от точки к точке. Примеры: ненасыщенные растворы, пар, газовые смеси.
Гетерогенная система – система, составные части которой отделены друг от друга видимыми поверхностями раздела, на которых происходят резкие скачкообразные изменения какого-либо свойства. Примеры: насыщенный раствор какой-либо соли, находящийся в равновесии с кристаллами этой соли, две несмешивающиеся жидкости и т. д.).
Совокупность тел, энергетически взаимодействующих между собой и с другими телами, обменивающихся с ними веществом, называется термодинамической системой.
Системы делят на:
- изолированные (это те системы, которые не обмениваются энергией и веществом с другими системами),
- открытые (те системы, которые обмениваются с окружающей средой и веществом, и энергией),
-закрытые (системы, в которых есть только обмен энергией).
№4
-
Тепловой эффект реакции, теплота, выделенная или поглощенная термодинамической системой при протекании в ней химической реакции. Закон Гесса – тепловой эффект химической реакции не зависит от пути реакции, а зависит только от начального и конечного состояния системы.
![]()
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Практически важны два типа теплового эффекта реакции:
- изотермо-изобарный (при постоянных температуре Т и давлении р)
-изотермо-изохорный (при постоянных Т и объеме V).
Различают дифференциальный и интегральный тепловой эффект реакции.
Размерность дифференциального теплового эффекта реакции - кДж/моль. Если uT,V, hT,p > 0, реакция называется эндотермической, при обратном знаке эффекта - экзотермической.
Интегральный тепловой эффект реакции в расчете на один пробег реакции (изменение числа молей вещества равно его стехиометрическому коэффициенту) измеряется в кДж
2) Энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
Изменение энтальпии (или Тепловой эффект химической реакции) не зависит от пути процесса, определяясь только начальным и конечным состоянием системы.
№5
Энтропия – это мера вероятности данного состояния, т.е. числа способов которыми это состояние может реализоваться. Энтропия возрастает вместе со сложн. хар-ра с помощью которого образуется макросостояние.
2-е нач. термодинамики:
При любых сомопроизв. протек. процессов в изолированных системахее энтропия не может убывать, для обратимых процессов ΔS=0
3-е начало термодинамики:
При абсолютном 0 градусов по цельсию энтропия кристалла имеющую полностью упорядоченную систему, равна 0 при любых значениях
Дж/моль*к
№6
Для того чтобы судить о возможности самопроизвольного протекания реакции, следует учитывать два фактора- энергию и энтропию(Все материальные системы обнаруживают тенденцию к достижению максимального беспорядка).
В химических системах при протекании реакции в условиях постоянного давления изменение энергии определяется изменением энтальпии. В экзотермических реакциях система теряет энергию до тех пор, пока полная энтальпия системы не достигнет минимума.
![]()
Характер
изменения энергии Гиббса позволяет
судить о принципиальной возможности
осуществления процесса. При ![]() процесс
может протекать, при
процесс
может протекать, при ![]() процесс
протекать не может. Если же
процесс
протекать не может. Если же ![]() ,
то система находится в состоянии химического
равновесия.
,
то система находится в состоянии химического
равновесия.
ΔG=∑ ΔG(прод. реакции) - ∑ ΔG (исходных веществ)
При постоянном давлении и температуры самопроиз. протекание реакции сопровождается уменьшением энергии Гиббса.
№7
Электроны в атоме не имеют траекторий движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. Орбиталь (s, p, d, f) – часть атомного пространства, в котором вероятность нахождения данного электрона наибольшая (~ 90%).
Электроны вокруг ядра образуют слои. Они называются квантовыми слоями или энергетическими уровнями. Энергетический уровень – это энергетический слой с определённым уровнем энергии находящихся на нём электронов. Энергетический уровень объединяет все электроны с одинаковым значением главного квантового числа.
Номер слоя, в котором находится электрон, равен его главному квантовому числу.
Наибольшее число электронов на энергетическом уровне определяется по формуле N = 2n2, где N — максимальное число электронов; n — номер уровня или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов-, • на втором — не более 8; • на третьем — не более 18; • на четвертом — не более 32.
№8
Принцип Паули: Согласно этому принципу (запрету), в атоме не может быть двух электронов с одинаковыми наборами значений квантовых чисел n, l, ml, ms. На любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют антипараллельные спины.
Правило Хунда (Гунда). В каждом квантовом слое одноимённые орбитали (орбитали одного подуровня) вначале заполняются однократно электронами с параллельными спинами, с тем, чтобы суммарный спин атома был максимальным; лишь после этого начинается спаривание электронов.
Наличие у электронов собственного механического момента, связанного с его вращением вокруг собственной оси, получило название спина
В повышении энергии атомных орбиталей имеется закономерность, которая определяется с помощью правила Клечковского: ниже по энергии находится та орбиталь, для которой сумма значений главного и орбитального квантовых чисел (n+l) минимальна. Например, орбиталь 4s, для которой n+l = 4+0 = 4, заполняется раньше, чем 3d, где сумма n+l = 3+2 = 5. При равенстве сумм ниже по энергии находится орбиталь с меньшим значением главного кантового числа. Так, орбиталь 3d имеет более низкую энергию, чем 4р.
Обычный порядок заполнения атомных орбиталей имеет следующий вид:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f =5d < 6p < 7s < 5f=6d
Если представить размещение электронов по слоям, то становится понятным, что в первом слое поместится меньше электронов чем в других слоях.
Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов-, • на втором — не более 8; • на третьем — не более 18; • на четвертом — не более 32.
Первый электронный слой включает только один подуровень, тогда как второй состоит из двух. На третьем электронном слое три подуровня, а на четвертом – четыре(s, p, d, f).
Каждый подуровень, в свою очередь состоит из орбиталей. На каждой из орбиталей, независимо от того, к какому электронному слою она принадлежит может находиться только по два электрона.
№9
Ионная связь.
Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na 2 SO 4 ) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).
Ковалентная неполярная связь.
При взаимодействии атомов с одинаковой электроотрица-тельностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H 2 , F 2 , Cl 2 , O 2 , N 2 . Химические связи в этих газах образованы посредством общих электронных пар, т.е. при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодей-ствием, которые осуществляет при сближении атомов.
Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков.
Ковалентная полярная связь.
При взаимодействии атомов, значение электроотрецательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония и амония.
Металлическая связь.
Связь, которая образуется в результате взаимодействия относите-льно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ- металлов.
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свобо-дные электроны, оторвавшиеся от атома, перемещаются между положи-тельными ионами металлов. Между ними возникает металлическая связь, т. е. Электроны как бы цементируют положительные ионы кристал-лической решетки металлов.
Водородная связь.
Связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента(O, N, F) другой молекулы, называется водородной связью.
Может возникнуть вопрос: почему именно водород образует такую специфическую химическую связь?
Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород приобретает сравнительно высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, выходящий в состав других молекул (HF, H 2 O, NH 3 ).
Рассмотрим некоторые примеры. Обычно мы изображаем состав воды химической формулой H 2 O. Однако это не совсем точно. Правильнее было бы состав воды обозначать формулой (H 2 O)n, где n = 2,3,4 и т. д. Это объясняется тем, что отдельные молекулы воды связаны между собой посредством водородных связей.
Водородную связь принято обозначать точками. Она гораздо более слабая, чем ионная или ковалентная связь, но более сильная, чем обычное межмолекулярное взаимодействие.
Наличие водородных связей объясняет увеличения объема воды при понижении температуры. Это связано с тем, что при понижении температуры происходит укрепление молекул и поэтому уменьшается плотность их “упаковки”.
При изучении органической химии возникал и такой вопрос: почему температуры кипения спиртов гораздо выше, чем соответствующих углеводородов? Объясняется это тем, что между молекулами спиртов тоже образуются водородные связи.
Повышение температуры кипения спиртов происходит также всле-дствие укрупнения их молекул.
Водородная связь характерна и для многих других органических соединений (фенолов, карбоновых кислот и др.). Из курсов органической химии и общей биологии вам известно, что наличием водородной связи объясняется вторичная структура белков, строение двойной спирали ДНК, т. е. явление комплиментарности.
№10
Мерой полярности связи является ее дипольный момент μ :
μ = е l,
где е – заряд электрона, l – расстояние между центрами положительного и отрицательного зарядов.
Дипольный момент – это векторная величина. Понятия «дипольный момент связи» и «дипольный момент молекулы» совпадают только для двухатомных молекул. Дипольный момент молекулы равен векторной сумме дипольных моментов всех связей. Таким образом, дипольный момент многоатомной молекулы зависит от ее строения.
В линейной молекуле СО2, например, каждая из связей С–О полярна. Однако молекула СО2 в целом неполярна, так как дипольные моменты связей компенсируют друг друга. Дипольный момент молекулы углекислого газа m = 0.
Важнейшая область применения данных о дипольных моментах молекул - структурные исследования, установление конформации молекул, конформационного и изомерного состава вещества, его зависимости от температуры. Величины дипольного момента молекул позволяют судить о распределении электронной плотности в молекулах и зависимости этого распределения от характера отдельных заместителей. По наличию или отсутствию дипольного момента молекулы можно в отдельных случаях выбрать для нее ту или иную структуру без каких-либо теоретических расчетов.
Эффективный заряд атома, характеризует разность между числом электронов, принадлежащих данному атому в хим. соединении, и числом электронов свободного атома. Для оценок эффективного заряда атома используют модели, в которых экспериментально определяемые величины представляют как ф-ции точечных неполяризуемых зарядов, локализованных на атомах; например, дипольный момент двухатомной молекулы рассматривают как произведение эффективного заряда атома на межатомное расстояние. В рамках подобных моделей эффективный заряд атома можно рассчитать, используя данные оптич. или рентгеновской спектроскопии, ЯМР и др. Однако, поскольку электронная плотность в химических соединениях делокализована и границ между атомами не существует, нельзя описать различные характеристики соединений одним набором эффективного заряда атома; значения этого показателя, определенные разными эксперим. методами, могут не совпадать. Эффективный заряд атома можно определить также на основе квантово-химических расчетов.
Эффективные заряды атома, определенные в рамках к.-л. одной модели или в однотипных расчетах, используют для корреляции с различными физ.-хим. характеристиками соединения, установления реакционных центров в молекулах, оценки степени ионности химической связи.
Важнейшими свойствами ковалентной связи является ее насыщаемость и направленность. Насыщаемость можно определить как способность атомов образовывать ограниченное число ковалентных связей. Так атом углерода может образовывать только четыре ковалентных связи, а атом кислорода – две. Максимальное число обычных ковалентных связей, которые может образовывать атом (без учета связей, образованных по донорно-акцепторному механизму) равно числу неспаренных электронов.
Ковалентные связи имеют пространственную направленность, поскольку перекрывание орбиталей при образовании одинарной связи происходит по линии, связывающей ядра атомов. Пространственное расположение электронных орбиталей молекулы обуславливают ее геометрию. Углы между химическими связями называют валентными углами.
Насыщаемость и направленность ковалентной связи отличает эту связь от ионной, которая в отличие от ковалентной связи является ненасыщенной и ненаправленной.
Длина связи – это расстояние между ядрами атомов, образующими эту связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
 .
.
Сверху вниз по подгруппам периодической системы элементов длина химической связи возрастает, поскольку в этом направлении увеличивается радиусы атомов (табл. 5.1). С увеличением кратности связи ее длина уменьшается.
Мерой прочности связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга. Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Для молекулы IСl3, например, Есвязи ≈40 , а для молекул N2 и CO Есвязи ≈1000 кДж/моль.
Сверху вниз по подгруппам периодической системы элементов энергия химической связи уменьшается, поскольку в этом направлении увеличивается длина связи. С увеличением кратности связи ее энергия возрастает.
№11
Комплексные соединения – это вещества определенного состава, состоящие из более простых, способных к самостоятельному существованию соединений. Комплексные соединения существуют как в твердом состоянии, так и в растворе, причем их образование не связано с возникновением новых электронных пар.
Координационная теория комплексных соединений создана Альфредом Вернером (1839). Последователем Вернера был Лев Чугаев.
Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение.
Комплексная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Лиганды (Адденты) — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью, бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три- , тетрадентатные и т. д.
Координационный полиэдр — воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах — частицы лигандов, непосредственно связанные с центральным атомом.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
№12
Как химические вещества комплексные соединения делятся на ионные (их иногда называют ионогенными) и молекулярные (неионогенные) соединения. Ионные комплексные соединения содержат заряженные комплексные частицы – ионы – и являются кислотами, основаниями или солями (см. § 1). Молекулярные комплексные соединения состоят из незаряженных комплексных частиц (молекул), например: [Fe(CO)5] или [Cr(C6H6)2] – отнесение их к какому-либо основному классу химических веществ затруднительно.
Входящие в состав комплексных соединений комплексные частицы довольно разнообразны. Поэтому для их классификации используется несколько классификационных признаков: число центральных атомов, тип лиганда, координационное число и другие.
По числу центральных атомов комплексные частицы делятся на одноядерные и многоядерные. Центральные атомы многоядерных комплексных частиц могут быть связаны между собой либо непосредственно, либо через лиганды. И в том, и в другом случае центральные атомы с лигандами образуют единую внутреннюю сферу комплексного соединения:
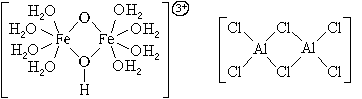
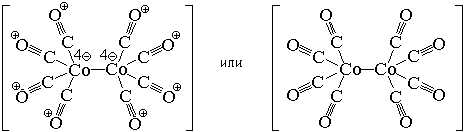
По типу лигандов комплексные частицы делятся на
1) Аквакомплексы,
то есть комплексные частицы, в которых
в качестве лигандов присутствуют
молекулы воды. Более или менее устойчивы
катионные аквакомплексы [M(H2O)n]m![]() ,
анионные аквакомплексы неустойчивы.
Все кристаллогидраты относятся к
соединениям, содержащим аквакомплексы,
например:
,
анионные аквакомплексы неустойчивы.
Все кристаллогидраты относятся к
соединениям, содержащим аквакомплексы,
например:
Mg(ClO4)2.6H2O на самом деле [Mg(H2O)6](ClO4)2;
2) Гидроксокомплексы,
то есть комплексные частицы, в которых
в качестве лигандов присутствуют
гидроксильные группы, которые до
вхождения в состав комплексной частицы
были гидроксид-ионами, например:
[Zn(OH)4]2![]() ,
[Cr(OH)6]3
,
[Cr(OH)6]3![]() ,
[Pb(OH)3]
,
[Pb(OH)3]![]() .
.
Гидроксокомплексы образуются из аквакомплексов, проявляющих свойства катионных кислот:
[Zn(H2O)4]2![]() +
4OH
+
4OH![]() =
[Zn(OH)4]2
=
[Zn(OH)4]2![]() +
4H2O
+
4H2O
3) Аммиакаты,
то есть комплексные частицы, в которых
в качестве лигандов присутствуют группы
NH3 (до образования комплексной частицы
– молекулы аммиака), например: [Cu(NH3)4]2![]() ,
[Ag(NH3)2]
,
[Ag(NH3)2]![]() ,
[Co(NH3)6]3
,
[Co(NH3)6]3![]() .
.
Аммиакаты также могут быть получены из аквакомплексов, например:
[Cu(H2O)4]2![]() +
4NH3 = [Cu(NH3)4]2
+
4NH3 = [Cu(NH3)4]2![]() +
4 H2O
+
4 H2O
Окраска раствора в этом случае меняется с голубой до ультрамариновой.
4) Ацидокомплексы,
то есть комплексные частицы, в которых
в качестве лигандов присутствуют
кислотные остатки как бескислородных,
так и кислородсодержащих кислот (до
образования комплексной частицы –
анионы, например: Cl![]() ,
Br
,
Br![]() ,
I
,
I![]() ,
CN
,
CN![]() ,
S2
,
S2![]() ,
NO2
,
NO2![]() ,
S2O32
,
S2O32![]() ,
CO32
,
CO32![]() ,
C2O42
,
C2O42![]() и
т. п.).
и
т. п.).
Примеры образования ацидокомплексов:
Hg2![]() +
4I
+
4I![]() =
[HgI4]2
=
[HgI4]2![]()
5) Комплексы, в которых лигандами являются атомы водорода, делятся на две совершенно разные группы: гидридные комплексы и комплексы, входящие в состав ониевых соединений.
При
образовании гидридных комплексов –
[BH4]![]() ,
[AlH4]
,
[AlH4]![]() ,
[GaH4]
,
[GaH4]![]() –
центральный атом является акцептором
электронов, а донором – гидридный ион.
Степень окисления атомов водорода в
этих комплексах равна –1.
–
центральный атом является акцептором
электронов, а донором – гидридный ион.
Степень окисления атомов водорода в
этих комплексах равна –1.
В
ониевых комплексах центральный атом
является донором электронов, а акцептором
– атом водорода в степени окисления
+1. Примеры: H3O![]() или
[OH3]
или
[OH3]![]() –
ион оксония, NH4
–
ион оксония, NH4![]() или
[NH4]
или
[NH4]![]() –
ион аммония. Кроме того существуют и
замещенные производные таких ионов:
[N(CH3)4]
–
ион аммония. Кроме того существуют и
замещенные производные таких ионов:
[N(CH3)4]![]() –
ион тетраметиламмония, [As(C6H5)4]
–
ион тетраметиламмония, [As(C6H5)4]![]() –
ион тетрафениларсония, [OH(C2H5)2]
–
ион тетрафениларсония, [OH(C2H5)2]![]() –
ион диэтилоксония и т. п.
–
ион диэтилоксония и т. п.
6) Карбонильные комплексы – комплексы, в которых в качестве лигандов присутствуют группы CO (до образования комплекса – молекулы монооксида углерода), например: [Cr(CO)6], [Fe(CO)5], [Ni(CO)4] и др.
7) Анионгалогенатные комплексы
– комплексы типа [I(I)2]![]() .
.
№13
Водные растворы образуются в тех случаях, когда суммарная энергия взаимодействия между молекулами воды и молекулами (в случае молекулярных растворов) или ионами (в случае ионных растворов) растворенного вещества больше, чем сумма энергий взаимодействия молекул воды между собой и молекул (ионов) рассматриваемого вещества между собой. Под энергией взаимодействия имеется в виду энергия Гиббса. (G=H-T*S).
-
Гетерогенные растворы полностью не смешаны, так как чистые вещества существуют в ясно отграниченных фазах, то есть это многофазные материалы. Например сост. из жидкости(насыщенный раствор) и осадка(твердое вещ-во).
-
Гомогенные растворы — это на молекулярном уровне смешанные чистые вещества, то есть однофазные материалы. Растворы солей, кислот, оснований и др. вещ-в
№ 14
Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, но сейчас он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей и молекулой и между двумя частицами.
Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых электромагнитных взаимодействий:
Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служитьHCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Ион-дипольное взаимодействие — взаимодействие между ионом и молекулой с постоянным или наведенным дипольным моментом.
Ион-дипольное взаимодействие, так же как и ван-дер-ваальсово (диполь-дипольное), относится к слабым, нековалентным связям. Оно обусловлено взаимодействием между ионами и полярными группами молекул (либо флуктуацими их электронной плотности). Энергия ион-дипольной связи составляет 50-200 кДж/моль.
Можно выделить два основных типа ион-дипольных взаимодействий.
1. Ориентационное взаимодействие (ион-постоянный диполь). Потенциал ион-дипольного взаимодействия (U) анизотропен, то есть зависит от ориентации постоянного диполя, но для любой фиксированной ориентации обратно пропорционален квадрату расстояния (r) и прямо пропорционален заряду иона и дипольному моменту молекулы (p):
![]()
При квазисвободном вращении диполя, например — в жидкостях (здесь и далее — при энергии теплового вращения, существенно превосходящей электростатическую) он оказывается обратно пропорционален четвёртой степени расстояния и температуре (T) и прямо пропорционален квадратам заряда и дипольного момента:
![]()
2. Индукционное взаимодействие (ион-наведенный диполь). Наведенный (индукционный) дипольный момент, возникающий вследствие поляризации молекулы внешним полем, в данном случае — полем иона, имеет постоянную ориентацию относительно иона. Он пропорционален заряду иона и поляризуемости молекулы и обратно пропорционален квадрату расстояния, что приводит к потенциалу взаимодействия, обратно пропорциональному, как и в случае постоянного дипольного момента, четвёртой степени расстояния и прямо пропорциональному квадрату заряда и поляризуемости молекулы:
![]()
Как и в случае других межмолекулярных взаимодействий, возможно взаимодействие заряда иона с высшими мультипольными моментами, однако оно, как правило, слабее и обратно пропорционально более высоким степеням расстояния, то есть гораздо более близкодействующее
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, Oили F. Водородные связи могут быть межмолекулярными или внутримолекулярными. Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры). Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
№15
1. Массовая доля – отношение (обычно процентное) массы растворенного вещества к массе раствора. Например, 15% (масс.) водный раствор NaCl на 100 единиц массы содержит 15 единиц массы NaCl и 85 единиц массы Н2О.
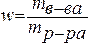 .
.
2. Мольная доля – отношение химического количества растворенного вещества (или растворителя) к сумме химических количеств всех веществ, составляющих раствор. В случае раствора одного вещества в другом мольная доля растворенного вещества (N2) равна
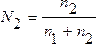 ,
,
а мольная доля растворителя (N1)
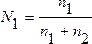 ,
,
где n1 и n2 – соответственно количество растворителя и растворенного вещества.
3. Молярная концентрация (молярность) – отношение химического количества растворенного вещества к объему раствора. Обычно молярность обозначается См или (после численного значения молярности) М. Так, 2 М Н2SO4 означает раствор, в каждом литре которого содержится два моля серной кислоты, то есть См = 2 моль/дм3.
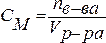 .
.
4. Моляльность (моляльная концентрация) – отношение химического количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m. Так, для раствора H2SO4 запись m=2 моль/кг (Н2О) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится два моля Н2SO4. Моляльность раствора в отличие от молярности не изменяется при изменении температуры.
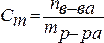 .
.
5. Нормальность (нормальная или эквивалентная концентрация) – отношение числа эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим способом, обозначается Сn или (после численного значения нормальности) буквой н. Так, 2 н. Н2SO4 означает раствор, в каждом литре которого содержится 2 эквивалента Н2SO4, то есть 98 г Н2SO4.
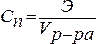 .
.
Эквивалент кислоты – это её количество, содержащее один эквивалент водорода, способного замещаться металлом.
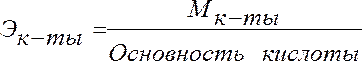
Эквивалент основания – это его количество, которые реагирует с эквивалентами кислот.
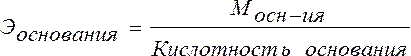
Эквивалент соли может быть вычислен как частное от деления ее молярной массы на произведение числа ионов металла и его валентности:
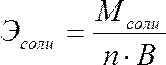
Пользуясь растворами, состав которых выражен нормальностью, легко рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 раствора вещества 1 с нормальностью N1 реагирует с V2 раствора вещества 2 с нормальностью N2. Это означает, что в реакцию вступило N1V1 эквивалентов вещества 1 и N2V2 эквивалентов вещества 2. Но вещества реагируют в эквивалентных количествах, следовательно
N1V1 = N2V2 и

Т.е. объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
№16
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
Процесс распада молекул в растворе или расплаве электролита на ионы называется электролитической диссоциацией. Одновременно, в электролите протекают процессы ассоциации ионов в молекулы. При неизменных внешних условиях (температура, концентрация и др.) устанавливается динамическое равновесие между распадами и ассоциациями. Поэтому, в электролитах диссоциирована определённая доля молекул вещества. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации.
Свойства растворов электролитов представляется естественным разделить на две группы:
1) свойства, определяемые путем изучения равновесных систем, К первой группе принадлежат те свойства, которые могут быть найдены в результате определений понижения давления пара, повышения температуры кипения, понижения температуры замерзания, растворимости, теплоемкости, теплосодержания, потенциалов гальванических элементов и поверхностного натяжения.
2) свойства, определяемые путем изучения систем, находящихся в неравновесных состояниях. Ко второй группе относятся те свойства, которые могут быть найдены путем определений диффузии, электропроводности if вязкости.
Многие свойства растворов электролитов являются аддитивными функциями свойств соответствующих ионов. Об этом свидетельствует, например, тот факт, что химические свойства раствора соли совпадают со свойствами ионов, из которых она состоит. Так, раствор хлористого калия не обнаруживает химических реакций, характерных для самого соединения, а обнаруживает лишь реакции, типичные для ионов калия и хлора. Эти свойства в равной мере присущи почти всем солям калия и хлоридам. Точно так же характерные химические свойства кислот и оснований в водных растворах являются свойствами ионов водорода и гидроксила. Некоторые физические свойства электролитов также аддитивны; наиболее ярким примером служит электропроводность при бесконечном разбавлении.
Многие свойства растворов электролитов определяются взаимодействием ионов. Так как при этом не требуется разрушения связей в молекулах сложных веществ, то реакция между ионами должна протекать легче, чем между молекулами. Направление процессов определяется энергетическими изменениями. Процесс самопроизвольно идет только в том случае, когда в системе уменьшается свободная энергия. Например, к понижению свободной энергии приводит образование слабодиссоциирующих веществ. Таким образом, реакции в растворах электролитов будут всегда направлены в сторону образования наиболее слабого электролита, в форме которого удаляется часть ионов.
Отличие свойств растворов электролитов от идеальных систем обусловливается не только взаимодействием ионов между собой, но и их взаимодействием с молекулами растворителя.
№17
Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).
Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
гидролиз по катиону (в реакцию с водой вступает только катион; Гидролиз по катиону приводит к образованию гидроксокатионов и ионов водорода (среда раствора кислая);
гидролиз по аниону (в реакцию с водой вступает только анион Гидролиз по аниону приводит к образованию гидроанионов и гидроксид-ионов (среда раствора щелочная);
совместный гидролиз (в реакцию с водой вступает и катион, и анион, в этом случае в растворе протекают две выше рассмотренные реакции.);
Полный гидролиз. Для полного протекания гидролиза нужно, чтобы соль была образована очень слабой кислотой и очень слабым основанием. Кроме того, желательно, чтобы один из продуктов гидролиза, уходил из сферы реакции в виде газа. (Малорастворимые вещества, остающиеся в контакте с раствором, вообще говоря, не уходят из сферы реакции, поскольку все равно, сколько то растворимы.) Поэтому полному гидролизу подвергаются обычно соли газообразных или неустойчивых кислот: сероводородной, угольной, отчасти сернистой. К ним примыкают вещества, которые в обычном понимании уже не являются солями: нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизуются также алкоголяты.
Если вернуться к обычным солям, то полностью гидролизующиеся соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)) нельзя получить реакциями обмена в водных растворах. Вместо ожидаемых продуктов в результате реакции мы получим продукты гидролиза. Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основной карбонат меди (CuOH)2CO3.
№18
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ,
наличие катализатора,
температура (правило Вант-Гоффа),
давление,
площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию, то мы заметим, что мгновенная скорость химической реакции величина непостоянная.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам.
При этом стехиометрические коэффициенты должны отражать механизм элементарных актов реакции.
№19
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза
Уравнение, которое описывает это правило, следующее:
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции .
—
температурный коэффициент реакции .
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400 oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
![]()
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошлареакция:
-
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
-
Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
-
Молекулы должны быть правильно ориентированы относительно друг друга.
При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.
Разность между средним энергетическим уровнем молекулы и энергетическим уровнем реакции называется энергией активации или энергетическим барьером. Чем больше энергия активации (энергетический барьер), тем медленнее идет реакция.
Средний энергетический уровень молекулы — это энергия, которой обладают большинство молекул системы в данный момент времени.
Энергетический уровень реакции — это запас энергии, которым должны обладать молекулы, чтобы их столкновение стало эффективным, чтобы произошла реакция. Этот запас энергии является постоянным для каждой данной реакции.
№20
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия(в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Для обратимой химической реакции константа равновесия может быть выражена через константы скорости прямых и обратных реакций, исходя из того факта, что в состоянии равновесия скорости прямой и обратной реакций равны.
Принцип Ле Шателье.
При постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных СТЕХИОМЕТРИЧЕСКИМ коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
К показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Как видно, константа равновесия есть отношение констант скорости прямой и обратной реакции.
Когда концентрации реагирующих веществ перестанут изменяться, то установится равновесие и V1= V2
Физический смысл константы равновесия: закон действующих масс:
«Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие».
(равновесие будет смещаться до тех пор, пока не установится новое равновесие, соответствующее данным условиям )
1.Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
2 NO(г) + Cl2(г) = 2 NOCl(г)
2.Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
3.Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции.
№21
К элементам главной подгруппы 1-ой группы Периодической системы относятся Li, Na, K, Rb, Cs, Fr. Их принято называть щелочными металлами. Эти металлы в своих рядах являются первыми, т.е. именно у них начинается заполнение электронами нового электронного слоя. Их валентную электронную конфигурацию можно в общем виде обозначить так: nS1 где п - номер периода, в котором находится металл. Щелочные металлы имеют серебристо-белый цвет, а цезий - золотисто-желтый. Хранят щелочные металлы под слоем керосина или бензола. Металлические К, РЬ, Сsсамопроизвольно загораются на воздухе. При комнатной температуре щелочные металлы находиться в твердом (кристаллическом) состоянии, хотя все они имеют очень невысокую температуру плавления. Первые три металла легче воды и плавают на ее поверхности, вступая в бурную реакцию.
Щелочные металлы самые активные из всех металлов. Поэтому иногда говорят, что атомы щелочных металлов стремятся отдавать свой валентный электрон, чтобы приобрести устойчивую электронную оболочку инертного газа.). При переходе от Li к Сs активность металла, т.е. способность к химическому взаимодействию - увеличивается. И уж совсем неожиданны данные о сродстве к электрону (СЭ) у атомов щелочных металлов: изолированные атомы щелочных металлов “с удовольствием”, т.е. с выделением энергии (СЭ) присоединяют к себе электрон.
Отсюда следует очень важный вывод, что поведение изолированных атомов щелочных металлов - это одно, а их поведение в молекулах, т.е. при взаимодействии с атомами других химических элементов - это качественно другая ситуация. В молекулах атомные орбитали преобразовываются в молекулярные орбитали, валентные электроны атомов в молекуле находятся в совместном пользовании или сильно смещаются к одному из атомов вплоть до образования ионной связи. Типичные степени окисления элементов ТА группы в различных соединениях +1. Таким образом, имеются две степени окисления у элементов 1-А группы: О - в молекулах Ме2 и в металлическом состоянии и +1 - в соединениях ( ярко выраженная ионная связь. Очень высокая химическая активность щелочных металлов обусловлена легко разрушаемой кристаллической структурой и малой плотностью.
Взаимодействие с простыми веществами.
Щелочные металлы взаимодействуют с кислородом. Все они легко окисляются кислородом воздуха, а рубидий и цезий даже самовоспламеняются.
Щелочные металлы самовоспламеняются во фторе, хлоре, парах брома, образуя галогениды: При нагревание взаимодействуют со многими неметаллами.
Взаимодействие с водой. Все щелочные металлы реагируют с водой, восстанавливая ее до водорода. Активность взаимодействия металлов с водой увеличивается от лития к цезию.
Взаимодействуют с кислотами. Щелочные металлы взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода.
Взаимодействие с оксидами металлов и солями. Щелочные металлы вследствие высокой химической активности могут восстанавливать многие металлы из их оксидов и солей.
Водоро́д — первый элемент периодической системы элементов; обозначается символом H. Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине.
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н —тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %[11]. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет[11]. Тритий содержится в природе в очень малых количествах. Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
В промышленности
Конверсия с водяным паром при 1000 °C:
Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
Электролиз водных растворов солей:
Каталитическое окисление кислородом:
Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
Взаимодействие кальция с водой:
Гидролиз гидридов:
Действие щелочей на цинк или алюминий:
С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
Физические свойства.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии.
Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода.
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм. Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и параводорода.\
