
- •С.А. Сергеева, в.Е. Рябинин Практикум по химии
- •Рекомендовано
- •Оглавление
- •Введение
- •Общие вопросы выполнения лабораторных работ
- •1.1. Правила работы в химической лаборатории
- •Правила оказания первой помощи пострадавшим в химической лаборатории
- •1.3. Правила ведения лабораторного журнала
- •Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
- •1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
- •2.Растворы (определение, классификация).
- •3.Титриметрический метод анализа (понятие и виды).
- •4. Метод кислотно-основного титрования (определение, основное уравнение).
- •1. Практическая часть
- •1.3. Контрольные вопросы и задачи
- •2. Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •I. Информационный раздел
- •Концентрация кодеина и морфина в моче у 3-х испытуемых
- •II. Аналитический раздел
- •Тема: Коллигативные свойства растворов неэлектролитов и электролитов
- •1. Вода как универсальный биологический растворитель.
- •2. Коллигативные свойства растворов (определение, виды).
- •1. Практическая часть
- •Суточный баланс воды в организме взрослого человека
- •Состав растворов Рингера –Локка и Тироде для теплокровных животных
- •II. Давление пара разбавленных растворов. Закон Рауля
- •2.1.Давление насыщенного пара растворителя
- •1.3. Контрольные задачи
- •2. Экспериментальная часть
- •Криоскопическим методом
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Протолитические равновесия и процессы. Водородный показатель. Гидролиз
- •1. Электролиты сильные и слабые.
- •3.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
- •1. Практическая часть
- •1.3. Контрольные вопросы
- •2. Экспериментальная часть
- •Реакция среды при гидролизе солей
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Буферные системы, классификация и механизм действия
- •1. Практическая часть
- •2. Экспериментальная часть
- •Ацетатного буферного раствора по кислоте и щелочи
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •5. Практические навыки, которыми должен овладеть студент по теме занятия.
- •Десятичные приставки к названиям единиц
- •Содержание газов в артериальной и венозной крови, л/1 л крови
- •Парциальное давление и напряжение газов, кПа (мм рт. Ст.)
- •Проверка ёмкости мерной посуды
- •Формулы перехода от одних выражений концентраций растворов к другим
- •Константы некоторых жидкостей, применяемых в качестве растворителей
- •Ионное произведение воды при температуре от до:
- •Константы диссоциации некоторых слабых электролитов в водных растворах при
- •Характеристика важнейших индикаторов
- •Средние значения водородного показателя (рН) биологических жидкостей
- •Расчет в растворах кислот и оснований
- •Состав смешанной слюны человека
- •Список литературы Основная литература
- •Дополнительная литература
Экспериментальные данные и результаты измерений
-
№

 (л)
(л)
 (л)
(л)
 (л)
(л)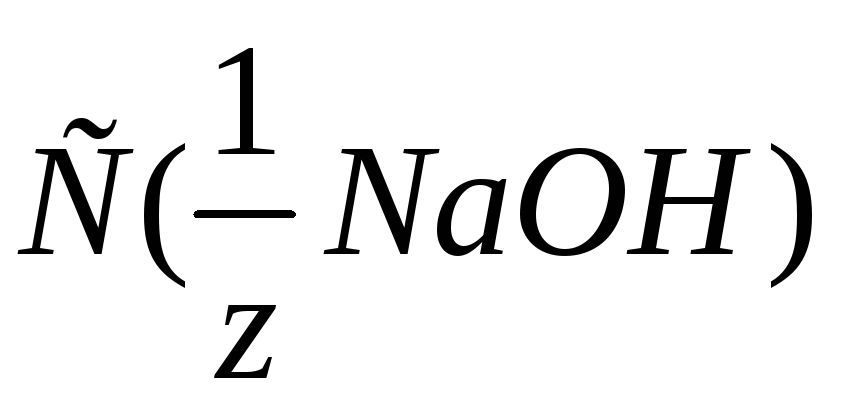
моль/л
1
2
3
Выводы.
Вывод в данной работе может быть
сформулирован так: 1) «Освоены правила
работы с мерной посудой, используемой
в титриметрическом анализе. 2) Методом
прямого титрования с использованием в
качестве первичного стандарта![]() установлена молярная концентрация
эквивалента титраната – раствора
установлена молярная концентрация
эквивалента титраната – раствора
![]() .
.![]() =………..
моль/л».
=………..
моль/л».
Примечание:
Стандартизированный
раствор
![]() может быть использован в свою очередь
как вторичный стандартный раствор для
определения количества соляной кислоты.
Но надо помнить, что гидроксид натрия
медленно реагирует со стеклом с
образованием силикатов, поэтому
раствор
может быть использован в свою очередь
как вторичный стандартный раствор для
определения количества соляной кислоты.
Но надо помнить, что гидроксид натрия
медленно реагирует со стеклом с
образованием силикатов, поэтому
раствор![]() нельзя
долго хранить в стеклянном сосуде.
нельзя
долго хранить в стеклянном сосуде.
Опыт №2. Определение массовой доли соляной кислоты в фармакопейном препарате (Acidum hydrochiloridum dilutum)
Цель работы. Опытным путем определить в % содержание соляной кислоты в фармакопейном препарате (ρ = 1,04 г/мл).
Принцип
метода. В
основе метода лежит кислотно-основное
титрование.
В качестве
титранта применяют стандартизированный
раствор
![]() (из опыта №1). Продуктами реакции между
сильной кислотой и сильным основанием
являются соль, не подвергающаяся
гидролизу и вода:
(из опыта №1). Продуктами реакции между
сильной кислотой и сильным основанием
являются соль, не подвергающаяся
гидролизу и вода:
![]() ,
,![]() .
В этом случае раствор в точке эквивалентности
имеет нейтральную реакцию, т.е.
.
В этом случае раствор в точке эквивалентности
имеет нейтральную реакцию, т.е.![]() ,
поэтому титрование проводят в присутствии
метилоранжа.
,
поэтому титрование проводят в присутствии
метилоранжа.
Ход работы:
5 мл раствора соляной кислоты (ρ = 1,04 г/мл) переносите в мерную колбу на 100 мл, объем доводите дистиллированной водой до метки и тщательно перемешивайте.
Отбирайте пипеткой по 5 аликвоты соляной кислоты в колбы для титрования, добавляйте 1-2 капли индикатора метилоранжа и титруйте, постоянно перемешивая стандартным раствором гидроксида натрия из бюретки до желтого окрашивания.
Из 3-х сходящихся результатов титрования рассчитайте процентное содержание соляной кислоты в анализируемом образце.
 ,
,
где:
а – навеска, а
 ;
; –объем препарата взятый для определения,
мл
–объем препарата взятый для определения,
млМ.м.(HCI)=36,46 г/моль;
V (пипетки) – объем аликвотной (точной) части разведения, взятый для титрования, мл.
Результаты внесите в таблицу №2.2.
Таблица 2.2
Экспериментальные данные и результаты измерений
-
№

 (л)
(л)
 (л)
(л)
 (л)
(л)
1
2
3
Выводы. Сделайте заключение о
процентном содержании![]() в
растворе, подлежит ли лекарственная
форма отпуску? Как велико относительное
отклонение вашего результата от данных,
имеющихся у преподавателя? В какой среде
индикатор – метиловый оранжевый –
изменяет окраску? Соответствует ли это
рН в точке эквивалентности в данном
титровании? Не следовало ли взять другой
индикатор?
в
растворе, подлежит ли лекарственная
форма отпуску? Как велико относительное
отклонение вашего результата от данных,
имеющихся у преподавателя? В какой среде
индикатор – метиловый оранжевый –
изменяет окраску? Соответствует ли это
рН в точке эквивалентности в данном
титровании? Не следовало ли взять другой
индикатор?
Контроль усвоения темы (тесты для самоконтроля уровня текущих знаний).
Образец теста
Во время быстрого аварийного подъема из глубины на поверхность, в результате закупоривания кровеносных сосудов, наблюдается изменение цвета кожи, головокружение, расстройства речи, помрачения сознания и такое заболевание называется _____.
1) кессонной (декомпрессионной) болезнью
2) базедовой болезнью
3) анемией
4) диабетом
На растворимость твердых веществ влияет фактор _____.
1) давление
2) величина поверхности твердого вещества
3) природа растворителя
4) объем раствора
Для проведения клинических исследований необходимо приготовить раствор парафина и в качестве растворителя рекомендуют использовать _____.
1) воду
2) метанол
3) ацетон
4) бензол
Ионы, которые не могут существовать одновременно в растворе _____.
1) K+ и PO43-
2) Na+ и SO42-
3) Zn2+ и OH-
4) K+ и NO3-
Пергидролем называют раствор пероксида водорода с массовой долей:
1) 100 %
2) 65 %
3) 30 %
4) 3 %
Молярная концентрация показывает количество молей растворенного вещества, содержащееся в:
1) 1 л (или 1000 мл) раствора
2) 1000 г раствора
3) 100 г раствора
4) 100 мл раствора
Размерность моляльной концентрации выражается….
моль/кг
моль/л
г/моль
г/мл
При разбавлении серной кислоты всегда приливают кислоту в воду. Разбавление конц. H2SO4 приливанием к ней воды опасно тем, что _____.
1) может возникнуть пожар
2) может произойти разложение воды
3) может выделиться газ
4) может произойти разбрызгивание раствора вследствие выделения теплоты
Массовая доля раствора равна ______%, если известно, что 200 г раствора содержат 10 г сульфата цинка:
1) 2
2) 20
3) 5
4) 10
15
Массовая доля серной кислоты в
конечном растворе, полученном при
смешении 0,5
![]() раствора с массовой долей
раствора с массовой долей![]() 7% (
7% (![]()
![]() )
и 150 г этой же кислоты с массовой долей
25% составляет _____ %.
)
и 150 г этой же кислоты с массовой долей
25% составляет _____ %.
1) 10
2) 11
3) 40
4) 48
Масса вещества и растворителя в растворе, полученном при растворении 100 г с массовой концентрацией 10% противоаллергического средства
 ,
составляет ___ и ___г.
,
составляет ___ и ___г.
1) 20 и 80
2) 5 и 95
3) 10 и 90
4) 15 и 99
Для инъекционного введения лекарственного средства, был использован физиологический раствор
 с
массовой концентрацией 0,9%,
с
массовой концентрацией 0,9%, г/мл. Молярная концентрация
г/мл. Молярная концентрация в полученном растворе составляет _____
моль/л (с точностью до целого значения).
в полученном растворе составляет _____
моль/л (с точностью до целого значения).
1) 0,16
2) 0,16
3) 0,17
4) 0,18
Перманганатометрию используют для определения количества органических примесей в воде. Масса перманганата калия, содержащийся в 500 мл раствора с
 =
0,2 моль/л, составляет ______ г.
=
0,2 моль/л, составляет ______ г.
1) 1,58
2) 3,16
3) 6,32
4) 7,90
В медицине в качестве наружного антисептического средства используют раствор _____.
1) КМnО4
2) МnSO4
3) НСI
4) Na2SO4
4.Вопросы по теме для самостоятельного изучения их студентами.«Медицина и химия в цифрах и фактах: ошибка или заблуждения экспертов» (учебно-исследовательский проект с элементами проблемности). Защиту результатов предлагается проводить бригадами из 5-7 студентов.
