
- •С.А. Сергеева, в.Е. Рябинин Практикум по химии
- •Рекомендовано
- •Оглавление
- •Введение
- •Общие вопросы выполнения лабораторных работ
- •1.1. Правила работы в химической лаборатории
- •Правила оказания первой помощи пострадавшим в химической лаборатории
- •1.3. Правила ведения лабораторного журнала
- •Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
- •1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
- •2.Растворы (определение, классификация).
- •3.Титриметрический метод анализа (понятие и виды).
- •4. Метод кислотно-основного титрования (определение, основное уравнение).
- •1. Практическая часть
- •1.3. Контрольные вопросы и задачи
- •2. Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •I. Информационный раздел
- •Концентрация кодеина и морфина в моче у 3-х испытуемых
- •II. Аналитический раздел
- •Тема: Коллигативные свойства растворов неэлектролитов и электролитов
- •1. Вода как универсальный биологический растворитель.
- •2. Коллигативные свойства растворов (определение, виды).
- •1. Практическая часть
- •Суточный баланс воды в организме взрослого человека
- •Состав растворов Рингера –Локка и Тироде для теплокровных животных
- •II. Давление пара разбавленных растворов. Закон Рауля
- •2.1.Давление насыщенного пара растворителя
- •1.3. Контрольные задачи
- •2. Экспериментальная часть
- •Криоскопическим методом
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Протолитические равновесия и процессы. Водородный показатель. Гидролиз
- •1. Электролиты сильные и слабые.
- •3.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
- •1. Практическая часть
- •1.3. Контрольные вопросы
- •2. Экспериментальная часть
- •Реакция среды при гидролизе солей
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Буферные системы, классификация и механизм действия
- •1. Практическая часть
- •2. Экспериментальная часть
- •Ацетатного буферного раствора по кислоте и щелочи
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •5. Практические навыки, которыми должен овладеть студент по теме занятия.
- •Десятичные приставки к названиям единиц
- •Содержание газов в артериальной и венозной крови, л/1 л крови
- •Парциальное давление и напряжение газов, кПа (мм рт. Ст.)
- •Проверка ёмкости мерной посуды
- •Формулы перехода от одних выражений концентраций растворов к другим
- •Константы некоторых жидкостей, применяемых в качестве растворителей
- •Ионное произведение воды при температуре от до:
- •Константы диссоциации некоторых слабых электролитов в водных растворах при
- •Характеристика важнейших индикаторов
- •Средние значения водородного показателя (рН) биологических жидкостей
- •Расчет в растворах кислот и оснований
- •Состав смешанной слюны человека
- •Список литературы Основная литература
- •Дополнительная литература
1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
2.Растворы (определение, классификация).
2.1.Механизм процессов растворения. Термодинамический подход к процессу растворения.
Растворимость газов в жидкостях. Закон Генри-Дальтона. Растворимость газов в крови. Кессонная болезнь.
Способы выражения концентрации растворов (массовая, мольная и объемная доли растворенного вещества, молярная концентрация, молярная концентрация эквивалента, титр раствора).
Взаимосвязь разных способов выражения концентрации растворов.
3.Титриметрический метод анализа (понятие и виды).
3.1.Расчеты в титриметрии. Закон эквивалентов.
3.2.Оборудование титриметрического анализа: мерные и вспомогательные менее точные посуды. Техника работы в объемном анализе (наблюдение за правильностью установки мениска при работе с пипеткой, мерной колбой и бюреткой, правила наливание раствора пипеткой, проверка емкости мерной посуды).
4. Метод кислотно-основного титрования (определение, основное уравнение).
4.1. Ацидиметрия и алкалиметрия: исходные вещества и рабочие тированные растворы; кривые титрования, скачок титрования, точка эквивалентности; индикаторы и интервалы их перехода: метилоранж, фенолфталеин, принцип выбора индикаторов для титрования.
4.2. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами.
Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
1. Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 7) с алгоритмами их решений, эталонами ответов и с комментариями
Расчет по массовой доле веществ в растворе
Задача
№1.В медицине издавна борную кислоту
/![]() /
(сассолин) применяют в виде 2-3% растворов
для полоскания горла, в мазях и присыпках,
т.к. она обладает антисептическими
свойствами. Но, в настоящее время в связи
с выявленными побочными явлениями
внесены ограничения к ее применению.
Сколько граммов
/
(сассолин) применяют в виде 2-3% растворов
для полоскания горла, в мазях и присыпках,
т.к. она обладает антисептическими
свойствами. Но, в настоящее время в связи
с выявленными побочными явлениями
внесены ограничения к ее применению.
Сколько граммов![]() и воды нужно для приготовления 250 г
раствора с массовой долей борной кислоты
3%?
и воды нужно для приготовления 250 г
раствора с массовой долей борной кислоты
3%?
Решение.
Из формулы расчета массовой доли:
 следует:
следует:

 г.
г.Чтобы рассчитать массу воды, нужно из общей массы раствора вычесть массу растворенного вещества:
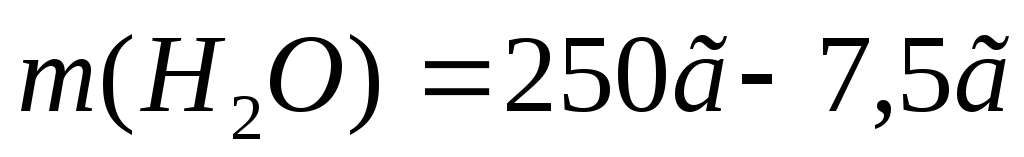 =242,5
г.
=242,5
г.
Ответ.
![]() г.,
г.,![]() 242,5
г.
242,5
г.
Расчеты при разбавлении и смешивании растворов с различной массовой долей растворенного вещества
Задача
№2. Натрия
нитрит /![]() /
в весьма редких случаях применяют внутрь
при отравлении цианидами. В этом случае
его вводят внутривенно в виде 1-2 %
раствора. Какую массу воды следует
добавить к 50 г раствора
/
в весьма редких случаях применяют внутрь
при отравлении цианидами. В этом случае
его вводят внутривенно в виде 1-2 %
раствора. Какую массу воды следует
добавить к 50 г раствора![]() с
массовой долей 11%, чтобы получить раствор
с массовой долей 1% (0,01)?
с
массовой долей 11%, чтобы получить раствор
с массовой долей 1% (0,01)?
Решение.
Для расчета массы
 в исходном растворе воспользуемся
формулой для расчета массовой доли:
в исходном растворе воспользуемся
формулой для расчета массовой доли: ,
преобразованной относительно m(X):
,
преобразованной относительно m(X):
 =
= г
= 5,5 г.
г
= 5,5 г.Найдем массу раствора, которую нужно получить. При добавлении воды масса растворенного вещества не изменяется, следовательно, масса нового раствора в соответствии с вышеуказанной формулой, преобразованной относительно
 ,
имеет вид:
,
имеет вид: =
= =550
г.
=550
г. ,
которую следует добавить, равна разности
между массой приготовленного раствора
и массой исходного раствора:
,
которую следует добавить, равна разности
между массой приготовленного раствора
и массой исходного раствора:
 =
=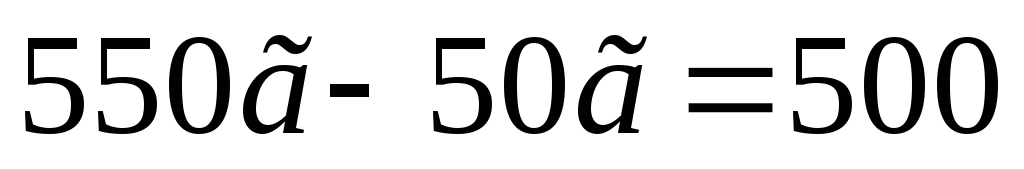 г.
г.
Ответ.
![]() =500
г.
=500
г.
Расчет по молярной концентрации раствора
Задача
№3. В медицине
калия хлорид /![]() /
применяется при нарушении сердечного
ритма, особенно в связи с интоксикацией
сердечными гликозидами, когда происходит
обеднение клеток миокарда ионами K+.
Сколько граммов
/
применяется при нарушении сердечного
ритма, особенно в связи с интоксикацией
сердечными гликозидами, когда происходит
обеднение клеток миокарда ионами K+.
Сколько граммов
![]() необходимо для приготовления 1 л раствора
с
необходимо для приготовления 1 л раствора
с![]() моль/л?
Опишите процесс приготовления этого
раствора (см. рисунок 2.1).
моль/л?
Опишите процесс приготовления этого
раствора (см. рисунок 2.1).
Решение.
Из формулы расчета молярной концентрации:
 следует:
следует:


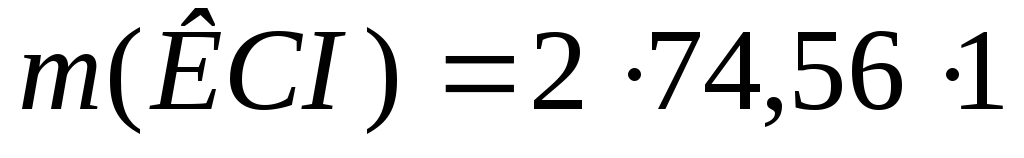 =149,12
г.
=149,12
г.
Ответ.
![]() 149,12
г.
149,12
г.
Приготовление растворов заданной концентрации

Расчет по молярной концентрации эквивалента
Задача
№4. Перманганат
калия /![]() /
применяют в медицинской практике как
антисептическое средство наружно в
водных растворах для промывания ран,
полоскания полости рта и горла, а также
для смазываний язвенных и ожоговых
поверхностей. Рассчитайте сколько
граммов
/
применяют в медицинской практике как
антисептическое средство наружно в
водных растворах для промывания ран,
полоскания полости рта и горла, а также
для смазываний язвенных и ожоговых
поверхностей. Рассчитайте сколько
граммов![]() необходимо
взять для приготовления 2 л раствора с
С(
необходимо
взять для приготовления 2 л раствора с
С(![]() )=
0,5 моль/л, если анализ будет проводиться
в кислой среде?
)=
0,5 моль/л, если анализ будет проводиться
в кислой среде?
Эталон решение.
Из формулы расчета молярной концентрации эквивалентов:
 вытекает:
вытекает:
 .
.Таким образом,

 =6,53
г.
=6,53
г.
Ответ.
![]() 6,53
г.
6,53
г.
Связь между разными способами выражения концентрации
Задача
№5. Вычислите
молярную, эквивалентную молярную и
моляльность раствора серной кислоты с
![]() и
и![]()
![]() .
.
Решение.
Из формулы перехода от концентрации, выраженной массовыми долями растворенного вещества:
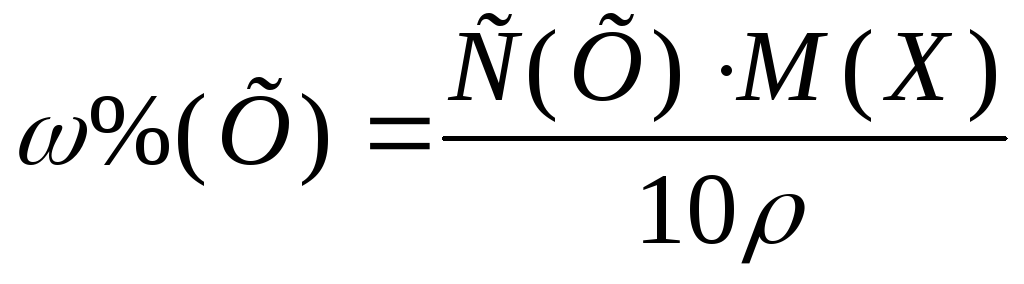 ,
к молярной концентрации вещества или
молярной концентрации эквивалента
вещества соответственно вытекает:
,
к молярной концентрации вещества или
молярной концентрации эквивалента
вещества соответственно вытекает: или
или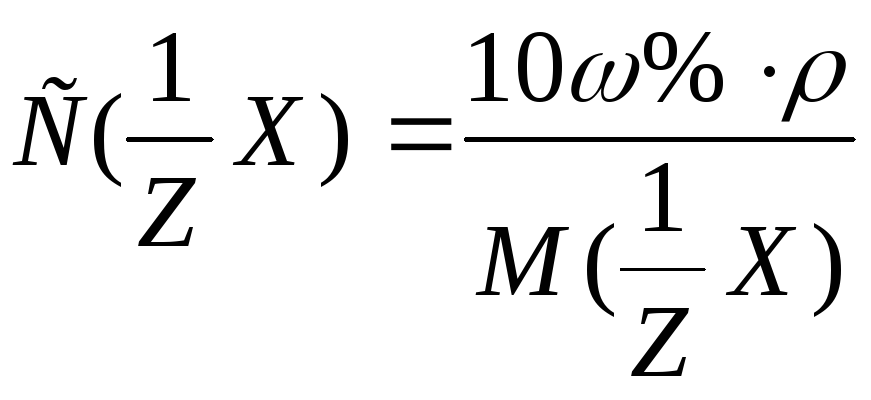 .
.Согласно вышеуказанным формулам получаем:
 =
= =
= моль/л;
моль/л; .
С учетом того, что
.
С учетом того, что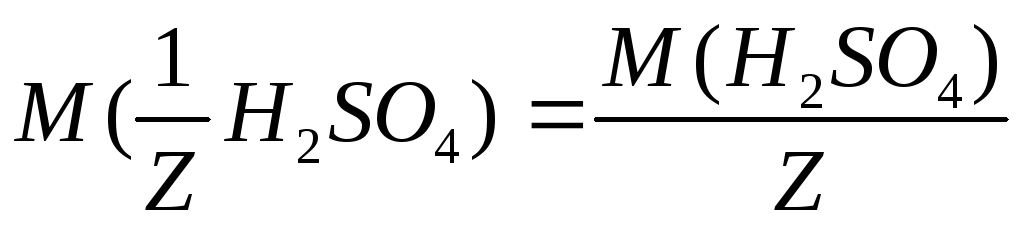 =
= =
49 г/моль, получаем:
=
49 г/моль, получаем:
 =
2,18 моль/л.Как
видно, для
перехода от молярной концентрации
вещества к молярной концентрации его
эквивалента надо знать только значение
фактора эквивалентности
=
2,18 моль/л.Как
видно, для
перехода от молярной концентрации
вещества к молярной концентрации его
эквивалента надо знать только значение
фактора эквивалентности
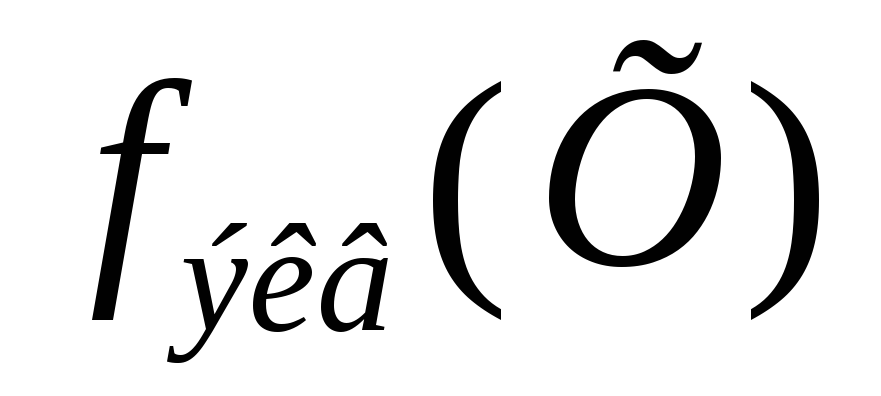 ,
которое показывает, во сколько раз
молярная концентрация эквивалента
вещества больше молярной концентрации
вещества.
,
которое показывает, во сколько раз
молярная концентрация эквивалента
вещества больше молярной концентрации
вещества.Для определения моляльности раствора сначала найдем массу
 в воде массой 1 кг:10:90=х:1000;
в воде массой 1 кг:10:90=х:1000; .
Отсюда
.
Отсюда моль/кг.
моль/кг.
Ответ.
![]()
![]() моль/л;
моль/л;![]() 2,18
2,18![]() ;
;![]() моль/кг.
моль/кг.
Расчет для приготовления растворов лекарственных препаратов при введении больному
Задача №6. Больному при угнетении дыхания и кровообращения различного происхождения необходимо ввести 100 мг лекарственное средство 4-этил-4-метил-2,6-пиперидиндион (бемегрида). Сколько мл этого раствора с массовой долей 0,5% необходимо ввести больному?
Эталон решение.
Исходные данные:
 (бемегрида)=
100 мг= 0,1 г., ρ=1 г/мл.
(бемегрида)=
100 мг= 0,1 г., ρ=1 г/мл.Из формул:
 ,
, ,
, ,
следует:
,
следует: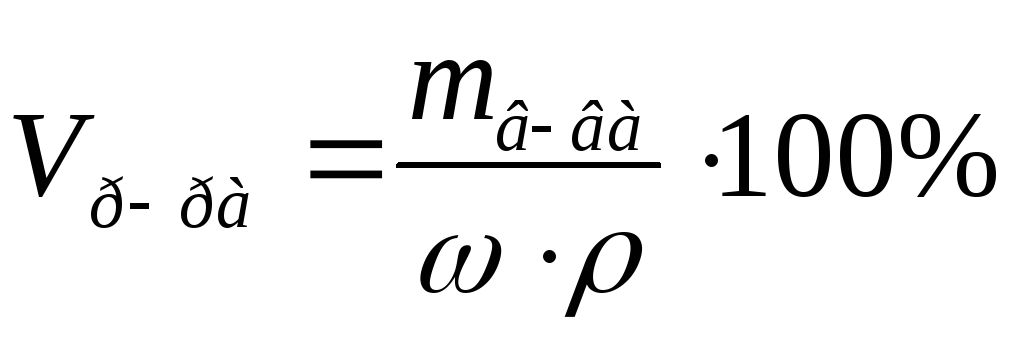 =
= мл (или 20 см3).
мл (или 20 см3).
Ответ. Больному надо ввести 20 мл бемегрида.
Вычисления по результатам прямого титрования
Задача
№7. В медицине
кислоту хлористоводородную разведенную
применяют внутрь в каплях или в виде
микстуры (чаще вместе с пепсином) при
недостаточной кислотности желудочного
сока и ее обычно назначают совместно с
препаратами железа, так как она
способствует улучшению их всасывания.
Какова молярная концентрация эквивалента
и титр хлороводородной кислоты, если
на нейтрализацию 20 мл ее раствора по
реакции
![]() израсходовано 30 мл раствора гидроксида
натрия С
израсходовано 30 мл раствора гидроксида
натрия С![]() моль/л
моль/л
Эталон решение.
Из формулы закона эквивалентов:
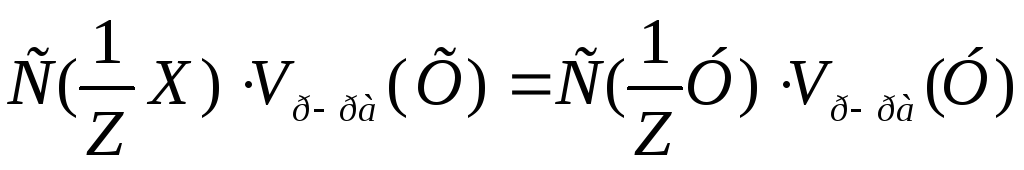 ,
следует:
,
следует: =
= моль/л.
моль/л.Определяем титр раствора HCI по формуле:
 г/мл.
г/мл.
Ответ.
![]() 0,15 моль/л;
0,15 моль/л;![]() г/мл.
г/мл.
1.2. Ситуационные задачи (№№ с 8 по 16) для закрепления материала (выполнить в протокольной тетради).
Задача №8. Больному массой 59 кг необходимо ввести раствор NaHCO3 из расчета 0,66 ммоль/кг. Сколько мл раствора с массовой долей 4,2% необходимо взять?
Задача №9. Для лечения гнойных ран, а также для полосканий и смазываний при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина) фармацевтом был приготовлен раствор из 5 мл 30% раствора Н2О2 и 15 мл дистиллированной воды. Рассчитайте массовую долю Н2О2 в полученном растворе (ρ=1 г/мл).
Задача №10. Фармакопейным препаратом перекиси водорода является раствор перекиси водорода, содержащий 2,7-3,3 % Н2О2 и этот препарат готовят из более концентрированного раствора, содержащего 27,5-31,0% Н2О2 называемого пергидролем. Рассчитайте массу Н2О2 и объем воды, необходимые для приготовления 100 г 3% раствора Н2О2.
Задача № 11. Сколько миллилитров 30% (ρ=1,15 г/мл) раствора соляной кислоты надо взять для приготовления 0,5 л 8,4% фармакопейного препарата HCI (ρ=1,041 г/мл)?
Задача №12. Раствор Люголя, применяющийся в ЛОР- практике для смазывания слизистой оболочки полости рта и горла, содержит 17 мл воды, 1 г йода, 2 г йодида калия. Рассчитать массовые и молярные доли йода и йодида калия в растворе Люголя.
Задача №13. Какую массу глюкозы необходимо растворить в воде массой 260 г, чтобы получить раствор, моляльность которого Сm (С6H12O6/H2O)= 0,5 моль/кг?
Задача
№14. Растворы![]() в медицинской практике применяют как
противоядие при отравлениях: солями
магния, щавелевой кислотой и ее
растворимыми солями, а также растворимыми
солями фтористой кислоты, т.к. при этом
образуются недиссоцирующие и нетоксичные
соединения: оксалат и фторид кальция.
Сколько граммов 10% раствора хлорида
кальция /
в медицинской практике применяют как
противоядие при отравлениях: солями
магния, щавелевой кислотой и ее
растворимыми солями, а также растворимыми
солями фтористой кислоты, т.к. при этом
образуются недиссоцирующие и нетоксичные
соединения: оксалат и фторид кальция.
Сколько граммов 10% раствора хлорида
кальция /![]()
![]() /
потребуется для приготовления 20 мл 2%
раствора /
/
потребуется для приготовления 20 мл 2%
раствора /![]()
![]() /.
Рассчитать молярную долю, молярную,
эквивалентную молярную концентрацию
и титр полученного раствора.
/.
Рассчитать молярную долю, молярную,
эквивалентную молярную концентрацию
и титр полученного раствора.
Задача №15. Для стандартизации раствора хлороводородной кислоты навеску буры (Na2B4O7∙10H2O) массой 0,256 г растворили в мерной колбе объемом 100 мл. На титрование затрачено 13,16 мл раствора HCl. Вычислите молярную концентрацию эквивалента раствора хлороводородной кислоты.
