
- •Задачи с решениями
- •2. (Хромопротеиды: Свойства и функции гемоглобина)
- •3. Биохимия нервной ткани. Бактерии Clostridium botulinum выделяют 7 типов токсинов белковой природы. Наиболее токсичен из них токсин типа а (ботокс).
- •11. Биологическое окисление. Цикл трикарбоновых кислот - общий путь метаболизма. Энергетический обмен. Окислительное фосфорилирование и транспортные системы митохондрий.
- •33. Биохимия крови. Гемостаз. У детей, перенесших сердечно-легочную реанимацию, при контроле системы гемостаза отмечали угнетение Хагеман-зависимого фибринолиза.
- •39. Хрусталик и роговица глаза преломляют свет, поэтому их клетки почти не содержат митохондрий. Каким способом в клетках этих тканей в основном синтезируются молекулы атф ? Для ответа на вопрос:
3. Биохимия нервной ткани. Бактерии Clostridium botulinum выделяют 7 типов токсинов белковой природы. Наиболее токсичен из них токсин типа а (ботокс).
Хотя БОТОКС – одно из самых токсичных веществ в природе, он искусственно синтезируется и широко используется в медицине, особенно в косметологии. БОТОКС препятствует выделению ацетилхолина пресинатическими мембранами. БОТОКС – цинкзависимая протеаза, специфически вырезает белок SNAP-25 (синаптосомальный протеин 25 kDa), заякоренный в пресинаптической мембране и таким образом препятствует соединению синаптических пузырьков с пресинаптической мембраной, что прекращает секрецию ацетилхолина и, соответственно, нарушает проведение импульсов через синапсы.
Объясните возможность применения БОТОКСа в косметологии.
Для ответа на вопрос:
а) назовите принципы использования БОТОКСа, зная механизм его действия в организме человека;
б) какие осложнения возможны при неправильном проведении процедуры инъекции БОТОКСа;
в) нарисуйте схемы, показывающие роль ацетилхолина в синаптической передаче сигнала и перемещении синаптического пузырька, содержащего ацетилхолин, с помощью белка SNAP-25.
ОТВЕТ:
а) Инъекция БОТОКСа в кожу уменьшает или полностью прекращает проведение нервных импульсов и поэтому предотвращает сокращение мышц в области инъекции. Образование морщин в этих областях прекращается, т.к они появляются в результате постоянного сокращения мышц, особенно в уголках глаз и на лбу.
б) При неправильном проведении процедура может привести к параличу вне области инъекции или даже летальному исходу из-за нарушения проводимости сигналов через синапсы в таких жизненно важных органах, как сердце и легкие.
в) Разрушение белка SNAP-25 приводит к нарушению слияния синаптического пузырька, содержащего ацетилхолин, с пресинаптической мембраной и прекращению секреции ацетилхолина в синаптическую щель.

Рис. 3 Роль ацетилхолина в синаптической передаче сигнала

Рис. 4 Роль SNAP-25 (синаптосомального протеина 25 kDa) в перемещении синаптического пузырька
4. Регуляция активности ферментов. Студент получил задание – охарактеризовать активный центр 3 ферментов Е1, Е2, Е3. Для этого он использовал вещества: диизопропилфторфосфат (ДФФ, специфический необратимый ингибитор «сериновых» ферментов) и монойодуксусную кислоту (необратимый неспецифический ингибитор ферментов), а также субстраты этих ферментов. Проведя свои опыты, студент сделал вывод, что Сер присутствует в активном центре ферментов Е1 и Е2, а в активном центре Е1, Е3 и Е2 он определил наличие аминокислотного остатка Цис.
Оцените достоверность результатов, полученных студентом.
Для ответа на вопрос:
а) укажите, почему в работе студент использовал ДФФ и монойодуксусную кислоту; представьте схемы, объясняющие механизм их взаимодействия с ферментом;
б) опишите, как студент мог определить активность ферментов; укажите, в каких единицах измеряется активность ферментов.
ОТВЕТ:
а) ДФФ относится к специфическим необратимым ингибиторам «сериновых» ферментов, т.к. он образует ковалентную связь с гидроксильной группой серина в активном центре фермента при условии определенного окружения радикала серина – Асп, Сер, Глу. Вывод, сделанный студентом, о наличии в активном центре ферментов Е1 и Е2 серина, правильный.

Рис. 5
Использовать монойодуксусную кислоту для установления структуры функциональных групп активного центра фермента нельзя. Это вещество относится к необратимым неспецифическим ингибиторам ферментов и образует ковалентные связи со свободными SH-группами цистеина, занимающими любое положение в молекуле белков. Вывод студента о наличии SH-группы в активном центре ферментов Е1, Е2 и Е3 необходимо проверить, применяя специфические ингибиторы;

Рис. 6
б) Добавляя субстрат в реакционную смесь, уже содержащую фермент и ДФФ или монойодуксусную кислоту, он смог оценить ингибирующее действие этих веществ по снижению скорости расходования субстрата или образования продукта. Результаты опытов показали снижение активности всех ферментов (Е1, Е2, Е3).
Удельная активность фермента = S (мкмоль) /τ (мин) · m (мг).
5. Регуляция активности ферментов. В 1935 г. немецкий врач Г. Домагк обнаружил противомикробное действие протонзила (красного стрептоцида), синтезированного в качестве красителя. Вскоре было установлено, что «действующим началом» красного стрептоцида служит образующийся при его метаболизме сульфаниламид (стрептоцид), от которого произошла большая группа сульфаниламидных препаратов.
Бактериостатическое действие сульфаниламидов связано с тем, что они замещают парааминобензойную кислоту (ПАБК) в активном центре фермента дигидроптеоратсинтазы в процессе синтеза бактериями фолиевой кислоты, необходимой для образования нуклеотидов, т.е. сульфаниламиды –псевдосубстраты. Нарушение синтеза нуклеотидов и, следовательно, нуклеиновых кислот вызывает изменения роста и развития микроорганизмов.
В организме человека фолиевая кислота не синтезируется, а поступает с пищей, как витамин.
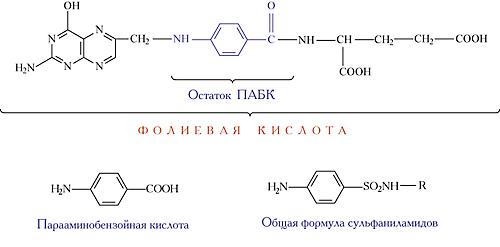
Рис. 7
Объясните механизм антибактериального действия сульфаниламидов.
Ответьте на вопросы:
а) как называется такой тип ингибирования? Благодаря чему он возможен (сравните химические структуры сульфаниламидов и ПАБК)?
б) как такие ингибиторы влияют на Км и Vmax-реакции?
в) почему сульфаниламиды неэффективны в средах, где много ПАБК (например, там, где находится гной)?
г) почему при лечении обычно назначают сразу «ударную» дозу сульфаниламидов?
д) будут ли сульфаниламиды влиять на усвоение фолиевой кислоты человеком?
ОТВЕТ:
а) Конкурентное ингибирование; из-за схожести химических структур сульфаниламидов и ПАБК.
б) Конкурентные ингибиторы увеличивают Км, не изменяют Vmax; сульфаниламиды как структурные аналоги ПАБК связываются в активном центре фермента дигидроптеоратсинтазы (вместо ПАБК), ингибируя ее.
в) Конкурентное ингибирование можно ослабить или полностью прекратить, повысив концентрацию субстрата (ПАБК), поэтому при высокой концентрации ПАБК сульфаниламиды неэффективны.
г) Это делают для того, чтобы за короткий промежуток времени достичь большой концентрации сульфаниламидов в крови, большинство молекул дигидроптеоратсинтазы будет ингибировано (при конкурентном ингибировании степень ингибирования пропорциональна отношению концентраций ингибитора и субстрата: чем оно выше, тем полнее ингибирование). Таким образом, бактерии теряют способность синтезировать нуклеиновые кислоты, размножаться и погибают.
д) Нет, т.к. сульфаниламиды влияют на синтез фолиевой кислоты. На процессы усвоения и образования коферментных форм фолиевой кислоты в организме человека сульфаниламидные препараты не воздействуют.
6. МАТРИЧНЫЕ БИОСИНТЕЗЫ. Глутатион-S-трансферазы (GST) – семейство ферментов, катализирующих присоединение глутатиона (GSH) к различным ксенобиотикам. В ходе этих реакций обезвреживаются токсические вещества, повышается вероятность их выведения из организма. Многофункциональное семейство глутатион-S-трансферазы (GST) играет существенную роль как в метаболизме липидов, продуктов свободнорадикальных реакций, так и в обезвреживании канцерогенов. Известно несколько «полиморфов» GST и, соответственно, полиморфных генов этого фермента. При наличии так называемого «ноль-генотипа» GST (проявляющегося низкой активностью фермента) увеличивается риск развития рака молочной железы. Объясните, как в ходе эволюции могли возникнуть несколько вариантов гена глутатионтрансфераз, включая и ген, присутствие которого в геноме способствует возникновению рака молочной железы.
Для этого:
а) объясните, что такое полиморфизм, мутации;
б) назовите матричный процесс, нарушение которого могло привести к неполному исправлению ошибок репликации и полиморфизму; представьте его схему и дайте краткое описание;
в) поясните, почему низкая активность GST способствует развитию онкологического заболевания;
г) приведите примеры полиморфизма других белков, которые вы знаете.
ОТВЕТ:
а) Существование в популяции 2 и большего числа аллелей одного гена называют «аллеломорфизм», а белковые продукты, образующиеся в ходе экспрессии этих вариантов гена, – «полиморфы». Причина возникновения нескольких вариантов гена глутатионтрансферазы – нарушение процесса репарации, в результате чего могут образовываться гены, кодирующие белки, которые немного отличаются по свойствам от исходного белка. Изменения в последовательности пуриновых или пиримидиновых нуклеотидов в гене, неисправленные ферментами репарации, получили название «мутации». Иногда из-за нарушения репарации появляются гены белков, вызывающие патологические состояния.
б) Этот процесс называется «репарация».

Рис. 11 Система репарации ошибок репликации
в) Снижение активности глутатионтрансферазы и, соответственно, скорости конъюгации канцерогенов с GSH может привести к мутациям, т.к. такие ксенобиотики практически не выводятся из организма.
г) Примеры полиморфизма – варианты гена фермента гликозилтрансферазы (А, В и О), отвечающего за формирование групп крови по системе АВО; белки главного комплекса гистосовместимости и др.
7. МАТРИЧНЫЕ БИОСИНТЕЗЫ. ТРАНСКРИПЦИЯ. Регуляция экспрессии генов у бактерий, как известно, происходит на стадии транскрипции при помощи оперонов. Однако существуют дополнительные механизмы регуляции экспрессии бактериальных генов. Один из них – синтез антисмысловой РНК. Для синтеза антисмысловой РНК используется специальный, отличный от данного «анти-ген». Антисмысловая РНК комплементарна последовательности мРНК и может образовывать с ней двуцепочечную молекулу, стабилизированную водородными связями.
Искусственно синтезированные антисмысловые РНК в настоящее время проходят экспериментальные испытания на способность задерживать развитие рака, а также используются для борьбы с ВИЧ-инфекцией способом блокировки синтеза определенных вирусных белков.
Объясните, почему антисмысловые РНК замедляют экспрессию определенных генов.
Для этого:
a) приведите схему процесса, скорость которого снижается при активации транскрипции «анти-гена». Назовите его этапы и стадии;
б) укажите, какие виды РНК принимают участие в этом процессе.
ОТВЕТ:
a) Синтез белка проходит следующие этапы: инициация, элонгация, терминация.

Рис. 12 Инициация

Рис. 13 Элонгация
Одна аминокислота в процессе элонгации проходит в 3 стадии:
• включение аа-тРНК в А-центр;
• образование пептидной связи;
• перемещение пептидил-тРНК из А-центра в в Р-центр в результате транслокации рибосомы.

Рис. 14 Терминация
б) В ходе синтеза белка участвуют мРНК, тРНК, рРНК (в составе рибосом).
8. МАТРИЧНЫЕ БИОСИНТЕЗЫ. РЕПЛИКАЦИЯ. Цитогенетическим маркером хронического миелолейкоза (ХМЛ) служит Ph-хромосома (Филадельфийская хромосома), которая возникает за счет обмена генетическим материалом между хромосомами 9 и 22. В результате транслокации на 22-й хромосоме возникает новый ген BCR-ABL, кодирующий белок, представляющий собой тирозинкиназу с повышенной активностью. Симптомы заболевания - нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы до миелоцитов и промиелоцитов, спленомегалия, астения, обусловленная повышенным клеточным распадом, который может сопровождаться гиперурикемией. В типичных случаях гематолог легко ставит диагноз ХМЛ, но иногда клинико-гематологическая картина не типична и требуется подтверждение диагноза.
Опишите молекулярно-генетический метод, с помощью которого можно подтвердить диагноз ХМЛ.
Для этого:
а) объясните, как можно получить большое число копий гена в условиях репликации in vitro при очень малых количествах исходной ДНК в образце; приведите схему этого процесса;
б) перечислите, какие компоненты содержит реакционная смесь;
в) изложите, какова функция праймеров;
г) поясните, каким способом можно выявить мутацию в амплифицированном участке ДНК.
ОТВЕТ:
а) Большое число копий гена можно получить методом ПЦР.

Рис. 15 Схема ПЦР
б) Компоненты реакционной смеси: исследуемая ДНК, 4 dNTP, 2 праймера, термостабильная, или Taq-полимераза, буфер, содержащий ионы Mg2+.
в) Праймеры – это короткие олигодезоксирибонукеотидные последовательности длиной от 15 до 30 пар нуклеотидов, которые комплиментарны 3’-концам амплифицируемого участка на нитях ДНК. Расстояние между праймерами определяет длину синтезируемых фрагментов молекулы ДНК.
г) Образцы с амплифицированным фрагментом ДНК, предположительно содержащим мутацию, наносят на узкие полоски нитроцеллюлозы и обрабатывают меченными олигонуклеотидами (32Р-зондами), содержащими нормальную и мутантную последовательности. Радиоавтографически оценивают, с какими 32Р-зондами связывается ДНК пациента. Гибридизация с радиоактивно меченым зондом ‒ наиболее чувствительный метод индикации. Кроме данного метода, в диагностической практике используют электрофорез в агарозном геле с окрашиванием бромистым этидием и ДНК-гибридизацию с последующей индикацией с помощью ферментативной и люминисцентной меток.
9. ГОРМОНЫ. МЕХАНИЗМЫ ДЕЙСТВИЯ (первое занятие). Важное свойство мембран – способность воспринимать и передавать внутрь клетки сигналы из внешней среды. Около 80% первичных мессенджеров (гормоны, нейротрансмиттеры) взаимодействуют со специфическими рецепторами, которые связаны с эффекторами через G-белки. Последние участвуют в разных трансмембранных системах передачи сигнала. Объясните роль G-белков в этих процессах.
Для этого:
а) опишите структурную организацию G-белков;
б) подумайте, какие специфические центры должна иметь каждая α-субъединица в аденилатциклазной системе;
в) напишите схему передачи сигнала от мембранного рецептора через G-белок на фермент аденилатциклазу;
г) разъясните, как усиливается сигнал при работе аденилатциклазной системы;
д) объясните, почему G-белки называют «внутренние часы клетки».
ОТВЕТ:
а) G-белки локализованы на внутренней поверхности плазматической мембраны, имеют гетеротримерную структуру. Они состоят из большой α-субъединицы , а также меньших β- и γ-субъединиц. α-субъединица обладает ГТФ-азной активностью, в неактивной (выключенной) форме она связывает молекулу ГДФ на активном сайте. Субъединицы β и γ

Рис. 16 Структура G-белков
связаны между собой и в физиологических условиях не могут быть диссоциированы. В неактивном состоянии βγ-комплекс непрочно связан с α-субъединицей. γ-Субъединица связана с мембраной геранилгераниловой цепью, близкой по структуре к холестерину, а α-субъединица ‒ с помощью миристиновой кислоты. Такие связи обеспечивают удержание комплекса G-белка в плоскости мембраны и способность легко двигаться в этой плоскости.
б) Необходимы центры для:
• связывания ГТФ или ГДФ;
• взаимодействия с рецептором;
• связывания с βγ-субъединицами;
• взаимодействия с ферментом аденилатциклазой.
в)

Рис. 17 Аденилатциклазная система
г) Каскадный механизм. Одна молекула гормона, активирующая рецептор, может «включать» несколько G-белков, затем каждый активирует несколько молекул аденилатциклаз с образованием тысяч молекул цАМФ и т.д. Таким образом, по механизму каскадного усиления одна молекула гормона способна изменить активность нескольких тысяч молекул.
д) Конформационные изменения в комплексе {α-ГТФ}-{АЦ} стимулируют повышение ГТФ-фосфатазной активности α-субъединицы. Протекает реакция дефосфорилирования ГТФ, и один из продуктов
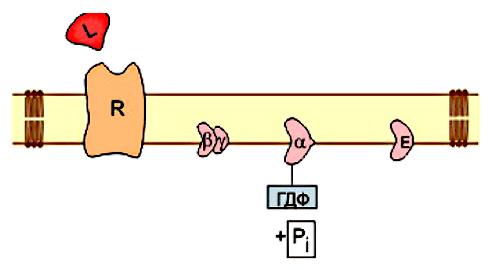
Рис. 18
реакции, неорганический фосфат (Рi), отделяется от α-субъединицы, а комплекс α-ГДФ сохраняется. Образование в активном центре α-субъединицы молекулы ГДФ снижает его сродство к аденилатциклазе, но увеличивает сродство к βγ-субъединицам. G-белок возвращается к неактивной форме. Таким образом, скорость гидролиза ГТФ определяет время, в течение которого система находится в активном состоянии.
10. 1. Липиды: переваривание и всасывание. 2. ВИТАМИНЫ. Пациентка в возрасте 50 лет страдает в течение нескольких лет дискинезией желчного пузыря, что проявляется тупыми болями в правом подреберье. При исследовании кала выявлена стеаторея. В последний месяц у женщины ухудшилось зрение в темноте. Объясните, почему нарушение функции желчного пузыря может привести к ухудшению зрения у данной больной. Изучите последовательность событий, представленных на схеме (рис. А-Г), происходящих в процессе восприятия энергии фотона палочками (рецепторными клетками сетчатки).
Для этого:
а) назовите витамин, который обозначен буквой (V) на рисунке, являющийся предшественником кофермента родопсина;
б) опишите, какие изменения происходят с коферментом, выбранным вами в пункте а) и родопсином при поглощении кванта света (hv);
в) какой тип белка вам напоминает трансдуцин и в каких системах вы видели такой тип белка (см. рис. Б);
г) какую реакцию катализирует фермент ФДЭ, активированный трансдуцином, напишите эту реакцию и укажите ее значение;
д) разъясните, что происходит с Na+/Ca2+-каналом в результате предыдущей реакции и какие изменения происходят при этом (см. рис. Г);
е) объясните молекулярные механизмы связи между дискинезией желчного пузыря и нарушением зрения в темноте.

Рис. 19
М – мембрана наружного сегмента палочек; R - белок родопсин,; hv – энергии фотона; Т - трансдуцин; V – витамин.
ОТВЕТ:
а) Коферментом зрительного белка опсина служит 11-цис-ретиналь, альдегидное производное жирорастворимого витамина А; ретиналь и опсин образуют белок родопсин.
б) При восприятии кванта света зрительным рецептором происходит изомеризация в витаминной части зрительных рецепторов: производное витамина А 11-цис-ретиналь превращается в транс-ретиналь. В результате изменяется белковая опсиновая часть рецепторов, родопсин обесцвечивается и переходит в метародопсин II. Метародопсин II взаимодействует с другим белком – трансдуцином.
в) Трансдуцин состоит из 3 протомеров. В результате активации системы энергией фотона α протомер трансдуцина обменивает ГДФ, который связан с ним в темновой фазе, на ГТФ.
Трансдуцин - разновидность семейства тримерных G-белков. G-белки служат компонентом аденилатциклазной, инозитолфосфатной и других систем передачи сигнала.
г) ФДЭ-фосфодиэстераза – фермент, который гидролизует в данном случае молекулу цГМФ до ГМФ.

Рис. 20
Значение этой реакции - снижение концентрации цГМФ в цитоплазме наружного сегмента.
д) При уменьшении концентрации цГМФ Na+/Ca2+ каналы в плазматической мембране наружного сегмента, которые были открыты в темноте и через которые внутрь рецепторных клеток входили ионы Na+ и Ca2+, закрываются. Уменьшение входа ионов Na+ приводит к гиперполяризации мембраны и возникновению рецепторного потенциала.
е) Дискинезия желчного пузыря характеризуется снижением поступления желчи в двенадцатиперстную кишку. Поступление желчных кислот в кишечник замедляется, нарушается эмульгирование, а следовательно, переваривание и всасывание продуктов гидролиза жиров и жирорастворимых витаминов, к которым относится витамин А. Все эти вещества всасываются в составе смешанных мицелл, для формирования которых также необходимы желчные кислоты. Витамин А участвует в восприятии света, при его гиповитаминозе в темноте ухудшается зрение (куриная слепота). Таким образом можно объяснить связь между дискинезией желчного пузыря и ухудшением зрения в темноте.
