Вирусы
.doc|
6._Методы культивирования вирусов. Для культивирования вирусов используют: - культуры клеток; - культуры тканей; - куриные эмбрионы; - чувствительных лабораторных животных. Культуры клеток. Культуры клеток готовят из тканей животных или человека. Культуры подразделяют на первичные (неперевиваемые), полуперевиваемые и перевиваемые. Первичные культуры клеток получают непосредственно из тканей многоклеточных организмов. Такие клетки обычно не способны к делению (неперевиваемые) и используются однократно: фибробласты эмбриона курицы (ФЭК), человека (ФЭЧ), клетки почки различных животных и т.д. Первичные культуры получают из клеток различных тканей чаще путем их размельчения и трипсинизации, используют однократно, т.е. постоянно необходимо иметь соответствующие органы или ткани. К полуперевиваемым клеткам относятся диплоидные клетки различных тканей и органов, способные к ограниченному размножению in vitro. Перевиваемые культуры клеток готовят из злокачественных линий клеток, обладающих способностью неограниченно размножаться in vitro в определенных условиях, способны к многократному диспергированию и перевиванию, т.е. к многократным пассажам, наиболее удобны в вирусологической работе. К ним относятся, например, злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки и др. О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически и характеризуется морфологическими изменениями клеток. Характер ЦПД вирусов используют как для их обнаружения (индикации), так и для ориентировочной идентификации, т. е. определения их видовой принадлежности. Один из методов индикации вирусов основан на способности поверхности клеток, в которых они репродуцируются, адсорбировать эритроциты — реакция гемадсорбции. Для ее постановки в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты. Другой метод — реакция гемагглютинации (РГ). Применяется для обнаружения вирусов в культуральной жидкости культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Количество вирусных частиц определяют методом титрования по ЦПД в культуре клеток. Для этого клетки культуры заражают десятикратным разведением вируса. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических доз. Более точным количественным методом учета отдельных вирусных частиц является метод бляшек. Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток. Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям. Для получения чистых культур риккетсий, хламидий. и ряда вирусов в диагностических целях, а также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. О размножении упомянутых микроорганизмов судят по морфологическим изменениям, выявляемым после вскрытия эмбриона на его оболочках. О репродукции некоторых вирусов, например гриппа, оспы, можно судить по реакции гемагглютинации (РГА) с куриными или другими эритроцитами. К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие в нем большого количества белков и других соединений, затрудняющих последующую очистку риккетсий или вирусов при изготовлении различных препаратов. Лабораторные животные. Видовая чувствительность животных к определенному вирусу и их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки — к вирусам Коксаки). Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования.
_Реакция торможения гемагглютинации. Механизм. Компоненты. Применение. Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови. Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты. РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных. Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток.
|
_ Реакция агглютинации. Компоненты, механизм, способы постановки. Применение. Реакция агглютинации — простая по постановке реакция, при которой происходит связывание антителами корпускулярных антигенов (бактерий, эритроцитов или других клеток, нерастворимых частиц с адсорбированными на них антигенами, а также макромолекулярных агрегатов). Она протекает при наличии электролитов, например при добавлении изотонического раствора натрия хлорида. Применяются различные варианты реакции агглютинации: развернутая, ориентировочная, непрямая и др. Реакция агглютинации проявляется образованием хлопьев или осадка (клетки, «склеенные» антителами, име ющими два или более антигенсвязывающих центра — рис. 13.1). РА используют для: 1) определения антител в сыворотке крови больных, например, при бруцеллезе (реакции Райта, Хеддельсона), брюшном тифе и паратифах (реакция Видаля) и других инфекционных болезнях; 2) определения возбудителя, выделенного от больного; 3) определения групп крови с использованием моноклональных антител против алло-антигенов эритроцитов. Для определения у больного антител ставят развернутую реакцию агглютинации: к разведениям сыворотки крови больного добавляют диагностикум (взвесь убитых микробов,) и через несколько часов инкубации при 37 ˚С отмечают наибольшее разведение сыворотки (титр сыворотки), при котором произошла агглютинация, т. е. образовался осадок. Характер и скорость агглютинации зависят от вида антигена и антител. Примером являются особенности взаимодействия диагностикумов (О- и H-антигенов) со специфическими антителами. Реакция агглютинации с О-диагностикумом (бактерии, убитые нагреванием, сохранившие термостабильный О-антиген) происходит в виде мелкозернистой агглютинации. Реакция агглютинации с Н-диагностикумом (бактерии, убитые формалином, сохранившие термолабильный жгутиковый Н-антиген) — крупнохлопчатая и протекает быстрее. Если необходимо определить возбудитель, выделенный от больного, ставят ориентировочную реакцию агглютинации, применяя диагностические антитела (агглютинирующую сыворотку), т. е. проводят серотипирование возбудителя. Ориентировочную реакцию проводят на предметном стекле. К капле диагностической агглютинирующей сыворотки в разведении 1:10 или 1:20 добавляют чистую культуру возбудителя, выделенного от больного. Рядом ставят контроль: вместо сыворотки наносят каплю раствора натрия хлорида. При появлении в капле с сывороткой и микробами хлопьевидного осадка ставят развернутую реакцию агглютинации в пробирках с увеличивающимися разведениями агглютинирующей сыворотки, к которым добавляют по 2—3 капли взвеси возбудителя. Агглютинацию учитывают по количеству осадка и степени просветления жидкости. Реакцию считают положительной, если агглютинация отмечается в разведении, близком к титру диагностической сыворотки. Одновременно учитывают контроли: сыворотка, разведенная изотоническим раствором натрия хлорида, должна быть прозрачной, взвесь микробов в том же растворе — равномерно мутной, без осадка. Разные родственные бактерии могут агглютинироваться одной и той же диагностической агглютинирующей сывороткой, что затрудняет их идентификацию. Поэтому пользуются адсорбированными агглютинирующими сыворотками, из которых удалены перекрестно реагирующие антитела путем адсорбции их родственными бактериями. В таких сыворотках сохраняются антитела, специфичные только к данной бактерии.
__Серологические реакции, используемые для диагностики вирусных инфекций.
Иммунные реакции используют при диагностических и иммунологических исследованиях у больных и здоровых людей. С этой целью применяют серологические методы, т. е. методы изучения антител и антигенов с помощью реакций антиген—антитело, определяемых в сыворотке крови и других жидкостях, а также тканях организма. Обнаружение в сыворотке крови больного антител против антигенов возбудителя позволяет поставить диагноз болезни. Серологические исследования применяют также для идентификации антигенов микробов, различных биологически активных веществ, групп крови, тканевых и опухолевых антигенов, иммунных комплексов, рецепторов клеток и др. При выделении микроба от больного проводят идентификацию возбудителя путем изучения его антигенных свойств с помощью иммунных диагностических сывороток, т. е. сывороток крови гипериммунизированных животных, содержащих специфические антитела. Это так называемая серологическая идентификация микроорганизмов. В микробиологии и иммунологии широко применяются реакции агглютинации, преципитации, нейтрализации, реакции с участием комплемента, с использованием меченых антител и антигенов (радиоиммунологический, иммуноферментный, иммунофлюоресцентный методы). Перечисленные реакции различаются по регистрируемому эффекту и технике постановки, однако, все они основаны на реакции взаимодействия антигена с антителом и применяются для выявления как антител, так и антигенов. Реакции иммунитета характеризуются высокой чувствительностью и специфичностью. Особенности взаимодействия антитела с антигеном являются основой диагностических реакций в лабораториях. Реакция in vitro между антигеном и антителом состоит из специфической и неспецифической фазы. В специфическую фазу происходит быстрое специфическое связывание активного центра антитела с детерминантой антигена. Затем наступает неспецифическая фаза — более медленная, которая проявляется видимыми физическими явлениями, например образованием хлопьев (феномен агглютинации) или преципитата в виде помутнения. Эта фаза требует наличия определенных условий (электролитов, оптимального рН среды). Связывание детерминанты антигена (эпитопа) с активным центром Fab-фрагмента антител обусловлено ван-дер-ваальсовыми силами, водородными связями и гидрофобным взаимодействием. Прочность и количество связавшегося антигена антителами зависят от аффинности, авидности антител и их валентности. |
1 2. Морфология и структура вируса гриппа. 3. Морфология и структура вируса полиомиелита 4. Морфология и структура вируса герпеса 5. Признаки, отличающие вирусы от прокариот. 6. Методы культивирования вирусов 7. Результаты взаимодействия вируса с клеткой при острой и персестирующей вирусной инфекции. 8. Вирусоскопический метод. Внутриклеточные включения вирусного проис-хождения, характеристика. 9. Персистенция вирусов. Виды персистенции. Характеристика их. 10. Интеграция нуклеиновой кислоты вирусов в клеточный геном. Фазы процесса. Проявление. 11. Основы классификации вирусов 12. Вирусологическая диагностика вирусных инфекций 13. Морфология и антигенная структура вируса гепатита В 14. Морфология и антигенная структура вируса гепатита А 15. Морфология и антигенная структура вирусов Коксаки и ЕСНО. 16. Морфология и антигенная структура ретровируса - ВИЧ. 17. Особенности строения и антигенная характеристика вируса гепатита В и С 18. Особенности противовирусного иммунитета. 19. Химический состав вирионов. Вирусная РНК и ДНК 20. Структура и антигенная характеристика вируса гепатита В и С 21. Вирусологический метод диагностики гепатита А. 22. Вирусологический метод диагностики гепатита В 23. Вирусологический метод диагностики гриппа 24. Вирусологический метод диагностики вирусов Коксаки и ЕСНО. 25. Особенности строения и антигеная характеристика вируса гепатита В. 26. Серологические реакции для диагностики гриппа. 27. Вирусологические методы диагностики энтеровирусных инфекций 28. Принцип патогенеза гриппозной инфекции и вирусологический метод диагностики. 29. Серологические реакции, используемые при диагностике полиомиелита. 30. Серологические реакции для диагностики энтеровирусных инфекций. 31. Серологические реакции для диагностики гепатита В. 32. Методы вирусологической диагностики полиомиелита 33. Вирусологическая диагностика полиомиелита. 34. Интерферон. Характеристика препарата. Механизм действия. 35. Живая полиомиелитная вакцина. 36. Пассивная иммунопрофилактика гепатита А. Характеристика препарата. 37. Принцип патогенеза гепатита А. 38. Противогриппозные сыворотки. 39. Препараты для специфической активной профилактики гриппа. 40. Принципы приготовления генно-инженерных вакцин. Специфическая профилактика гепатита В. 41. Убитые вакцины для профилактики вирусных инфекций. 42. Вакцины для специфической профилактики полиомиелита. 43. Серологический метод исследования при диагностике гепатита А. 44. Принцип постановки реакций ГА и ТГА. 45. Использование РСК, реакции преципитации, РНГА при лабораторной диагностике вирусных инфекций 46. Стадии взаимодействия вируса с клеткой. 47. Экспресс диагностика вирусных инфекций. 48. Патогенез гепатита В и вирусологический метод диагностики. 49. Постановка реакции нейтрализации вирусов методом цветной пробы.
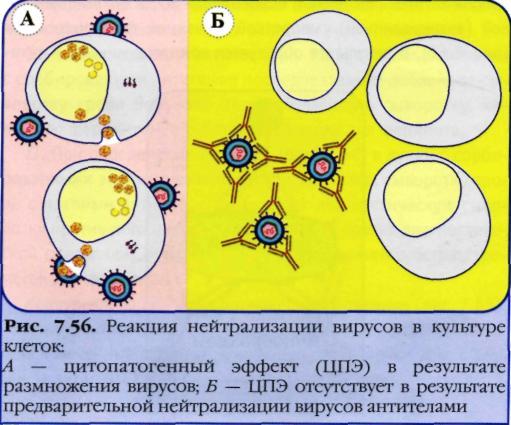
Реакция нейтрализации. В основе этой реакции лежит способность специфической антитоксической сыворотки нейтрализовать экзотоксин. Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т. е. их нейтрализацией. Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело. Для проведения реакции исследуемый материал, в котором предполагается наличие экзотоксина, смешивают с антитоксической сывороткой, выдерживают в термостате и вводят животным (морским свинкам, мышам). Контрольным животным вводят фильтрат исследуемого материала, не обработанный сывороткой. В том случае, если произойдет нейтрализация экзотоксина антитоксической сывороткой, животные опытной группы останутся живыми. Контрольные животные погибнут в результате действия экзотоксина.
|
|
11. Классификация вирусов 1. По размеру: a. маленькие( 15-100 нм, вирус полиомиелита); b. средние(100-300 нм); c. крупные(300-350 нм, вирусы натуральной оспы). 2. По форме: a. палочковидные(вирус табачной мозаики); b. нитевидные(филовирусы); c. пулеобразные(вирус бешенства); d. шаровидные(вирусы полиомиелита); e. в виде сперматозоида(бактериофаги). 3. По строению: a. простые(безоболочечные, вирус гепатита А); b. сложные(оболочные, вирус гриппа). 4. По типу симметрии: a. спиральный(вирус гриппа); b. икосаэдрический(кубический, вирус герпеса); c. сложный. 5. По типу нуклеиновой кислоты: a. ДНК b. РНК 6. По количеству нитей: a. двунитевые b. Однонитевые 7. По способу размножения; 8. По способу передачи вирусов; 9. По географическому расположению; 10. По хозяину; 11. По антигенным свойствам;
10,46. Типы взаимодействия вируса с клеткой. Стадии репродукции вирусов. Различают три типа взаимодействия вируса с клеткой: продуктивный, абортивный и интегративный. Продуктивный тип — завершается образованием нового поколения вирионов и гибелью (лизисом) зараженных клеток (цитоли-тическая форма). Некоторые вирусы выходят из клеток, не разрушая их (нецитолитическая форма). Абортивный тип — не завершается образованием новых вирионов, поскольку инфекционный процесс в клетке прерывается на одном из этапов. Интегративный тип, или вирогения — характеризуется встраиванием (интеграцией) вирусной ДНК в виде провируса в хромосому клетки и их совместным сосуществованием (совместная репликация). Латентная вирусная инфекция - это такой тип взаимодействия вируса с клеткой, при котором происходит репродукция и вирусов, и клеточных компонентов, но клетка не погибает; при этом клеточные синтезы преобладают, и поэтому клетка достаточно длительно сохраняет свои функции - этот механизм лежит в основе безусловных латентных вирусных инфекций; Вирус-индуцированные трансформации - это такой тип взаимодействия вируса с клеткой, при котором клетки, пораженные вирусом, приобретают новые, ранее не присущие им свойства. Геном вируса или его часть встраивается в геном клетки, и вирусные гены превращаются в группу клеточных генов. Этот интегрированный в хромосому клетки-хозяина вирусный геном называется провирус, а такое состояние клеток обозначается как вирогения.
Репродукция вирусов осуществляется в несколько стадий, последовательно сменяющих друг друга: адсорбция вируса на клетке; проникновение вируса в клетку; «раздевание» вируса; биосинтез вирусных компонентов в клетке; формирование вирусов; выход вирусов из клетки. Адсорбция. Взаимодействие вируса с клеткой начинается с процесса адсорбции, т. е. прикрепления вирусов к поверхности клетки. Это высокоспецифический процесс. Вирус адсорбируется на определенных участках клеточной мембраны — так называемых рецепторах. Клеточные рецепторы могут иметь разную химическую природу, представляя собой белки, углеводные компоненты белков и липидов, липиды. Число специфических рецепторов на поверхности одной клетки колеблется от 104 до 105. Следовательно, на клетке могут адсорбироваться десятки и даже сотни вирусных частиц. Проникновение в клетку. Существует два способа проникновения вирусов животных в клетку: виропексис и слияние вирусной оболочки с клеточной мембраной. При виропексисе после адсорбции вирусов происходят инвагинация (впячивание) участка клеточной мембраны и образование внутриклеточной вакуоли, которая содержит вирусную частицу. Вакуоль с вирусом может транспортироваться в любом направлении в разные участки цитоплазмы или ядро клетки. Процесс слияния осуществляется одним из поверхностных вирусных белков капсидной или суперкапсидной оболочки. По-видимому, оба механизма проникновения вируса в клетку не исключают, а дополняют друг друга. «Раздевание». Процесс «раздевания» заключается в удалении защитных вирусных оболочек и освобождении внутреннего компонента вируса, способного вызвать инфекционный процесс. «Раздевание» вирусов происходит постепенно, в несколько этапов, в определенных участках цитоплазмы или ядра клетки, для чего клетка использует набор специальных ферментов. В случае проникновения вируса путем слияния вирусной оболочки с клеточной мембраной процесс проникновения вируса в клетку сочетается с первым этапом его «раздевания». Конечными продуктами «раздевания» являются сердцевина, нуклеокапсид или нуклеиновая кислота вируса. Биосинтез компонентов вируса. Проникшая в клетку вирусная нуклеиновая кислота несет генетическую информацию, которая успешно конкурирует с генетической информацией клетки. Она дезорганизует работу клеточных систем, подавляет собственный метаболизм клетки и заставляет ее синтезировать новые вирусные белки и нуклеиновые кислоты, идущие на построение вирусного потомства. Реализация генетической информации вируса осуществляется в соответствии с процессами транскрипции, трансляции и репликации. Формирование (сборка) вирусов. Синтезированные вирусные нуклеиновые кислоты и белки обладают способностью специфически «узнавать» друг друга и при достаточной их концентрации самопроизвольно соединяются в результате гидрофобных, солевых и водородных связей. Существуют следующие общие принципы сборки вирусов, имеющих разную структуру: 1. Формирование вирусов является многоступенчатым процессом с образованием промежуточных форм; 2. Сборка просто устроенных вирусов заключается во взаимодействии молекул вирусных нуклеиновых кислот с капсидными белками и образовании нуклеокапсидов (например, вирусы полиомиелита). У сложно устроенных вирусов сначала формируются нуклеокапсиды, с которыми взаимодействуют белки суперкапсидных оболочек (например, вирусы гриппа); 3. Формирование вирусов происходит не во внутриклеточной жидкости, а на ядерных или цитоплазматических мембранах клетки; 4. Сложно организованные вирусы в процессе формирования включают в свой состав компоненты клетки-хозяина (липиды, углеводы). Выход вирусов из клетки. Различают два основных типа выхода вирусного потомства из клетки. Первый тип — взрывной — характеризуется одновременным выходом большого количества вирусов. При этом клетка быстро погибает. Такой способ выхода характерен для вирусов, не имеющих суперкапсидной оболочки. Второй тип — почкование. Он присущ вирусам, имеющим суперкапсидную оболочку. На заключительном этапе сборки нуклеокапсиды сложно устроенных вирусов фиксируются на клеточной плазматической мембране, модифицированной вирусными белками, и постепенно выпячивают ее. В результате выпячивания образуется «почка», содержащая нуклеокапсид. Затем «почка» отделяется от клетки. Таким образом, внешняя оболочка этих вирусов формируется в процессе их выхода из клетки. При таком механизме клетка может продолжительное время продуцировать вирус, сохраняя в той или иной мере свои основные функции. Время, необходимое для осуществления полного цикла репродукции вирусов, варьирует от 5—6 ч (вирусы гриппа, натуральной оспы и др.) до нескольких суток (вирусы кори, аденовирусы и др.). Образовавшиеся вирусы способны инфицировать новые клетки и проходить в них указанный выше цикл репродукции. |
1, Морфология и структура вирионов Вирусы- это автономные генетические структуры, имеющие ультрамикроскопические размеры, являющиеся облигатными внутриклеточными паразитами, обладающие одним типом нуклеиновой кислоты(ДНК или РНК), не имеющие собственной белок-синтезирующей системы и размножающиеся особым типом- дизъюнктивно (т.е. разобщенно) и относящиеся к царству Virea. Вирион — полноценная вирусная частица, состоящая из нуклеиновой кислоты и капсида (оболочки, состоящей из белка и, реже, липидов) и находящаяся вне живойклетки. Вирионы большинства вирусов не проявляют никаких признаков биологической активности, пока не соприкоснутся с клеткой-хозяином, после чего образуют комплекс «вирус—клетка», способный жить и «производить» новые вирионы. При заражении клетки вирион либо вводит в клетку-хозяина только свой геном (например,бактериофаги), либо проникает в клетку практически полностью (большинство других вирусов). Вироиды — небольшие молекулы кольцевой, суперспи-рализованной РНК, не содержащие белка, вызывающие заболевания у растений.структурой и не содержащих нуклеиновых кислот. Прионы — белковые инфекционные частицы, являющиеся агентами белковой природы, имеющие вид фибрилл размером 10—20x100—200 нм. Прионы, по-видимому, являются одновременно индукторами и продуктами автономного гена человека или животного и вызывают у них энцефалопатии в условиях медленной вирусной инфекции (болезни Крейтц-фельдта—Якоба, куру и др.). Морфологию и структуру вирусов изучают с помощью электронного микроскопа, так как их размеры малы и сравнимы с толщиной оболочки бактерий. Форма вирионов может быть различной: палочковидной (вирус табачной мозаики), пулевидной (вирус бешенства), сферической (вирусы полиомиелита, ВИЧ), в виде сперматозоида (многие бактериофаги). Различают просто устроенные и сложно устроенные вирусы. Простые, или безоболочечные, вирусы состоят из нуклеиновой кислоты и белковой оболочки, называемой капсидом. Капсид состоит из повторяющихся морфологических субъединиц — капсомеров. Нуклеиновая кислота и капсид взаимодействуют друг с другом, образуя нуклеокапсид. Сложные, или оболочечные, вирусы снаружи капсида окружены ли-попротеиновой оболочкой (суперкапсидом, или пеплосом). Эта оболочка является производной структурой от мембран вирус-инфицированной клетки. На оболочке вируса расположены гликопротеиновые шипы, или шипики (пепломеры). Под оболочкой некоторых вирусов находится матриксный М-белок. Капсид и суперкапсид защищают вирионы от влияния окружающей среды, обусловливают избирательное взаимодействие (адсорбцию) с клетками, определяют антигенные и иммуногенные свойства вирионов. Внутренние структуры вирусов называются сердцевиной. Тип симметрии. Капсид или нуклеокапсид могут иметь спиральный, икосаэдрический (кубический) или сложный тип симметрии. Икосаэдрический тип симметрии обусловлен образованием изометрически полого тела из капсида, содержащего вирусную нуклеиновую кислоту (например, у вирусов гепатита А, герпеса, полиомиелита). Спиральный тип симметрии обусловлен винтообразной структурой нуклеокапсида (например, у вируса гриппа). Включения — скопление вирионов или отдельных их компонентов в цитоплазме или ядре клеток, выявляемые под микроскопом при специальном окрашивании. Вирус натуральной оспы образует цитоплазмати-ческие включения — тельца Гварниери; вирусы герпеса и аденовирусы — внутриядерные включения. Размеры вирусов определяют с помощью электронной микроскопии, методом ультрафильтрации через фильтры с известным диаметром пор, методом ультрацентрифугирования. Одним из самых мелких вирусов является вирус полиомиелита (около 20 нм), наиболее крупным — натуральной оспы (около 350 нм). Вирусы имеют уникальный геном, так как содержат либо ДНК, либо РНК. Поэтому различают ДНК-содержащие и РНК-содержащие вирусы. Они обычно гаплоидны, т.е. имеют один набор генов. Геном вирусов представлен различными видами нуклеиновых кислот: двунитчатыми, однонитчатыми, линейными, кольцевыми, фрагментированными. Среди РНК-содержащих вирусов различают вирусы с положительным (плюс-нить РНК) геномом. Плюс-нить РНК этих вирусов выполняет наследственную функцию и функцию информационной РНК (иРНК). Имеются также РНК-содержащие вирусы с отрицательным (минус-нить РНК) геномом. Минус-нить РНК этих вирусов выполняет только наследственную функцию. Геном вирусов способен включаться в состав генетического аппарата клетки в виде провируса, проявляя себя генетическим паразитом клетки. Нуклеиновые кислоты некоторых вирусов (вирусы герпеса и др.) могут находиться в цитоплазме инфицированных клеток, напоминая плазмиды.
5. Признаки, отличающие вирусы от прокариот. 1.Вирусы не имеют клеточного строения, в то время как бактерии – одноклеточные. Строение примитивного вируса представляет собой молекулу или ДНК, или РНК, окруженную молекулами белка, которые создают оболочку. Более сложные вирусы могут иметь вторую, внешнюю оболочку и, даже содержать ферменты. Бактерии, хоть и примитивные, но все же настоящие клетки. И, хотя у них нет как такового ядра, но ДНК в форме клубка находится прямо в цитоплазме, имеется клеточная оболочка с капсулами, жгутиками и микроворсинками, присутствует в клетке РНК. 2.Вирусы не могут размножаться вне живых клеток. Бактерии размножаются самостоятельно делением клетки. Вирус внедряется то в те клетки, куда может попасть при помощи клеточных рецепторов. Там он распадается на нуклеиновую кислоту и белковые оболочки. Эти оболочки прикрепляются к мембране клетки. С этого момента всеми процессами в клетке управляет та генетическая информация, которая содержится в НК вируса. Клетка сама приступает к синтезу вирусных белков. Затем из вновь образованных нуклеиновых кислот и белков образуются новые вирусы, а клетка разрушается. 3.Вирусы обладают только одним видом нуклеиновой кислоты, а в состав бактерии входит ДНК, РНК, рибосомы и клеточная мембрана. 4. Размеры вирусов намного меньше размеров бактерий. 5.Вирусы не обладают обменом веществ. Так как бактерии – клетки, они характеризуются собственным обменом веществ.
9.Персистенция вирусов. Виды персистенции. ВИРУСНАЯ ПЕРСИСТЕНЦИЯ - сохранение вируса в функционально активном состоянии в клетках организма или культур ткани за пределами тех сроков, которые характерны для острой инфекции. Соответственно, инфекции, обусловленные феноменом вирусной персистенции, называют персистентными вирусными инфекциями. Как правило, они протекают при менее выраженных по сравнению с острой инфекцией клинических проявлениях, либо вовсе без них. Выделяют три группы персистентных вирусных инфекций: 1.хронические; 2.латентные; 3.медленные. Хронические инфекции отличаются от двух других тем, что присутствие вируса определяется относительно просто с помощью лабораторных методов; к их числу относятся, например, хронические формы вирусного гепатита В . При латентных инфекциях, типичных, в частности, для герпесвирусов, возбудитель маскирован в тканях, и его выявление возможно при обострениях. При медленных инфекциях, представителем которых может считаться болезнь Крейцфельда-Якоба, вирусная персистенция приходится на чрезвычайно длительный (несколько лет) инкубационный период, предшествующий медленно развивающемуся заболеванию.
|
2, 23,26 Морфология и структура вируса гриппа. Таксономия: семейство – Orthomyxoviridae, род Influenzavirus. Различают 3 серотипа вируса гриппа: А, В и С. Структура вируса гриппа А. Возбудитель гриппа имеет однонитчатую РНК, состоящую из 8 фрагментов. Подобная сегментарность позволяет двум вирусам при взаимодействии легко обмениваться генетической информацией и тем самым способствует высокой изменчивости вируса. Капсомеры уложены вокруг нити РНК по спиральному типу. Вирус гриппа имеет также суперкапсид с отростками. Вирус полиморфен: встречаются сферические, палочковидные, нитевидные формы. Антигенная структура. Внутренние и поверхностные антигены. Внутренние антигены состоят из РНК и белков капсида, представлены нуклеопротеином (NP-белком) и М-белками. NP-и М-белки — это типоспецифические антигены. NP-белок способен связывать комплемент, поэтому тип вируса гриппа обычно определяют в РСК. Поверхностные антигены — это гемагглютинин и нейраминидаза. Их структуру, которая определяет подтип вируса гриппа, исследуют в РТГА, благодаря торможению специфическими антителами гемагглютинации вирусов. Внутренний антиген – стимулирует Т-киллеры и макрофаги, не вызывает антителообразования. У вируса имеются 3 разновидности Н- и 2 разновидности N – антигенов. Иммунитет: Во время заболевания в противовирусном ответе участвуют факторы неспецифической защиты: выделительная функция организма, сывороточные ингибиторы, альфа-интерферон, специфические IgA в секретах респираторного тракта, которые обеспечивают местный иммунитет. Клеточный иммунитет - NK-клетки и специфические цитотоксические Т-лимфоциты, действующие на клетки, инфицированные вирусом. Постинфекционный иммунитет достаточно длителен и прочен, но высокоспецифичен (типо-, подтипо-, вариантоспецифичен). Микробиологическая диагностика. Диагноз «грипп» базируется на (1) выделении и идентификации вируса, (2) определении вирусных АГ в клетках больного, (3) поиске вирусоспецифических антител в сыворотке больного. При отборе материала для исследования важно получить пораженные вирусом клетки, так как именно в них происходит репликация вирусов. Материал для исследования — носоглоточное отделяемое. Для определения антител исследуют парные сыворотки крови больного. Экспресс-диагностика. Обнаруживают вирусные антигены в исследуемом материале с помощью РИФ (прямой и непрямой варианты) и ИФА. Можно обнаружить в материале геном вирусов при помощи ПЦР. Вирусологический метод. Оптимальная лабораторная модель для культивирования штаммов—куриный эмбрион. Индикацию вирусов проводят в зависимости от лабораторной модели (по гибели, по клиническим и патоморфологическим изменениям, ЦПД, образованию «бляшек», «цветной пробе», РГА и гемадсорбции). Идентифицируют вирусы по антигенной структуре. Применяют РСК, РТГА, ИФА, РБН (реакцию биологической нейтрализации) вирусов и др. Обычно тип вирусов гриппа определяют в РСК, подтип — в РТГА. Серологический метод. Диагноз ставят при четырехкратном увеличении титра антител в парных сыворотках от больного, полученных с интервалом в 10 дней. Применяют РТГА, РСК, ИФА, РБН вирусов. Лечение: симптоматическое/патогенетическое. А-интерферон – угнетает размножение вирусов. 1. Препараты - индукторы эндогенного интерферона. Этиотропное лечение - ремантидин – препятствует репродукции вирусов, блокируя М-белки. Арбидол – действует на вирусы А и В. 2. Препараты - ингибиторы нейраминидазы. Блокируют выход вирусных частиц из инфицированных клеток. При тяжелых формах – противогриппозный донорский иммуноглобулин и нормальный человеческий иммуноглобулин для в\в введения. Профилактика: Неспецифическая профилактика – противоэпидемические мероприятия, препараты а-интерферона и оксолина. Специфическая – вакцины. Живые аллантоисные интраназальная и подкожная, тривалентные инактивированные цельно-вирионные гриппозные интраназальная и парентеральная-подкожная (Грипповак), химические Агриппал, полимер-субъединичная «Гриппол». Живые вакцины создают наиболее полноценный, в том числе местный, иммунитет.
8. Вирусоскопический метод. Внутриклеточные включения вирусного проис-хождения, характеристика. Вирусоскопический метод диагностики осуществляют при помощи: 1. Электронной микроскопии 2. Люминесцентной микроскопии 3. Световой микроскопии Электронная микроскопия позволяет наблюдать объекты, размеры которых лежат за пределами разрешающей способности светового микроскопа (0,2 мкм). Световые лучи в таких микроскопах заменяют поток электронов, имеющий при определенных условиях длину волны около 0,005 нм, т.е. почти в 100000 раз короче длины волны видимого света. Люминесцентная микроскопия основана на явлении фотолюминесценции. По сравнению с обычными методами обладает рядом преимуществ: возможностью исследования живых микроорганизмов и обнаружения их в исследуемом материале в небольших концентрациях вследствие высокой степени контрастности. Световая микроскопия позволяет выявить включения вирусов, которые они образуют в ядре или цитоплазме заражённых клеток. Для этого необходимо предварительно окрасить мазок по методу Романовского-Гимзе или серебрением по Морозову. Серологическая диагностика вирусных инфекций основана на выявлении в крови больного противовирусных антител в серологических реакциях с использованием специфических вирусных антигенов - диагностикумов или специфицеских тест – систем. В основе большинства серологических реакций при вирусных инфекциях лежат реакция взаимодействия вирусных антигенов и гомологичных антител в жидкой среде. РСК, РТГА, РНГА, РИФ, ИФА, РИА. Некоторые вирусы можно обнаружить и идентифицировать по включениям , которые они образуют в ядре или цитоплазме заражённых клеток. Включения выявляются в окрашенных по Романовскому-Гимзе мазках из зараженных клеток. Они бывают эозинофильные и базофильные. По локализации в клетке различают: • цитоплазматические; • ядерные; • смешанные включения. Характерные ядерные включения формируются в клетках, зараженных вирусами герпеса (тельца Каудри), цитомегалии и полиомы, аденовирусами, а цитоплазматические включения — вирусами оспы (тельца Гварниери и Пашена), бешенства (тельца Бабеша-Негри) и др. |
|
3, 32. Морфология и структура вируса полиомиелита
Таксономия.: семейство Picornaviridae, род Enterovims, вид Poliovirus. Структура. По структуре полиовирусы — типичные представители рода Enterovirus. РНК-содержащие вирусы. Морфология: мелкий вирус размером до 30 им, образует внутриядерные включения в пораженных клетках. Вирион имеет почти сферическую форму, тип симметрии кубический, состоит из однонитчатой РНК и белка. Мелкие частицы вируса полиомиеднта способны образовывать кристаллы. Культивирование: Хорошо репродуцируются в первичных и перевариваемых культурах клеток из тканей человека и сопровождается цитопатическим эффектом. В культуре клеток под агаровым покрытием энтеровирусы образуют бляшки. Антигенные свойства: Существует три тина вируса полиомиелита (I, II, III), не вызывающие перекрестного иммунитета. Все серотипы патогенны для человека. Патогенез и клиника. Естественная восприимчивость человека к вирусам полиомиелита высокая. Входными воротами служат слизистые оболочки верхних дыхательных путей и пищеварительного тракта. Первичная репродукция вирусов происходит в лимфатических узлах глоточного кольца и тонкой кишки. Из лимфатической системы вирусы проникают в кровь, а затем в ЦНС, где избирательно поражают клетки передних рогов спинного мозга (двигательные нейроны). Инкубационный период продолжается в среднем 7—14 дней. Различают 3 клинические формы полиомиелита: паралитическую, менингеальную (без параличей), абортивную (легкая форма). Заболевание начинается с повышения температуры тела, общего недомогания, головных болей, рвоты, болей в горле. Иммунитет. После перенесенной болезни остается пожизненный типоспецифический иммунитет. Иммунитет определяется наличием вируснейтрализующих антител, среди которых важная роль принадлежит местным секреторным антителам слизистой оболочки глотки и кишечника (местный иммунитет). Пассивный естественный иммунитет сохраняется в течение 3—5 недель после рождения ребенка. Микробиологическая диагностика. Материал для исследования - кал, отделяемое носоглотки, при летальных исходах — кусочки головного и спинного мозга, лимфатические узлы. Ранний метод диагностики полиомиелита основан на выделении вируса испражнений и слизи носоглотки в культуре клеток или при заражении экспериментальных животных (обезьяны хлопковые крысы, новорожденные белые мышата). Вирусы полиомиелита выделяют путем заражения исследуемым материалом первичных и перевиваемых культур клеток. О репродукции вирусов судят по цитопатическому действию. Идентифицируют выделенный вирус с помощью типоспецифических сывороток в реакции нейтрализации в культуре клеток. Важное значение имеет внутривидовая дифференциация вирусов, которая позволяет отличить патогенные штаммы от вакцинных штаммов, выделяющихся от людей, иммунизированных живой полиомиелитной вакциной. Различия между штаммами выявляют с помощью ИФА, реакции нейтрализации цитопатического действия вируса в культуре клеток со штаммоспецифической иммунной сывороткой, а также в ПЦР. Серодиагностика основана на использовании парных сывороток больных с применением эталонных штаммов вируса в качестве диагностикума. Содержание сывороточных иммуноглобулинов классов IgG, IgA, IgM определяют методом радиальной иммунодиффузии по Манчини. Лечение. Патогенетическое. Применение гомологичного иммуноглобулина для предупреждения развития паралитических форм ограничено. Профилактика. Основной мерой профилактики полиомиелита является иммунизация. Первая инактивированная вакцина для профилактики – создавала общий гуморальный иммунитет, не формировала местной резистентности слизистых оболочек ЖКТ, не обеспечивала надежную защиту. Пероральная живая культуральная вакцина из трех серотипов штаммов. Используют для массовой иммунизации детей, она создает стойкий общий и местный иммунитет. Неспецифическая профилактика сводится к санитарно-гигиеническим мероприятиям. Острая инфекционная болезнь, с лихорадкой, поражением печени. Антропоноз.
13. Морфология и антигенная структура вируса гепатита В Таксономия, морфология, антигенная структура: Семейство Picornaviridae род Hepatovirus. Типовой вид —имеет один серотип. Это РНК-содержащий вирус, просто организованный, имеет один вирусоспецифический антиген. Культивирование: Вирус выращивают в культурах клеток. Цикл репродукции более длительный, чем у энтеровирусов, цитопатический эффект не выражен. Резистентность: Устойчивостью к нагреванию; инактивируется при кипячении в течение 5 мин. Относительно устойчив во внешней среде (воде). Эпидемиология. Источник-больные. Механизм заражения — фекально-оральный. Вирусы выделяются с фекалиями в начале клинических проявлений. С появлением желтухи интенсивность выделения вирусов снижается. Вирусы передаются через воду, пищевые продукты, руки. Болеют преимущественно дети в возрасте от 4 до 15 лет. Патогенез: Обладает гепатотропизмом. После заражения репликация вирусов происходит в кишечнике, а оттуда через портальную вену они проникают в печень и реплицируются в цитоплазме гепатоцитов. Повреждение гепатоцитов возникает в результате иммунопатологических механизмов. Клиника. Инкубационный период - от 15 до 50 дней. Начало острое, с повышением т-ры и тошнотой, рвотой). Возможно появление желтухи на 5-й день. Клиническое течение заболевания легкое, без особых осложнений. Продолжительность заболевания 2 нед. Хронические формы не развиваются. Иммунитет. После инфекции - стойкий пожизненный иммунитет, связанный с IgG. В начале заболевания в крови IgM, которые сохраняются в организме в течение 4 месяцев и имеют диагностическое значение. Помимо гуморального, развивается и местный иммунитет в кишечнике. Микробиологическая диагностика. Материал для исследования - сыворотка и испражнения. Диагностика основана главным образом на определении в крови IgM с помощью ИФА, РИА и иммунной электронной микроскопии. Этими же методами можно обнаружить вирусный антиген в фекалиях. Вирусологическое исследование не проводят. Лечение. Симптоматическое. Профилактика. Неспецифическая профилактика. Для специфической пассивной профилактики используют иммуноглобулин. Иммунитет сохраняется около 3 мес. Для специфической активной профилактики – инактивированная культуральная концентрированная вакцина. Рекомбинантная генно – инженерная вакцина.
|
4. Морфология и структура вируса герпеса ВПГ вызывает герпетическую инфекцию, или простой герпес, характеризующийся везикулезными высыпаниями на коже, слизистых оболочках, поражением ЦНС и внутренних органов, а также пожизненным носительством (персистенцией) и рецидивами болезни. Таксономия. Семейство Herpesviridae. Род Simplexvirus. Структура. Геном ВПГ кодирует около 80 белков, необходимых для репродукции вируса и взаимодействия последнего с клетками организма и иммунным ответом. ВПГ кодирует 11 гликопротеинов, являющихся прикрепительными белками (gB, gC, gD, gH), белками слияния (gB), структурными белками, иммунными белками «уклонения» (gC, gE, gl). Вирус вызывает литические инфекции фибробластов, эпителиальных клеток и латентные инфекции нейронов. Культивирование. Для культивирования вируса применяют куриный эмбрион (на оболочке образуются мелкие плотные бляшки) и культуру клеток, на которой он вызывает цитопатический эффект в виде появления гигантских многоядерных клеток с внутриядерными включениями. Антигенная структура. Вирус содержит ряд антигенов, связанных как с внутренними белками, так и с гликопротеидами наружной оболочки. Последние являются основными иммуногенами, индуцирущими выработку антител и клеточный иммунитет. Существует два серотипа: ВПГ 1 типа и ВПГ 2 типа. Резистентность. Вирус нестоек, чувствителен к солнечным и УФ-лучам. Эпидемиология. Источник инфекции — больной. ВПГ-1 и ВПГ-2 передаются преимущественно контактным путем (с везикулярной жидкостью, со слюной, половых контактах), через предметы обихода, реже — воздушно-капельным путем, через плаценту, при рождении ребенка. Оба типа вирусов могут вызывать оральный и генитальный герпес. ВПГ-1 чаще поражает слизистые оболочки ротовой полости и глотки, вызывает энцефалиты, а ВПГ-2 — гениталии (генитальный герпес). Патогенез. Различают первичный и рецидивирующий простой герпес. Чаще вирус вызывает бессимптомную или латентную инфекцию. Первичная инфекция. Везикула —проявление простого герпеса с дегенерацией эпителиальных клеток. Основу везикулы составляют многоядерные клетки. Пораженные ядра клеток содержат эозинофильные включения. Верхушка везикулы через некоторое время вскрывается, и формируется язвочка, которая вскоре покрывается струпом с образованием корочки с последующим заживлением. Минуя входные ворота эпителия, вирусы проходят через чувствительные нервные окончания с дальнейшим передвижением нуклеокапсидов вдоль аксона к телу нейрона в чувствительных ганглиях. Репродукция вируса в нейроне заканчивается его гибелью. Некоторые вирусы герпеса, достигая ганглионарных клеток, способны приводить к развитию латентной инфекции, при которой нейроны не гибнут, но содержат в себе вирусный геном. Большинство людей (70-90 %) являются пожизненными носителями вируса, который сохраняется в ганглиях, вызывая в нейронах латентную персистирующую инфекцию. Латентная инфекция чувствительных нейронов является характерной особенностью нейротропных герпесвирусов ВПГ. В латентно инфицированных нейронах около 1 % клеток в пораженном ганглии несет вирусный геном. Клиника. Инкубационный период 2—12 дней. Болезнь начинается с возникновения на пораженных участках зуда, появления отека и пузырьков, заполненных жидкостью. ВПГ поражает кожу (везикулы, экзема), слизистые оболочки рта, глотки (стоматит) и кишечника, печень (гепатиты), глаза (кератит) и ЦНС (энцефалит). Рецидивирующий герпес обусловлен реактивацией вируса, сохранившегося в ганглиях. Он характеризуется повторными высыпаниями и поражением органов и тканей. Генитальная инфекция является результатом аутоинокуляции из других пораженных участков тела; но наиболее часто встречающийся путь заражения — половой. Поражение проявляется в образовании везикулы, которая довольно быстро изъязвляется. Вирус простого герпеса проникает во время прохождения новорожденного через родовые пути матери, вызывая неонаталъный герпес. Неонатальный герпес обнаруживается на 6-й день после родов. Вирус диссеминирует во внутренние органы с развитием генерализованного сепсиса. Иммунитет. Основной иммунитет— клеточный. Развивается ГЗТ. NK-клетки играют важную роль в ранней противомикробной защите. Организм пораженного реагирует на гликопротеины вируса, продуцируя цитотоксические Т-лимфоциты, а также Т-хелперы, активирующие В-лимфоциты с последующей продукцией специфических антител. Гликопротеины вызывают образование вируснейтрализующих антител. Вирус - нейтрализующие антитела подавляют межклеточное распространение вирусов. Микробиологическая диагностика. Используют содержимое герпетических везикул, слюну, соскобы с роговой оболочки глаз, кровь, спинномозговую жидкость. Вирусологическая диагностика основана на выделении вируса путем введения исследуемого материала (содержимое везикул, слюна, смывы из глотки) в мозг белым мышам, на роговицу кролика и на хорион-аллантоисную оболочку куриных эмбрионов. О наличии вируса судят по внутриядерным включениям в пораженных клетках, специфичность определяют в реакции нейтрализации. При исследовании парных сывороток больного определяют нарастание титра антител. Меры профилактики не разработаны. Для выделения вируса исследуемым материалом заражают клетки HeLa, Нер-2, человеческие эмбриональные фибробласты. Рост в культуре клеток проявляется округлением клеток с последующим прогрессирующим поражением всей культуры клеток. Заражают также куриные эмбрионы, у которых после внутримозгового заражения развивается энцефалит. Выделенный вирус идентифицируют в РИФ и ИФА с использованием моноклональных антител. Серодиагностику проводят с помощью РСК, РИФ, ИФА и реакции нейтрализации по нарастанию титра антител больного. ИБ также способен выявлять типоспецифические антитела. При экспресс-диагностике в мазках-отпечатках из высыпаний, окрашенных по Романовскому-Гимзе, выявляются гигантские многоядерные клетки с внутриядерными включениями. Для идентификации вируса используют также амплификацию генов вирусной ДНК в реакции ПЦР. Лечение. Для лечения применяют препараты интерферона, индукторы интерферона и противовирусные химиотерапевтические препараты (ацикловир, видарабин). Профилактика. Специфическая профилактика рецидивирующего герпеса осуществляется в период ремиссии многократным введением инактивированной культуральной герпетической вакцины |
12. Вирусологическая диагностика вирусных инфекций Методы индикации вирусов: a. О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически по морфологическим изменениям клеток. Часть таких клеток погибает и отслаивается от стенок пробирки. Вирусные частицы, освобождающиеся при разрушении одних клеток, инфицируют другие, которые через некоторое время также погибают. В результате вместо сплошного клеточного монослоя остаются лишь отдельные клеточные островки. b. Некоторые вирусы можно обнаружить и идентифицировать по включениям , которые они образуют в ядре или цитоплазме заражённых клеток. c. ЦПД вирусов можно также продемонстрировать с помощью «цветной пробы»: метаболически активные клетки культуры в ходе жизнедеятельности выделяют кислые продукты, что вызывает изменение индикаторов, присутствующего в культуральной среде. d. Реакция гемадсорбции применяют для индикации гемагглютинирующих вирусов. Реакция основана на способности поверхности клеток, в которых репродуцируются такие вирусы, адсорбировать эритроциты. Для постановки реакции гемадсорбции в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты. e. Реакцию гемагглютинации (РГА) применяют для обнаружения гемагглютинирующих вирусов в культуральной жидкости зараженной культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Для постановки РГА к исследуемому материалу добавляют взвесь эритроцитов. В присутствие вирусов происходит агглютинация эритроцитов. Результаты реакции учитывают через 40 минут после оседания эритроцитов: (+) - выраженная гемагглютинация-тонкая пленка склеившихся эритроцитов на дне пробирки, имеющая вид зонтика, (-) – резко очерченный осадок эритроцитов. f. Более точным количественным методом учета отдельных вирусных частиц является метод бляшек. Культуру клеток заражают вирусом и покрывают тонким слоем агара. После инкубирования посевов в течение суток на поверхности агара появляются просветленные участки определенной формы (бляшки), представляющие собой участки погибших клеток в сплошном монослое культуры клеток. Титр вируса, установленный этим методом, выражают числом бляшкообразующих единиц (БОЕ) в 1 мл. Методы идентификации вирусов: Реакция связывания комплемента Реакция протекает в две фазы. Первая фаза - взаимодействие антигена и антител при обязательном участии комплемента. Вторая - выявление результатов реакции при помощи индикаторной гемолитической системы (эритроциты барана и гемолитическая сыворотка). Разрушение эритроцитов гемолитической сывороткой происходит только в случае присоединения комплемента к гемолитической системе. Если же комплемент адсорбировался ранее на комплексе антиген-антитело, то гемолиз эритроцитов не наступает. Результат опыта оценивают, отмечая наличие или отсутствие гемолиза во всех пробирках. Реакцию считают положительной при полной задержке гемолиза, когда жидкость в пробирке бесцветна и эритроциты оседают на дно, отрицательной - при полном лизисе эритроцитов, когда жидкость интенсивно окрашена («лаковая» кровь). Степень задержки гемолиза оценивают в зависимости от интенсивности окраски жидкости и величины осадка эритроцитов на дне (++++, +++, ++, +). Реакция торможения гемагглютинации Принцип реакции основан на способности АТ связывать различные вирусы и нейтрализовать их, лишая возможности агглютинировать эритроциты. Визуально этот эффект и проявляется в «торможении» гемагглютинации. РТГА применяют при диагностике вирусных инфекций для выявления специфических антигемагглютининов и идентификации различных вирусов по их гемагглютининам, проявляющим свойства Аг. Реакция пассивной (непрямой) гемагглютинации Под непрямой, или пассивной, агглютинацией понимают реакцию, в которой антитела взаимодействуют с антигенами, предварительно адсорбированными на инертных частицах. В реакции пассивной гемагглютинации (РПГА) в качестве носителя используют эритроциты. Нагруженные антигеном эритроциты склеиваются в присутствии специфических антител к данному антигену и выпадают в осадок. Постановка. В лунках полистироловых планшетов готовят ряд последовательных разведений сыворотки. В предпоследнюю лунку вносят - 0,5 мл заведомо положительной сыворотки и в последнюю 0,5 мл физиологического раствора (контроли). Затем во все лунки добавляют по 0,1 мл разведенного эритроцитарного диагностикума, встряхивают и помещают в термостат на 2 ч. Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном - оседают в виде пуговки или колечка.
14. Морфология и антигенная структура вируса гепатита А Вирус гепатита В - семейство Hepadnaviridae род Orthohepadnavirus. Морфология: ДНК-содержаший вирус сферической формы. Состоит из сердцевины, состоящей из 180 белковых частиц, составляющих сердцевинный НВс-антиген и липидсодержащей оболочки, содержащей поверхностный HBs-антиген. Внутри сердцевины находятся ДНК, фермент ДНК-полимераза, обладающая ревертазной активностью, и концевой белок НВе-антиген. Геном представлен двунитевой ДНК кольцевой формы. Культуральные свойства. Не культивируется на куриных эмбрионах, не обладает гемолитической и гемагглютинирующей активностью. ВГВ культивируется только в культуре клеток. Резистентность. Высокая к факторам окружающей среды и дезинфицирующим веществам. Вирус устойчив к длительному воздействию кислой среды, УФ-излучению, действию спирта, фенола. Антигенная структура. Сложная. В суперкапсиде вируса находится HBs-антиген, который локализован в гидрофильном слое на поверхности вириона. В формировании HBs-антигена участвуют 3 полипептида в гликозилированной форме:preSl — большой полипептид; preS2 — средний полипептид; S — малый полипептид. Эпидемиология: Развитие инфекционного процесса при попадании в кровь. Заражение происходит при парентеральных манипуляциях (инъекциях, хирургических вмешательствах), переливании крови. Патогенез и клиника заболевания. Инкубационный период 3—6 месяцев. Инфекционный процесс наступает после проникновения вируса в кровь. ВГВ из крови эндоцитозом проникает в гепатоцит. После проникновения вируса происходит достраивание плюс-нити ДНК ДНК-полимеразой до полноценной структуры. Клиническая картина характеризуется симптомами поражения печени, в большинстве случаев сопровождается развитием желтухи. Иммунитет. Гуморальный иммунитет, представленный антителами к HBs-антигену, защищает гепатоциты от вируса, элиминируя его из крови. Клеточный иммунитет освобождает организм от инфицированных гепатоцитов благодаря цитолитической функции Т-киллеров. Переход острой формы в хроническую обеспечивается нарушением Т-клеточного иммунитета. Микробиологическая диагностика. Используют серологический метод и ПЦР. Методами ИФА и РНГА в крови определяют маркеры гепатита В: антигены и антитела. ПЦР определяют наличие вирусной ДНК в крови и биоптатах печени. Для острого гепатита характерно обнаружение HBs антигена, НВе антигена и анти-HBc-IgM антитела. Лечение. Использование интерферона, интерфероногенов: виферона, амиксина, ингибитора ДНК-полимеразы, препарата аденинрибонозида. Профилактика. Исключение попадания вируса при парентеральных манипуляциях и переливаниях крови (применением одноразовых шприцев, проверкой на гепатит В по наличию HBs-антигена в крови доноров крови). Специфическая профилактика осуществляется вакцинацией рекомбинантной генно-инженерной вакциной, содержащей HBs-антиген. Вакцинации подлежат все новорожденные в первые 24 часа жизни. Длительность поствакцинального иммунитета — не менее 7 лет.
|
|
Вирусные гепатиты - группа инфекционных заболеваний, характеризующихся преимущественным поражением печени. Вирусный гепатит А. Ни рус гепатита A (HAV) относится к семейству Picornaviridae. Мелкий PНК содержащий, с кубическим типом симметрии, не имеет суперкапсидной оболочки. Источник инфекции: больной человек. Путь заражения: алиментарный (через инфицированные пищевые продукты И воду)Группы риска: дети и молодые люди в организованных коллективах. Патогенез и клиника. Вирус поражает гепатоциты по типу острой продуктивной инфекции с гибелью плеток и развитием диффузного воспалительного процесса в печени. Клинические формы: 1. Острая желтушная (общая интоксикация, желтушность кожных покровов и склер, гепатоспленомегалия); 2. Острая безжелтушная; 3. Инаппарантная. После клинического выздоровления хронический гепатит и вирусоноси- тельство не формируются. Микробиологическая диагностика: Основным методом является серологический: 1. ИФА - для определения в сыворотке крови IgM к вирусу гепатита А на ранних стадиях болезни. 2. ИФА - Для определение IgG a парных пробах сыворотки крови к HAV. Диагностическим является 4-кратное нарастание тира антител. Вирусологическая диагностика. Основывается на клинической картине заболевания и определении сывороточных ферментов в крови, прежде всего аланинаминотрансферазы (АЛАТ). Увеличение ее активности позволяет выявить стертые, бессимптомные и безжелтушные формы. Преимущественно в первые 10 дней болезни в сыворотке крови повышена активность сывороточного фермента крови — альдолазы. При инфекционном гепатите нарушена функция печени в пигментном обмене: в моче определяются желчные пигменты, в крови увеличено количество билирубина. Используют также белковые или осадочные реакции сыворотки крови: сулемовую и тимоловую пробы. В специальных лабораториях проводят серологические исследования для определения HAV-антигена или антител к нему (анти-НАУ-антитела) с помощью РСК, иммунной гемагглютинации и радиоиммунологического метода. Вирус выявляют в фекалиях, а антитела — в сыворотке крови. Специфическая профилактика вирусного гепатита А: 1. Плановая (активная) - инактивированная культуральная вакцина («ГЕП-А-ин-ВАК», Россия); 2. Экстренная (пассивная) - иммуноглобулин нормальный человеческий. Проводится лицам, контактировавшим с больными HAV-инфекцией. Вирусный гепатит В. Вирус гепатита В (HBV) (частицы Дейна) относится к семейству Hepadnaviridae. ДНК-содержащий, сферической формы, имеет двухслойную суперкапсидную оболочку. Антигены вируса гепатита В: 1. HBsAg - поверхностный (австралийский) антиген, который обнаруживается в крови больных, а также слюне, моче, сперме, влагалищном секрете. HBsAg обладает выраженной иммуногенностью и является рецептором для адсорбции вируса на гепатоцитах; 2. HBcAg - «сердцевинный антиген», представлен нуклеокапсидом. Обнаруживается только в ядрах гепатоцитов. В крови больных не определяется; 3. HBeAg - секретируемая растворимая часть HBcAg. Обнаруживается только в крови больных одновременно с HBsAg и свидетельствует об активной репликации вируса. Hbe Ag - маркер высокой инфекционности крови; 4.HBxAg - появляется при злокачественной трансформации гепатоцитов и участвует и этом процессе. Вирус обладает чрезвычайно высокой устойчивостью во внешней среде. Для его уничтожении требуется автоклавирование при давлении 1,5 атм в течении 40минут. Источник инфекции: больной человек или вирусоноситель. Пути заражения: 1.Парентеральный (основной) - при переливании: крови и ее препаратов, при инъекциях, зубоврачебных манипуляциях. 2.Половой (через сперму и влагалищный секрет). 3.Интранатальный (во время родов), значительно реже - трансплацентарный 4.Трансплантационный - при пересадке костного мозга, сердца и других органов. Контингенты высокого риска заражения гепатитом В такие же, как при ВИЧ-инфекции. Патогенез: вирус гепатита В размножается в гепатоцитах без цитопатогенного действия на эти клетки (хроническая продуктивная инфекция). Гибель гепатоцитов происходит под действием цитотоксических Т-лимфоцитов, а также вследствие аутоиммунных реакций. Клинические формы гепатита В: 1)Острая - может протекать как с клиническими проявлениями (желтушный и безжелтушный варианты), так и без них (инаппарантная форма); 2)Хроническая (у 10-15% больных) - формируется в результате интегративной вирусной инфекции и проявляется рецидивирующей симптоматикой с нарушениями функции печени в периоды репликации вируса. У 10-40% больных возникают осложнения в виде цирроза печени или первичной гепатокарциномы. Микробиологическая диагностика: I. ИФА - для определения HBs- и Нbе-антигенов в крови больного. Показателем активной репликации вируса (при острой инфекции и рецидиве хронической формы) является одновременное присутствие в крови HBs- и Hbе-антигенов. При хронической форме, в стадии ремиссии, в крови длительно и стабильно обнаруживается только HBs-антиген. 2. Генетический метод (ПЦР) - определение ДНК вируса гепатита B в крови обследуемого. Обнаружение вирусной ДНК свидетельствует об активной репликации HBV. 3. Cерологический (ИФА) - определение IgM к НВс-антигену. Обнаружение этого класса антител подтверждает диагноз острой формы заболевания. Специфическая профилактика гепатита В: 1)Плановая (активная): - рекомбинантная дрожжевая вакцина (Россия) - содержит HBsAg: 2) Экстренная (пассивная): - иммуноглобулин человеческий против гепатита B. Вирусологическая диагностика. Диагноз сывороточного гепатита основан на эпидемиологических, клинико-лабораторных данных и обнаружении австралийского антигена. Поверхностный (австралийский) антиген в сыворотке крови может быть найден уже в инкубационном периоде и исчезает в стадии выздоровления. У носителей он может обнаруживаться в течение нескольких лет. Для выявления антигена используют серологические методы: реакцию иммунопреципитации в геле (РПГ), метод встречного электроиммунофореза (ВИЭФ), РСК, РПГА, метод флюоресцирующих антител, радиоиммунологический метод. Все реакции основаны на взаимодействии антигена со специфической сывороткой. Вирусный гепатит С Вирус гепатита С (HCV) относится к семейству Flaviviridae. РНК- содержащий, сферической формы, имеет суперкапсидную оболочку: Включает 6 антигенных типов. Из всех возбудителей вирусных гепатитов HCV подвержен наибольшей генетической изменчивости под действием различных факторов, в т.ч. и медикаментов. Источник инфекции: больной человек или вирусоноситель. Пути заражения как при гепатите В: передача вируса в основном происходит парентерально (при инъекциях и гемотрансфузиях). Каждый второй пациент с HCV-инфекцией относится к лицам, вводившим внутривенно наркотики (гепатит наркоманов). Клиническое течение: В связи с высоким уровнем генетической изменчивости в течение заболевания, HCV «ускользает» от иммунного надзора организма. Эта особенность определяет значительное количество (до 85%) хронических форм заболевания. Острое заболевание протекает, как .правило, в виде стертой или бессимптомной (инаппарантной) форм. Осложнениями течения гепатита С являются цирроз печени, реже гепатокарцинома. Микробиологическая диагностика: 1)Серологический (ИФА) - для определения IgM к HСV в сыворотке больного. 2) Генетический метод (ПЦР) - определение РНК вируса гепатита с в крови больного. Специфическая профилактика и специфическое лечение не разработаны.
|
15, 24 Морфология и антигенная структура вирусов Коксаки и ЕСНО Морфология. характеризуются небольшими размерами вириона (28 нм — вирус Коксаки, 10—15 нм — ECHO), кубической симметрией, способностью образовывать кристаллы внутри пораженных клеток. РНК однонитчатая, составляет 20—30% вириона, капсид голый. Устойчивы к эфиру. Некоторые типы энтеровирусов агглютинируют эритроциты человека 0-группы или эритроциты кур. Антигенная структура. Вирусы Коксаки по антигенной структуре делят на две группы: А и В. Группа А содержит 26, а группа В — 6 серологических типов. Вирусы ECHO разделены на 32 серотипа. Вирусологическая диагностика. Материалом для исследования служат испражнения больных в течение первой недели, смывы из носоглотки не позднее третьего дня, кровь, ликвор, моча не позднее пятого дня, сыворотка крови в первый и 14 дня; в случае смерти - кусочки мозга, внутренних органов, лимфоузлы. Большинство цитопатогенных вирусов выделяют в первичных культурах тканей обезьян и человека, а некоторые — в культурах перевиваемых клеток Нер-2, FL, HLS или Детройт-6. Вирусы Коксаки А с трудом адаптируются к культуре тканей. Тип энтеровируса определяют в РНА на культуре клеток или новорожденных мышах, используя специфические нейтрализующие сыворотки. новорожденных белых мышей позволяет дифференцировать энтеровирусы по клинике: Коксаки А — вялые парадичи без энцефалитов, Коксаки В - судороги и параличи. Но одного выделения вируса для постановки диагноза недостаточно, так как возможно носительство энтеровирусов при другом заболевании. Поэтому диагноз более достоверен при выделении вируса и при исследовании парных сывороток больного, взятых в ранней острой стадии болезни и в период реконвалесценции. Серологическая диагностика: - РСК, РН – для определения антител в парных пробах сыворотки больного. Диагностическим являеся 4-кратное нарастание титра антител у взрослых и 2-кратное – у детей. Специфическая профилактика и лечение не разработаны.
16.Морфология и антигенная структура ретровируса - ВИЧ Вирус иммунодефицита человека вызывает ВИЧ-инфекцию, заканчивающуюся развитием синдрома приобретенного иммунного дефицита. Возбудитель ВИЧ-инфекции — лимфотропный вирус, относящийся к семейству Retroviridae роду Lentivirus. Морфологические свойства: РНК-содержащий вирус. Вирусная частица сферической формы Оболочка состоит из двойного слоя липидов, пронизанного гликопротеинами. Липидная оболочка происходит из плазматической мембраны клетки хозяина, в которой репродуцируется вирус. Гликопротеиновая молекула состоит из 2 субъединиц, находящихся на поверхности вириона и пронизывающих его липидную оболочку. Сердцевина вируса конусовидной формы, состоит из капсидных белков, ряда матриксных белков и белков протеазы. Геном образует две нити РНК, для осуществления процесса репродукции ВИЧ имеет обратную транскриптазу, или ревертазу. Геном вируса состоит из 3 основных структурных генов и 7 регуляторных и функциональных генов. Функциональные гены выполняют регуляторные функции и обеспечивают осуществление процессов репродукции и участие вируса в инфекционном процессе. Вирус поражает в основном Т- и В-лимфоциты, некоторые клетки моноцитарного ряда (макрофаги, лейкоциты), клетки нервной системы. Культуральные свойства: на культуре клеток Т-лимфоцитов и моноцитов человека (в присутствии ИЛ-2). Антигенная структура: 2 типа вируса — ВИЧ-1 и ВИЧ-2 ВИЧ-1, имеет более 10 генотипов (субтипов): А, В, С, D, E, F…, отличающихся между собой по аминокислотному составу белков. ВИЧ-1 делят на 3 группы: М, N, О. Большинство изолятов относится к группе М, в которой выделяют 10 подтипов: А, В, С, D, F-l, F-2, G, Н, I, К. Устойчивость: Чувствителен к физическим и химическим факторам, гибнет в при нагревании. Вирус может длительно сохраняться в высушенном состоянии, в высохшей крови. Факторы патогенности, патогенез: Вирус прикрепляется к лимфоциту, проникает в клетку и репродуцирует в лимфоците. В результате размножения ВИЧ в лимфоците последние разрушаются или теряют свои функциональные свойства. В результате размножения вируса в различных клетках происходит накопление его в органах и тканях, и он обнаруживается в крови, лимфе, слюне, моче, поте, каловых массах. При ВИЧ-инфекции снижается число Т-4-лимфоцитов, нарушается функция В-лимфоцитов, подавляется функция естественных киллеров и ответ на антигены снижается и нарушается продукция комплемента, лимфокинов и других факторов, регулирующих иммунные функции (ИЛ), в результате чего наступает дисфункция иммунной системы. Клиника: поражается дыхательная система (пневмония, бронхиты); ЦНС (абсцессы, менингиты); ЖКТ (диареи), возникают злокачественные новообразования (опухоли внутренних органов). ВИЧ-инфекция протекает в несколько стадий: 1) инкубационный период, составляющий в среднем 2—4 недели; 2) стадия первичных проявлений, характеризующаяся вначале острой лихорадкой, диареей; завершается стадия бессимптомной фазой и персистенцией вируса, восстановлением самочувствия, однако в крови определяются ВИЧ-антитела, 3) стадия вторичных заболеваний, проявляющихся поражением дыхательной, нервной системы. Завешается ВИЧ-инфекция последней, 4-й терминальной стадией- СПИДом. Микробиологическая диагностика. Вирусологические и серологические исследования включают методы определения антигенов и антител ВИЧ. Для этого используют ИФА, ИБ и ПЦР. Сыворотки больных ВИЧ-1 и ВИЧ-2 содержат антитела ко всем вирусным белкам. Однако для подтверждения диагноза определяют антитела к белкам gp41, gpl20, gpl60, p24 у ВИЧ-1 и антитела к белкам gp36, gpl05, gpl40 у ВИЧ-2. ВИЧ-антитела появляются через 2—4 недели после инфицирования и определяются на всех стадиях ВИЧ. Метод выявления вируса в крови, лимфоцитах. Однако при любой положительной пробе для подтверждения результатов ставится реакция ИБ. Применяют также ПЦР, способную выявлять ВИЧ-инфекцию в инкубационном и раннем клиническом периоде, однако ее чувствительность несколько ниже, чем у ИФА. Клинический и серологический диагнозы подтверждаются иммунологическими исследованиями, если они указывают на наличие иммунодефицита у обследуемого пациента. Диагностическая иммуноферментная тест-система для определения антител к ВИЧ – включает вирусный АГ, адсорбированный на носителе, АТ против Ig человека. Используется для серодиагностики СПИДа. Лечение: применение ингибиторов обратной транскриптазы, действующих в активированных клетках. Препараты являются производные тимидина — азидотимидин и фосфазид. Профилактика. Специфическая - нет. |
18.Особенности противовирусного иммунитета. Основой противовирусного иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные вирусом, уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к вирусспецифическим белкам инфицированной клетки. Противовирусные антитела способны нейтрализовать только внеклеточно расположенные вирусы, как и факторы неспецифического иммунитета — сывороточные противовирусные ингибиторы. Такие вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами или выводятся с мочой, потом и др. (так называемый «выделительный иммунитет»). Интерфероны усиливают противовирусную резистентность, индуцируя в клетках синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов. Кроме этого, интерфероны оказывают иммуномодулирующее действие, усиливают в клетках экспрессию антигенов главного комплекса гистосовместимости (МНС). Противовирусная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с вирусами, препятствуют их адгезии на эпителиоцитах.
19.Химический состав вирионов. Вирусная РНК и ДНК Простые вирусы состоят из белка и нуклеиновый кислоты. Наиболее важная часть вирусной частицы -нуклеиновая кислота - является носителем генетической информации. У вирусов обнаружен лишь один тип - или ДНК, или РНК, что положено в основу их классификации. Второй обязательный компонент вириона - белкиотличаются у разных вирусов, что позволяет распознавать их с помощью иммунологических реакций. Более сложные по структуре вирусы, кроме белков и нуклеиновых кислот, содержат углеводы, липиды. Для каждой группы вирусов характерен свой набор белков, жиров, углеводов и нуклеиновых кислот. Некоторые вирусы содержат в своём составе ферменты. Каждый компонент вирионов имеет определённые функции: белковая оболочка защищает их от неблагоприятных воздействий, нуклеиновая кислота отвечает за наследственные и инфекционные свойства и играет ведущую роль в изменчивости вирусов, а ферменты участвуют в их размножении. Обычно нуклеиновая кислота находится в центре вириона и окружена белковой оболочкой (капсидом), как бы одета в неё. Капсид состоит из определённым образом уложенных однотипных белковых молекул (капсомеров), которые образуют симметричные геометрические формы в месте с нуклеиновой кислотой вирусы (нуклеокапсид). В случае кубической симметрии нуклеокапсида нить нуклеиновой кислоты свёрнута в клубок, а капсомеры плотно уложены вокруг неё. различают ДНК-содержащие и РНК-содержащие вирусы. Они обычно гаплоидны, т.е. имеют один набор генов. Геном вирусов представлен различными видами нуклеиновых кислот: двунитчатыми, однонитчатыми, линейными, кольцевыми, фрагментированными. Среди РНК-содержащих вирусов различают вирусы с положительным (плюс-нить РНК) геномом. Плюс-нить РНК этих вирусов выполняет наследственную функцию и функцию информационной РНК (иРНК). Имеются также РНК-содержащие вирусы с отрицательным (минус-нить РНК) геномом. Минус-нить РНК этих вирусов выполняет только наследственную функцию. Геном вирусов способен включаться в состав генетического аппарата клетки в виде провируса, проявляя себя генетическим паразитом клетки. Нуклеиновые кислоты некоторых вирусов (вирусы герпеса и др.) могут находиться в цитоплазме инфицированных клеток, напоминая плазмиды.
34.Интерферон. Характеристика препарата. Механизм действия. Интерферон относится к важным защитным белкам иммунной системы. Открыт при изучении интерференции вирусов, т. е. явления, когда животные или культуры клеток, инфицированные одним вирусом, становились нечувствительными к заражению другим вирусом. Оказалось, что интерференция обусловлена образующимся при этом белком, обладающим защитным противовирусным свойством. Этот белок назвали интерфероном. Интерферон представляет собой семейство белков-гликопротеидов, которые синтезируются клетками иммунной системы и соединительной ткани. В зависимости от того, какими клетками синтезируется интерферон, выделяют три типа: α, β и γ-интерфероны. Альфа-интерферон вырабатывается лейкоцитами и он получил название лейкоцитарного; бета-интерферон называют фибробластным, поскольку он синтезируется фибробластами — клетками соединительной ткани, а гамма-интерферон — иммунным, так как он вырабатывается активированными Т-лимфоцитами, макрофагами, естественными киллерами, т. е. иммунными клетками. Интерферон синтезируется в организме постоянно, и его концентрация в крови держится на уровне примерно 2 МЕ/мл (1 международная единица — ME — это количество интерферона, защищающее культуру клеток от 1 ЦПД50 вируса). Выработка интерферона резко возрастает при инфицировании вирусами, а также при воздействии индукторов интерферона, например РНК, ДНК, сложных полимеров. Такие индукторы интерферона получили название интерфероногенов. Помимо противовирусного действия интерферон обладает противоопухолевой защитой, так как задерживает пролиферацию (размножение) опухолевых клеток, а также иммуномодулирующей активностью, стимулируя фагоцитоз, естественные киллеры, регулируя антителообразование В-клетками, активируя экспрессию главного комплекса гистосовместимости. Механизм действия интерферона сложен. Интерферон непосредственно на вирус вне клетки не действует, а связывается со специальными рецепторами клеток и оказывает влияние на процесс репродукции вируса внутри клетки на стадии синтеза белков. Применение интерферона. Действие интерферона тем эффективнее, чем раньше он начинает синтезироваться или поступать в организм извне. Поэтому его используют с профилактической целью при многих вирусных инфекциях, например гриппе, а также с лечебной целью при хронических вирусных инфекциях, таких как парентеральные гепатиты (В, С, D), герпес, рассеянный склероз и др. Интерферон дает положительные результаты при лечении злокачественных опухолей и заболеваний, связанных с иммунодефицитами. Интерфероны обладают видоспецифичностью, т. е. интерферон человека менее эффективен для животных и наоборот. Однако эта видоспецифичность относительна. Получение интерферона. Получают интерферон двумя способами: а) путем инфицирования лейкоцитов или лимфоцитов крови человека безопасным вирусом, в результате чего инфицированные клетки синтезируют интерферон, который затем выделяют и конструируют из него препараты интерферона; б) генно-инженерным способом — путем выращивания в производственных условиях рекомбинантных штаммов бактерий, способных продуцировать интерферон. Обычно используют рекомбинантные штаммы псевдомонад, кишечной палочки со встроенными в их ДНК генами интерферона. Интерферон, полученный генно-инженерным способом, носит название рекомбинантного. В нашей стране рекомбинантный интерферон получил официальное название «Реаферон». Производство этого препарата во многом эффективнее и дешевле, чем лейкоцитарного. Рекомбинантный интерферон нашел широкое применение в медицине как профилактическое и лечебное средство при вирусных инфекциях, новообразованиях и при иммунодефицитах. |
|
Вакцина — медицинский препарат, предназначенный для создания иммунитета к инфекционным болезням. Классификации вакцин: 1.Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Примером таких вакцин являются БЦЖ и вакцина против натуральной оспы человека, в качестве которой используется непатогенный для человека вирус оспы коров. 2.Инактивированные (убитые) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). В препараты иногда добавляют консерванты и адьюванты. Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант. Корпускулярные вакцины – содержащие в своем составе протективный антиген 3.Анатоксины относятся к числу наиболее эффективных препаратов. Принцип получения – токсин соответствующей бактерии в молекулярном виде превращают в нетоксичную, но сохранившую свою антигенную специфичность форму путем воздействия 0.4% формальдегида при 37t в течение 3-4 недель, далее анатоксин концентрируют, очищают, добавляют адьюванты. 4.Синтетические вакцины. Молекулы эпитопов сами по себе не обладают высокой иммуногенностью для повышения их антигенных свойств эти молекулы сшиваются с полимерным крупномолекулярным безвредным веществом, иногда добавляют адьюванты. 5.Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов. Требования, предъявляемые к современным вакцинам: Иммуногенность; Низкая реактогенность (аллергенность); Не должны обладать тератогенностью, онкогенностью; Штаммы, из которых приготовлена вакцина, должны быть генетически стабильны; Длительный срок хранения; Технологичность производства; Простота и доступность в применении. |
Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Аттенуация (ослабление) возможна путём воздействия на штамм химических (мутагены) и физических (температура) факторов или посредством длительных пассажей через невосприимчивый организм. Так же в качестве живых вакцин используются дивергентные штаммы (непатогенные для человека), имеющие общие протективные антигены с патогенными для человека микробами. Примером такой вакцины является БЦЖ и вакцина против натуральной оспы. Возможно получение живых вакцин генно-инженерным способом. Принцип получения таких вакцин сводится к созданию непатогенных для человека рекмбинантных штаммов, несущих протективные антигены патогенных микробов и способных при введении в орг. человека размножаться и создавать иммунитет. Такие вакцины называют векторными. Вне зависимости от того, какие штаммы включены в вакцины, бактерии получают путём выращивания на искусственных питательных средах, культурах клеток или куриных эмбрионах. В живую вакцину, как правило, добавляют стабилизатор, после чего подвергают лиофильному высушиванию. В связи с тем, что живые вакцины способны вызывать вакцинную инфекцию (живые аттенуированные микробы размножаются в организме, вызывая воспалительный процесс проходящий без клинических проявлений), они всегда вызывают перестройку иммунобиологического статуса организма и образование специфических антител. Это так же может являться недостатком, т. к. живые вакцины чаще вызывают аллергические реакции. Вакцины данного типа, как правило, вводятся однократно. Примеры: сибиреязвенная вакцина, чумная вакцина, бруцеллёзная вакцина, БЦЖ вакцина, оспенная дермальная вакцина.
Субклеточные и субъединичные вакцины. Получение. Преимущество. Применение. Роль адъювантов. Действующим началом этого типа препаратов являются протективные антигены бактерий, полученные путем воздействия ультразвука на бактериальные клетки. Главным преимуществом данного типа вакцин является их низкая реактогеннность. Адьюванты применяются для усиления иммуногенности вакцин. В качестве адъювантов используют минеральные сорбенты (гели гидрата окиси и фосфата аммония), полимеры, и др. хим. соединения, бактерии и компоненты бактерий, липиды, вещества, вызывающие воспалительную реакцию. Они действуют на антиген и организм в целом. Действие на антиген сводится к укрупнению молекул антигена, т. е. превращению растворимых антигенов в корпускулярные, в результате чего антиген лучше захватывается иммунокомпетентными клетками. При воздействии на организм в месте инъекции адьюванты вызывают воспалительный процесс образование фиброзной капсулы, что способствует более длительному сохранению антигена в «депо» и суммации антигенных раздражений. Адьюванты так же непосредственно активируют пролиферацию В, Т и А систем иммунитета. |
Инактивированные (убитые, корпускулярные или молекулярные) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). Для выделения из бактерий и вирусов антигенных комплексов (гликопротеинов, ЛПС, белков) применяют трихлоруксусную кислоту, фенол, ферменты, изоэлектрическое осаждение. Их получают путем выращивания патогенных бактерий и вирусов на искусственных питательных средах, инактивируют, выделяют антигенные комплексы, очищают, конструируют в виде жидкого или лиофильного препарата. Преимуществом данного типа вакцин является относительная простота получения (не требуется длительного изучения и выделения штаммов). К недостаткам же относятся низкая иммуногенность, потребность в трехкратном применении и высокая реактогенность формализированных вакцин. Так же, по сравнению с живыми вакцинами, иммунитет, вызываемый ими, непродолжителен. В настоящее время применяются следующие убитые вакцины: брюшнотифозная, обогащенная Vi антигеном; холерная вакцина, коклюшная вакцина
Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант. В процессе культивирования природных патогенных микробов можно получить протективный антиген, синтезируемый этими бактериями токсин затем превращается в анатоксин, сохраняющий специфическую антигенность и иммуногенность. Анатоксины являются одним из видов молекулярных вакцин. Анатоксины – препараты, полученные из бактериальных экзотоксинов, полностью лишенные своих токсических свойств, но сохранившие антигенные и иммуногенные свойства. Получение: токсигенные бактерии выращивают на жидких средах, фильтруют с помощью бактериальных фильтров для удаления микробных тел, к фильтрату добавляют 0,4% формалина и выдерживают в термостате при 30-40t на 4 недели до полного исчезновения токсических свойств, проверяют на стерильность, токсигенность и иммуногенность. Эти препараты называются нативными анатоксинам, в настоящее время почти не используются, т. к. содержат большое количество балластных веществ, неблагоприятно влияющих на организм. Анатоксины подвергаю физической и химической очистке, адсорбируют на адъювантах. Такие препараты называются адсорбированными высокоочищенными концентрированными анатоксинами. Титрование анатоксинов в реакции фолликуляции производят по стандартной фолликулирующей атитоксической сыворотке, в которой известно количество антитоксических единиц. 1 антигенная единица анатоксина обозначается Lf, это то количество анатоксина, которое вступает в реакцию фолликуляции с 1 единицей дифтерийного анатоксина. Анатоксины применяются для профилактики и реже, для лечения токсинемических инфекций дифтерия, газовая гангрена, ботулизм, столбняк). Так же анатоксины применяются для получения антитоксических сывороток путем гипериммунизации животных. Примеры препаратов: АКДС, АДС, адсорбированный стафилококковый анатоксин, ботулинистический анатоксин, анатоксины из экзотоксинов возбудителей газовых инфекций. |
|
47. Экспресс диагностика вирусных инфекций Для экспресс-диагностики вирусных инфекций применяют серологические методы, основанные на применении стандартных противовирусных антител: 1. РИА. 2. Иммунофлюоресцентный анализ. 3. Твердофазный ИФА.
38.Противогриппозная сыворотка Одними из первых противогриппозную сыворотку в условиях производства получила P. Laidlaw с соавт. (1935) путем иммунизации лошадей фильтратом смыва дыхательных путей больных хорьков и ткани их легких. Полученная сыворотка обладала способностью нейтрализовать вирус гриппа уже после 10-минутного контакта. В настоящее время для изготовления специфической сыворотки в производственных условиях в основном также используются лошади (А. А. Смородинцев, О. Н. Шишкина, 1938; Hare, 1939; Lyons, 1944; С. Л. Хайт, А. С. Виноградова, 1944, Н. Н. Орлова, А. В. Бейлинеон, 1958; Ю. К. Петров, 1959 и др.) Вместе с этим в последнее время появились указания на возможность изготовления противогриппозной сыворотки на волах (3. Г. Пейсель, С. И. Овсянкин, 1959), ослах (В. Б. Фрейман с соавт., 1963) и даже свиньях и козах (Г. X. Шайхетс соавт., 1959). В качестве антигена применяют различные вируссодержащие взвеси. Чаще всего с этой целью используют концентрированный гриппозный антиген, полученный путем адсорбции вируса гриппа, находящегося в аллантоисной жидкости курицы, с последующей элюцией в небольшие объемы солевых растворов. При этом титр антигена в реакции гемагглютинации должен быть не ниже 1:640 (А. А. Смородинцев с соавт. 1940; Ю. К. Петров, 1959; Ю. К. Петров, В. Н. Захарина, 1960; И. Е. Алатырцева с соавт., 1965). Применяли также суспензии из легких инфицированных мышей и тела эмбриона курицы (С. Л. Хайт, А. С. Виноградова, 1944), нативную вируссодержащую аллантоисную жидкость, а также аллантоисную жидкость, диализованную через целлофановые или коллоидные мешки с титром гемаглютининов не ниже 1:320 (Ю. К. Петров, 1959). Наблюдениями ряда авторов (Ю. К. Петров и В. Н. Захарина, 1960 и др.) установлено, что аллантоисная культура вируса Аг обладает слабовыраженными антигенными свойствами и малопригодна для иммунизации лошадей, поэтому неавидные штаммы этого вируса можно сконцентрировать методом адсорбции-элюции на формалинизированных эритроцитах. Значительно усиливает антигенную активность вируса добавление к нему адъюванта типа Фрейнда (Ю. К. Петров, 1965), сорбции на фосфате кальция и хлористом кальции (Н. Н. Орлова с соавт., 1965). Важное значение в успехе получения высокоактивной противогриппозной сыворотки придается штаммам вируса гриппа. Антигены для иммунизации животных готовят на хорошо адаптированных к куриному эмбриону штаммах вируса типов А2 и В. Последние должны быть ингибиторорезистентными, обладать высокоферментативными свойствами, быть высокоиммуногенными и соответствовать по антигенной структуре преобладающим разновидностям вируса гриппа. Биологическая активность их должна быть не ниже 6,0 log. В состав антигенов входит смесь нескольких штаммов вируса гриппа каждого отдельного типа. Ю. К. Петров (1959) проводил гипериммунизацию лошадей смесью, содержащей различные количества штаммов. Одна группа животных получала антиген, состоящий из равных количеств вируса гриппа A, A1, В, С и Д. Вторая — содержала 5% антигена вируса А, 20% — A1, 40% — С, 20% — В и 15% — Д. Оказалось, что лошади в первой группе выработали специфические антитела к вирусу типа A в титре 1:800 — 1:2000, Д — 1:400— 1:800, А и В — 1:600 — 1:400 и к С — 1:80 — 1:200. Титр же антител у животных второй группы был к вирусам типа А, A1, В и Д — 1:400 — 1:1280, а к С — 1:256 — 1:300. Необходимо подчеркнуть, что в связи с легкой изменяемостью вируса гриппа, в особенности типа А, следует учитывать это явление и при появлении нового типа, в особенности когда он является доминирующим, быстро пересматривать состав антигена, используемого для гипериммунизации.
|
|
|
|
|
|
|

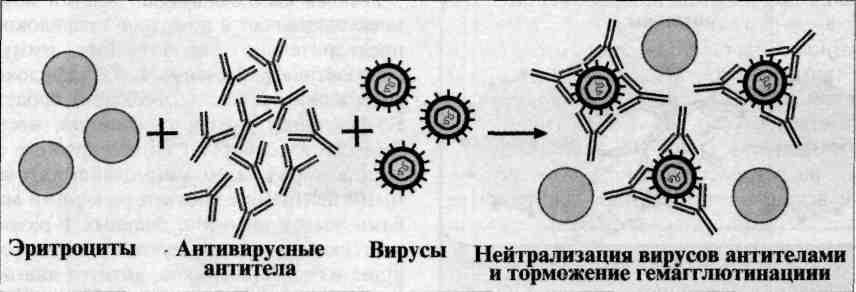
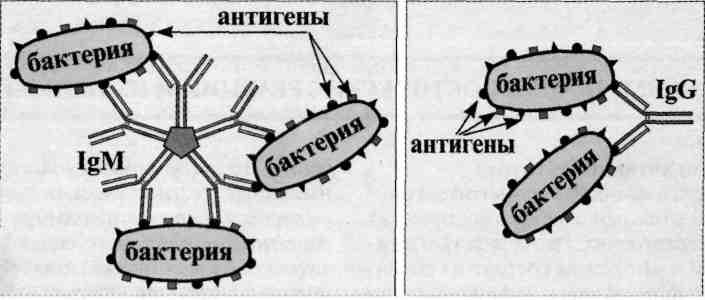
 . Морфология
и структура вирионов.
. Морфология
и структура вирионов.