
- •Теория Электролитической диссоциации
- •Сильные и слабые электролиты
- •1. Теория растворов слабых электролитов.
- •2. Теория растворов сильных электролитов.
- •Кислоты и основания
- •1. Теория Аррениуса.
- •2. Теория Бренстеда и Лоури.
- •3. Теория Льюиса.
- •Эталоны решения задач
- •В зависимости от условий ион hco3– может как отдавать протоны:
- •Таким образом, в первом случае ион hco3 является кислотой, во втором основанием, т. Е. Является амфолитом.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Шкала значений pH
- •Расчет значений рН и рОн в разбавленных растворах сильных и слабых кислот и оснований
- •Кислотно-основное равновесие биологических жидкостей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Усиление и подавление гидролиза
- •Значения рН растворов гидролизующихся солей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
- •Элементы количественного анализа
- •Объемный (титриметрический) метод анализа
- •Расчеты в объемных методах анализа Закон эквивалентов
- •Методы кислотно-основного титрования
- •Титранты и их стандартизация
- •Фиксирование точки эквивалентности
- •Механизм действия индикаторов
- •Точка перехода и интервал перехода окраски индикатора
- •Правила выбора индикатора
- •1. Титрование сильной кислоты сильным основанием.
- •3. Титрование слабого основания сильной кислотой.
- •Степень окисления. Окисление и восстановление
- •Окислители и восстановители
- •Последовательность подбора коэффициентов в уравнениях окислительно-восстановительных реакций (метод электронно-ионного баланса)
- •Оксидиметрия
- •Перманганатометрия
- •Иодометрия
- •Расчет эквивалентов окислителей и восстановителей
- •Эталоны решения задач
- •Метод нейтрализации
- •Метод оксидиметрии
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
Эталоны решения задач
1. Концентрация ионов водорода в растворе составляет 103 моль/л. Рассчитать значения pH, pOH и [ОН] в данном растворе. Определить среду раствора.
Примечание. Для вычислений используются соотношения: lg10a = a; 10lga а.
Решение.
1)
![]() ;
;
2)
![]()
3)
![]()
Среда раствора с pH 3 является кислой, так как pH 7.
2. Вычислить рН раствора соляной кислоты с молярной концентрацией 0,002 моль/л.
Решение.
Так
как в разбавленном растворе НС1
![]() 1,
а в растворе одноосновной кислоты
C(к-ты)
C(
1,
а в растворе одноосновной кислоты
C(к-ты)
C(![]() к-ты),
то можем записать:
к-ты),
то можем записать:
1) ![]() ,
,
2) ![]()
3. К
10 мл раствора уксусной кислоты с
C(![]() СН3СООН)
= 0,01 моль/л добавили 90 мл воды. Найти
разность значений pН
раствора до и после разбавления, если
СН3СООН)
= 0,01 моль/л добавили 90 мл воды. Найти
разность значений pН
раствора до и после разбавления, если
![]() (СН3СООН) 1,85105.
(СН3СООН) 1,85105.
Решение.
1) В исходном растворе слабой одноосновной кислоты СН3СООН:

Следовательно:
![]()
2) Добавление к 10 мл раствора кислоты 90 мл воды соответ-ствует 10-кратному разбавлению раствора. Поэтому:
![]()

![]()
Таким образом:
![]()
4. Найти
значение рН раствора гидроксида кальция
с молярной концентрацией эквивалента
0,002 моль/л, если
![]()
95%.
95%.
Решение.
В растворах сильных оснований:
![]()
![]()
![]()
5. рН
раствора серной кислоты с молярной
концентрацией 0,001 моль/л равен 2,72.
Найти
![]() .
.
Решение.
В растворе сильной кислоты:
![]()
Кислота двухосновная, следовательно, сначала необходимо определить молярную концентрацию эквивалента H2SO4 в растворе:

![]()
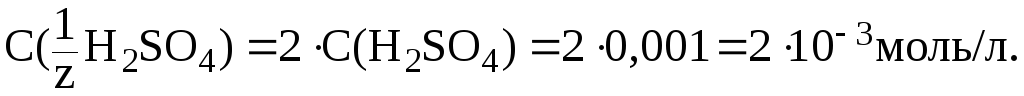
Зная величину pH раствора, можно рассчитать [H+]:
![]()
Отсюда:

6. Рассчитать
рН раствора NaOH,
если известно, что в 200 мл этого раствора
содержится 0,0004 г NaOH
(![]()
1).
1).
Решение.
В разбавленном растворе сильного основания:
![]()
Рассчитаем
C(![]() NaOH):
NaOH):

![]()
![]()
7. Вычислить число ионов гидроксида, содержащихся в 5 мл раствора, водородный показатель которого равен 3.
Решение.
1)
![]()
2)
![]()
3)
![]()
Для вычисления числа ионов используется соотношение, связывающее число структурных единиц (атомов, ионов, молекул) вещества N(x), количество этих структурных единиц n(x) и постоянную Авогадро NА, равную 6,02·1023 моль1:
 .
.
Отсюда:
![]()
8. Рассчитать
массу основания С5H5N·Н2О
в 150 мл раствора, водородный показатель
которого равен 10, если
![]() (С5H5N·Н2О) 5,2.
(С5H5N·Н2О) 5,2.
Решение.
Массу основания в растворе можно вычислить, зная молярную концентрацию раствора. Так как С5H5N·Н2О однокислотное основание, то из соотношения 14′:
рС(осн) = 2·рОН
![]() .
.
Величину рОН найдем из соотношения:
рОН = 14 рН = 14 10 = 4.
Таким образом:
рС(С5H5N·Н2О) = 2·4 5,2 = 2,8;
С(С5H5N·Н2О) = 10рС = 102,8 = 1,58·103 моль/л;
m(С5H5N·Н2О) = С(С5H5N·Н2О)·М(С5H5N·Н2О)·Vр-ра =
= 1,58·103·97·0,15 = 0,023 г.
9. Вычислить
молярную концентрацию гидроксида калия
в растворе, водородный показатель
которого равен 12, если
![]() = 90 %.
= 90 %.
Решение.
Гидроксид калия является однокислотным основанием, поэтому согласно соотношениям (8), (10) и (13):
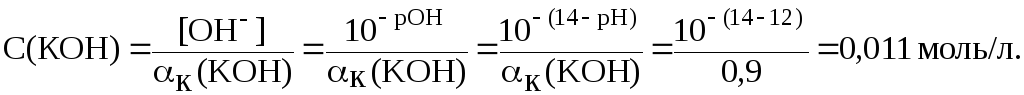
10. Вычислить рН раствора азотной кислоты с C(HNO3) = 0,01 моль/л (расчет вести через активность ионов Н+).
Решение.
![]()
Для
определения коэффициента активности
![]() сначала следует вычислить ионную силу
раствора I:
сначала следует вычислить ионную силу
раствора I:

![]()
![]()

Величину![]() ,
отвечающую I 0,01,
можно рассчитать по формуле:
,
отвечающую I 0,01,
можно рассчитать по формуле:
![]()
Отсюда:
![]()
![]()
![]()
Если принять
![]() = 1,
то:
= 1,
то:
![]()
![]()
Для точных расчетов сотые доли имеют значение.
11. Рассчитать рН раствора, в 100 мл которого находится 0,1 г гидроксида натрия и 0,174 г сульфата калия.
Решение.
Молярные концентрации электролитов в растворе составляют:


Ионная сила раствора, содержащего ионы Na+, K+, ОН и SO42, равна:

Коэффициент активности гидроксид-ионов и их активность соответственно равны:
![]()
![]()
![]()
Из соотношения (3) находим активность ионов водорода:

Таким образом:
![]()
12.
Найти число недиссоциированных молекул
кислоты в 500 мл раствора HF,
если
![]() = 10 %,
pH
= 2,5,
= 10 %,
pH
= 2,5,
![]() (НF) 7,2104.
(НF) 7,2104.
Решение.
В растворе слабой одноосновной кислоты молярную концентрацию кислоты можно рассчитать по формуле (12):
 .
.
Общее количество кислоты (n0) в заданном объеме раствора равно:
![]() .
.
Количество недиссоциированной кислоты (n) найдем по формуле:
![]() .
.
Число недиссоциированных молекул кислоты равно:

