
lecttext
.pdfХимическая связь в комплексных соединениях
Класс комплексных (или координационных) соединений является одним из важнейших в неорганической химии. Многие комплексные соединения играют важнейшую роль в биохимии (гемоглобин, хлорофилл,
большая часть ферментов, витаминов), в химической технологии
(комплексонаты металлов, комплексы-катализаторы окислительных и полимеризационных процессов).
Силы притяжения существуют не только между любыми двумя атомами, но и между любыми двумя молекулами. Об этом свидетельствует тот факт, что взаимодействие молекул часто приводит к образованию новых,
более сложных молекул, что можно определить как комплексообразование.
Какие же виды взаимодействия могут существовать между двумя молекулами? Между молекулами может осуществляться электростатическое и донорно-акцепторное взаимодействие. Промежуточное положение между электростатическим притяжением и донорно-акцепторным взаимодействием занимает так называемая водородная связь.
Природа химической связи в комплексных соединениях принципиально не отличается от природы связи в простых соединениях.
Вспомним строение комплексного соединения? Во внутренней сфере между центральным атомом и лигандами формируются полярные связи ковалентные связи, внешняя сфера удерживается около внутренней сферы комплекса за счет электростатического ион-ионного взаимодействия,
по характеру приближающегося к ионной связи.
Для объяснения образования и свойств комплексных соединений в настоящее время применяются теория валентных связей (ТВС), теория
кристаллического поля (ТКП) и теория молекулярных орбиталей
(ТМО). Сегодня мы познакомимся с вами с двумя первыми теориями и
постараемся для каждой из двух теорий найти ее достоинства и недостатки!

Теория валентных связей
Представления о донорно-акцепторной (ковалентной) связи легли в основу теории валентных связей, успешно развитой Лайнусом Полингом в
30-е годы прошлого столетия и способствовавшей прогрессу в исследованиях комплексных соединений.
ТВС была популярна в 1960-1970-е гг. скорее из-за наглядности, нежели исходя из критериев точности и надежности получаемых результатов. Сейчас эта теория имеет в основном историческое значение: она уступила свое место более совершенным теориям. Однако достоинством теории
Полинга в ее упрощенном варианте является большая наглядность. Поэтому для первого вашего знакомства с комплексными соединениями она чрезвычайно удобная.
ТВС исходит из предположения, что химическая связь в координационных соединениях является ковалентной связью, образованной по донорно-акцепторному механизму. Для образования такой связи комплексообразователь должен иметь свободные электронные орбитали,
количество которых определяет его координационное число. Лиганд должен иметь хотя бы одну неподеленную пару электронов. При перекрывании свободной орбитали комплексообразователя и заполненной орбитали лиганда образуется ковалентная σ-связь, которая в той или иной степени полярна в зависимости от природы комплексообразователя и лиганда. При образовании комплекса происходит гибридизации свободных орбиталей комплексообразователя, имеющих близкие значения энергии (обычно s-, p- и (d-орбитали одного уровня). Гибридизация приводит к образованию гибридных орбиталей с равной энергией. Тип гибридизации орбиталей определяет пространственное расположение лигандов вокруг центрального атома.

Координационное |
Гибридизация |
Конфигурация комплекса |
|
число |
|
|
|
|
|
|
|
2 |
sp или dp |
линейная |
|
|
|
|
|
4 |
sp3 |
или sd3 |
тетраэдрическая |
|
|
|
|
4 |
|
dsp2 |
квадратная |
|
|
|
|
6 |
d2sp3 |
или sp3d2 |
октаэдрическая |
|
|
|
|
Для октаэдрических комплексов в зависимости от природы лиганда возможна либо (n-1)d3nsnp3, либо nsnp3nd2 – гибридизация. Комплексы с гибридизацией (n-1)d2nsnp3 называют внутриорбитальными, или
низкоспиновыми, они обычно диамагнитны или слабо парамагнитны.
Комплексы с гибридизацией nsnp3nd2 называют внешнеорбитальными, или
высокоспиновыми, они парамагнитны.
Один и тот же комплексообразователь может образовывать как внутриорбитальные, так и внешнеорбитальные комплексы в зависимости от природы лиганда. Например, Со3+ образует внутриорбитальный комплекс
[Со(NН3)6]3+ и внешнеорбитальный комплекс [CoF6]3-.
Ион Со3+ имеет следующую электронную конфигурацию:
При образовании комплекса [Со(NH3)6]3+происходит спаривание Зd-
электронов и гибридизация вакантных орбиталей иона Со3+: 3d-
(«внутренних» d-орбиталей), 4s- и 4р-:
Свободные 3d24s4p3-гибридные орбитали взаимодействуют с содержащими неподеленные электронные пары орбиталями атомов азота молекул NH3. В результате ион Со3+ приобретает следующую электронную конфигурацию:

Все электроны спарены, их суммарный спин равен нулю (отсюда название – низкоспиновой), комплекс имеет диамагнитные свойства.
4s,4p34d2-гибридные орбитали взаимодействуют с содержащими неподеленные электронные пары орбиталями ионов F-. В результате ион Со3+
в комплексе приобретает следующую электронную конфигурацию:
Комплекс имеет четыре неспаренных электрона, следовательно,
высокий суммарный спин (высокоспиновый) и парамагнитные свойства.
Какие достоинства и недостатки имеет эта теория?
К достоинства, кроме ее наглядности, можно отнести то, что ТВС объясняет магнитных свойств большого числа комплексных соединений;
вводит понятие о так называемых внешне- и внутриорбитальных комплексах.
Недостатками ТВС является то, что она не рассматривает комплексные соединения с многоцентровыми связями, не объясняет и не предсказывает оптические свойства комплексных соединений, так как не учитывает возбужденные состояния, рассматривает образование только связывающих σ-
молекулярных орбиталей.
Перейдем к рассмотрению теории кристаллического поля!
Теория кристаллического поля
В 1929 г. Ганс Бете опубликовал статью, в которой рассмотрел эффект размещения изолированного катиона Na+ в
решетке ионного кристалла типа NaCl. В частности, он заинтересовался вопросом о том, что случается с энергетическими уровнями свободного иона при их помещении в электростатическое (или так называемое кристаллическое поле),

существующее в пределах кристалла. Энергетические уровни свободного иона – вырождены, т.е. существуют наборы независимых (ортогональных)
волновых функций, причем все члены этого набора имеют одинаковую энергию. Г.Бете показал, что при помещении этих ионов в кристалл должно наблюдаться полное или частичное снятие вырождения волновых функций.
ТКП в противоположность ТВС исходит из предположения ионного характера связи в комплексных соединениях. ТКП рассматривает лиганды как точечные (т.е. не имеющие размеров) отрицательные заряды или диполи.
ТКП применяется для описания комптексов d-элементов и объясняет их пространственную конфигурацию, спектральные и магнитные свойства,
исходя из рассмотрения влияния электрического поля лигандов на d-
орбитали комплексообразователя.
Большинство ионов d-элементов имеют координационное число 6.
Присоединяя 6 лигандов, такой ион образует октаэдрический комплекс.
Изначально, т.е. в отсутствие внешних воздействий, d-орбитали центрального иона имеют одинаковую энергию. Под влиянием октаэдрического электрического поля лигандов энергия dγ-орбиталей (dx2-y2 и dz2) повышается. Так как сумма энергий всех пяти d-орбиталей должна остаться постоянной, то энергия dε-орбиталей (dxy, dxz, dyz) понижается.
Происходит расщепление энергетического уровня d-орбиталей на два подуровня. В тетраэдрическом поле наоборот понижается энергия dγ-
орбиталей и повышается энергия dε-орбиталей.
Рис.1. Диаграмма расщепления d-орбиталей в поле лигандов
(chemistry.ru›course/content/chapter9/section/)
Разница в энергии подуровней называется энергией расщепления (Δ).
Величина зависит от химической природы лиганда. Лиганды, образующие
сильное кристаллическое поле, дают большое |
значение . |
Лиганды, |
образующие слабое поле, дают малое значение |
. О величине |
можно |
судить по спектру поглощения комплекса в ультрафиолетовой и видимой областях. Комплекс поглощает свет такой частоты h, что hν=Δ. В
соответствии с нарастанием силы образуемого поля лиганды располагают в спектрохимический ряд: I- < Br - < Сl - < NO3 - < RCOC - < F - < ОН - < НСОО - <
С2042 - ≈ Н20 < NCS - < NH3 < N02 - < CN - ≈ СО. Электроны заполняют прежде всего dε-орбитали, так как они имеют меньшую энергию. При этом энергия электрона на dε-орбитали меньше, чем его энергия на d-орбитали в отсутствии кристаллического поля. Таким образом, комплексообразование приводит к уменьшению энергии электронов и представляет собой термодинамически выгодный процесс. Разница в энергии электронов до комплексообразования и после него называется энергией стабилизации кристаллическим полем (ЭСКП). Чем больше ЭСКП, тем прочнее комплекс.
Распределение электронов по dγ - dε-орбиталям происходит в зависимости от соотношения энергии спаривания электронов (П) и энергии расщепления (Δ).
Если |
> П (сильное кристаллическое поле), то электроны заполняют |
|
прежде |
всего dε-орбитали, при необходимости спариваясь. Если |
< П |
(слабое кристаллическое поле), то электроны не спариваются и переходят на dγ-орбитали. Таким образом, лиганды сильного поля (амины, NO2-, CN-),
как правило, образуют диамагнитные или слабо парамагнитные низкоспиновые комплексы. Спектр поглощения таких комплексов смещается в область более коротких волн относительно аква-комплекса. Лиганды слабого поля (OH-, галогены-ионы) образуют парамагнитные,
высокоспиновые комплексы. Их спектр поглощения смещается в область более длинных волн относительно аква-комплекса.

Рис.2.Энергетическая диаграмма распределения d-электронов центрального атома 3d-элемента в слабом и сильном октаэдрическом поле лигандов
Заселение 3d-электронами dε- и dγ-подуровней центрального атома,
находящегося в сильном и слабом полях лигандов, различно (рис. 2.).
Порядок заполнения подуровней в основном соответствует общим принципам заполнения, но при одном исключении – восьмой электрон под влиянием сильного поля лигандов оказывается спаренным с седьмым электроном на одной 3dγ-AO вместо того, чтобы занять соседнюю свободную 3dγ-АО.
сильное поле |
слабое поле |
Рис.3.Схема расщепления |
d-орбиталей иона Со3+ в октаэдрическом |
поле
Комплексообразование может стабилизировать необычно высокие степени окисления комплексообразователя (Со (III) в [Со(NН3)6]3+, Мn(Ш) в
[Mn(CN)6]3- , Ni (IV) в [NiF6]3-).

Согласно ТКП октаэдрическая конфигурация поля лигандов наиболее выгодна, чем тетраэдрическая, поскольку расщепление энергетических уровней в октаэдрическом поле примерно в два раза больше, чем в тетраэдрическом поле при прочих равных условиях. Однако, есть случаи,
когда октаэдрическая и тетраэдрическая конфигурация равновероятны.
Примером могут служить компоексы Со(II) с электронной конфигурацией d7:
[Со(H2O)4]2+ ↔ [Со(H2O)6]2+, [Со(NH3)4]2+ ↔ [Со(NH3)6]2+.
Аквакатионы 3dпереходных металлов (H2O-лиганд слабого поля), как правило, имеют октаэдрическую конфигурацию. Замена H2O в
координационной сфере на лиганд более сильного поля часто вызывает более выгодную перестройку октаэдрического аквакомплекса в квадратный.
Например: [Сu(H2O)6]2+ ↔ [Сu(NH3)4]2+. Искажение правильной октаэдрической конфигурации координационного полиэдра в квадрат может рассматриваться в ряде случаев как следствие эффекта Яна-Теллера
(ru.wikipedia.org›wiki/Эффект_Яна_—_Теллера, xumuk.ru›Химическая энциклопедия›2/5469.html). По теореме Яна-Теллера виду энергетической выгодности при снятии вырождения система искажается. Октаэдр может исказиться в тетрагональную пирамиду или квадрат.
Рис.4. Эффект Яна-Теллера (nashislova.ru›hie/page/yana- tellera_effektyi.5437/)

Цветность комплексных соединений
Многие комплексные соединения в кристаллическом состоянии и водном растворе отличаются яркой окраской. Так, водный раствор,
содержащий катионы [Cu(NH3)4]2+, окрашен в интенсивно синий цвет,
катионы [Ti(H2O)6]3+ придают раствору фиолетовую окраску, а катионы
[Co(NH3)5H2O]2+
объяснить появление той или иной окраски у комплексных соединений.
Если через раствор или кристаллический образец вещества пропускать свет видимой части спектра, то в принципе возможны три варианта физического поведения образца: отсутствие поглощения света любой длины волны (образец вещества бесцветен, хотя может иметь полосы поглощения в ультрафиолетовой области спектра); полное поглощение света во всем интервале длин волн (образец будет казаться черным);
наконец, поглощение света только определенной длины волны (тогда образец будет иметь цвет, дополнительный к поглощенному узкому участку спектра). Таким образом, цвет раствора или кристаллов определяется
частотой полос поглощения видимого света
(alhimik.ru›compl_soed/gl_6.htm):
Поглощение квантов света комплексами (например, имеющими октаэдрическое строение) объясняется взаимодействием света с электронами,
находящимися на dε-подуровне, сопровождаемое их переходом на вакантные орбитали dγ-подуровня.
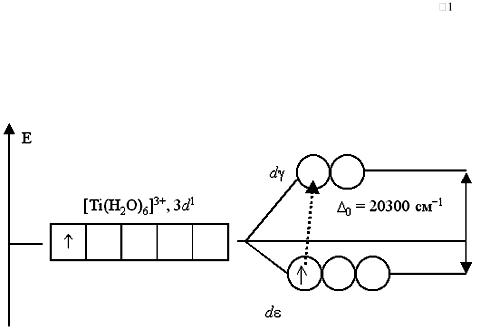
Например, при пропускании света через водный раствор, содержащий катионы гексаакватитана(III) [Ti(H2O)6]3+, обнаруживается полоса поглощения света в желто-зеленой области спектра (20300 см , λ=500 нм).
Это связано с переходом единственного электрона комплексообразователя с dε-АО на dγ-подуровень:
Рис. 5. Переход электронов с dε-подуровня, на вакантные орбитали dγ-
подуровня в [Ti(H2O)6]3+ (alhimik.ru›compl_soed/gl_6.htm)
Поэтому раствор, содержащий [Ti(H2O)6]3+, приобретает фиолетовый цвет (дополнительный к поглощенному желто-зеленому).
Таким образом, мы видим, что ТКП может быть применена для описания многих свойств комплексных соединений. ТКП используется для определения окраски соединений, магнитной восприимчивости,
относительной устойчивости в растворах. Выяснения влияния внутренней ассиметрии комплексов, предсказания относительных энергий электронных переходов, возможного числа неспаренных электронов, некоторых структурных свойств, например шпинелей, энергий электронных переходов в неизвестных комплексах, получения качественной информации о природе связи металл-лиганд.
Дальнейшим развитием ТКП является теория поля лигандов.
Примерно с 1950 года эта теория выдвинулась в центр внимания химии, а
