
Лекция 1
.pdfЛЕКЦИЯ 1. ВВЕДЕНИЕ. ОСНОВНЫЕ ПОНЯТИЯ
Введение. Термодинамический метод. Термодинамическая система. Параметры, характеризующие состояние термодинамической системы. Нулевой закон термодинамики. Температура. Историческая справка. Уравнение состояния. Термодинамические процессы.
Свой труд «Исследование о природе и причинах богатства народов» Адам Смит опубликовал в 1776 г., через семь лет после того, как Джеймс Уатт получил патент на предложенный им вариант парового двигателя. И Смит, и Уатт работали в университете Глазго. Единственная польза от угля, о которой упоминается в эпохальном труде Смита, — то, что уголь служит источником тепла для рабочих. Машины в XVIII в. приводились в движение ветром, водой и мышечной силой животных. Почти две тысячи лет прошло с тех пор, как Герон Александрийский заставил сферический сосуд вращаться вокруг оси под действием силы пара, но каким образом огонь порождает движение и заставляет двигаться части машин, оставалось загадкой. Поэтому Адам Смит не видел в угле скрытый источник богатства народов.
И вот паровой двигатель открыл новые возможности. Изобретение парового двигателя, позволившее превратить теплоту в механическое движение, не только ознаменовало наступление индустриальной революции, но и породило новую науку — термодинамику. В отличие от такой науки, как ньютоновская механика, возникшей из теории движения небесных тел, термодинамика родилась из более практического, земного интереса: ведь так хотелось узнать, как из теплоты возникает движение.
Термодинамика возникла из исследований тепловых явлений, но в ходе своего развития уже давно вышла за пределы учения о тепле. Скорее всего термодинамику можно определить как общее учение об энергии. Термодинамика учит различать формы энергии, устанавливает взаимосвязи между ними по энергетическим балансам Первого закона и выясняет условия и границы взаимопреобразований различных форм энергии в естественных явлениях и технических процессах на основе Второго закона.
Термодинамика как общее учение об энергии является фундаментальной общеинжеиерной наукой. Преобразования энергии составляют основную задачу обширной отрасли техники, называемой энергетикой, но процессы преобразования и передачи энергии весьма важны и в других областях техники. Для физиков и химиков большое значение имеют общие положения термодинамики о свойствах веществ в их различных агрегатных состояниях и о превращениях веществ в химических процессах. Здесь термодинамика как основа физической химии устанавливает общие соотношения между макроскопическими свойствами (характеристиками или параметрами состояния) чистых веществ и смесей в их рав-
1
новесных состояниях. Поэтому термодинамику можно определить и как общее учение о равновесных состояниях физических систем.
Характерным для обоих аспектов термодинамики — учений об энергии и о равновесии — является общность ее положений, не связанных с рассмотрением свойств конкретных систем или особенностей представления молекулярной либо атомистической структуры материи.
Эти достоинства обусловлены применением положений термо динамики лишь к равновесным состояниям и таким системам, которые велики по сравнению с размерами молекул и, следовательно, содержат очень много частиц, так что становится возможной феноменологически-макроскопическая теория.
Термодинамика устанавливает общие соотношения, справедливые для всех систем, однако использование их в конкретных случаях без дополнительной информации невозможно. Так, термодинамические соотношения позволяют получить новые данные на основе термического уравнения состояния, устанавливаемого в частных случаях путем измерений.
Все сказанное выше относится к термодинамике, оперирующей только макроскопическими величинами и обычно называемой классической или феноменологической термодинамикой в противовес статистической термодинамике, которая развилась в конце XIX столетия из кинетической теории газов. К феноменологической термодинамике (далее просто термодинамике), основы которой мы будем изучать в рамках нашего курса, относят те положения, для формулировки и применения которых не требуется явного рассмотрения внутреннего молекулярного строения и механизма молекулярных процессов в рассматриваемых телах. То есть, в отличие от многих областей физики и химии термодинамика не оперирует какими-либо моделями строения вещества и вообще непосредственно не связана с представлением о микроструктуре вещества. Эта часть термодинамики исходит из ряда установленных на опыте положений и пользуется известными данными о свойствах тел. Сама по себе термодинамика не может дать каких-либо сведений о свойствах вещества. Но если известны некоторые данные о свойствах веществ или систем, то термодинамические методы позволяют получить интересные и важные выводы.
Альберт Эйнштейн говорил: «Теория производит тем большее впечатление, чем проще ее исходные предпосылки, чем разнообразнее те факты, между которыми она устанавливает взаимосвязь, и чем шире простирается область ее применимости. Именно поэтому классическая термодинамика произвела на меня сильное впечатление. Это единственная физическая теория универсального содержания, относительно которой я убежден, что в рамках применимости ее основных принципов она никогда не будет опровергнута».
Еще одно высказывание о термодинамике, автором которого был Ричард Кокс, профессор физики в университете Хопкинса: «Классическая термодинамика — удивительная наука, скромная и доставляющая утешение здравому
2
смыслу. Величины, с которыми она имеет дело, попадают под масштаб обычных измерений. Законы, на которых она основана, подтверждаются обычными опытами. Как логическая система термодинамика изумительна по экономии ее средств. Ее понятия и принципы не содержат ничего лишнего. Пределы ее применимости четко сформулированы, и в этих пределах она является совершенной. В термодинамике ничего не пропущено и ничего не отложено в сторону».
Термодинамика — наука о наиболее общих тепловых свойствах макроскопических систем и закономерностях превращения энергии. Термодинамика представляет собой часть теоретической физики, основное содержание которой составляет рассмотрение общих свойств физических систем при равновесии, а также общих закономерностей, имеющих место при установлении равновесия.
Принцип построения термодинамики прост. В основу термодинамики положены два основных закона (или, как иногда говорят, начала), установленных опытным путем. Первый закон термодинамики характеризует количественную сторону процессов превращения энергии, а второй закон устанавливает качественную сторону (направленность) процессов, происходящих в физических системах. Ни первый, ни второй законы не опираются на какие-либо предположения о строении вещества: это-то и обеспечивает, как мы уже отмечали выше, большую общность методов термодинамики. Используя только эти два закона, методом строгой дедукции можно получить все основные выводы термодинамики.
Термодинамика применима для всех систем, для которых справедливы законы, лежащие в ее основе. Первый закон термодинамики, как мы увидим далее, представляет собой количественное выражение закона сохранения и превращения энергии и имеет всеобщий характер. Что же касается второго закона, то он основывается на опыте, накопленном при изучении макросистем в пределах, доступных нашему непосредственному наблюдению.
Статистическая термодинамика явно и с самого начала использует определенные представления о молекулярном (атомном) строении вещества. Для нее характерно применение статистических методов и математического аппарата теории вероятности. Законы классической, или квантовой, механики здесь распространяются на частицы (атомы, молекулы), и путем статистических методов устанавливаются взаимосвязи между свойствами отдельных частиц и макрофизическими свойствами систем, состоящих из очень большого числа частиц. Статистическая термодинамика, как и классическая термодинамика, представляет собой общую, базовую теорию, и только при дополнительных сведениях об определенной модели атомистического или молекулярного строения конкретной системы она позволяет на основе общих уравнений получить данные для этой системы.
3
Нужно иметь в виду, что при современном развитии науки деление термодинамики на феноменологическую и статистическую, достаточно условно и диктуется скорее педагогическими, а не логическими соображениями.
Термодинамическое исследование начинается с выделения ограниченной области пространства, подлежащей рассмотрению. Содержимое этой области назовем термодинамической системой. Все, что находится вне системы, будем называть внешней средой. Часть внешней среды также может быть выделена как другая система. Система отделяется от внешней среды материальной или воображаемой ограничивающей поверхностью — границей системы; граница выбирается таким образом, чтобы обеспечить четкое (однозначное) определение системы. Границам часто приписывают идеализированные свойства, особенно с точки зрения их проницаемости для вещества и энергии. Итак, термодинамической системой будем называть совокупность материальных тел, взаимодействующих как между собой, так и с окружающей средой; все другие материальные тела, находящиеся за пределами границ рассматриваемой системы, принято называть окружающей, или внешней, средой.
Определение термодинамической системы часто зависит от существования «границ», отделяющих рассматриваемую систему от остального мира. Чтобы понять термодинамическое поведение физических систем, важно учесть природу взаимодействия между системой и окружающей средой. Поэтому термодинамические системы по характеру взаимодействии с окружающей средой также делятся на три типа: изолированные, закрытые и открытые системы.
Изолированные системы не обмениваются с внешней средой ни энергией, ни веществом. Закрытые системы обмениваются с внешней средой энергией, но не обмениваются веществом. Открытые системы обмениваются с внешней средой и энергией, и веществом.
Существует иная классификация, связанная с детализацией энергетического обмена (обмен теплотой и работой). Термодинамические системы делятся на открытые и закрытые (нет обмена веществом). В свою очередь последние подразделяются на изолированные, адиабатно изолированные (нет теплообмена, но возможно изменение объема при совершении работы) и замкнутые (возможен теплообмен при постоянстве объема).
Гомогенной называют такую систему, химический состав и физические свойства которой во всех ее частях одинаковы или изменяются непрерывно (без скачка) от одной точки системы к другой. Примером гомогенной системы можно считать мысленно выделенный столб воздуха, представляющий собой смесь нескольких газов, в основном азота и кислорода. В такой системе в результате действия силы тяжести будут непрерывно изменяться от одной точки к другой как состав, так и физические свойства.
Гетерогенной называют систему, состоящую из двух и более различных гомогенных областей. Гомогенные области в гетерогенной системе называют
4
фазами. Каждая фаза отделена от соседней поверхностью раздела, при переходе через которую скачкообразно изменяются химический состав или физические свойства вещества. Иногда следует рассматривать поверхность раздела фаз не как математическую поверхность, а как тонкий разделяющий фазы слой, в котором свойства одной фазы быстро переходят в свойства другой.
Примером гетерогенной системы может служить вода с плавающим в ней льдом. В этой системе имеются две гомогенные области — вода и лед. Химический состав этих фаз одинаков, но физические свойства резко отличаются друг от друга.
Другой пример гетерогенной системы — содержимое запаянной стальной трубки, в которой находятся жидкая ртуть, жидкий этиловый спирт и смесь насыщенных паров этилового спирта и ртути. Такая гетерогенная система имеет три фазы: жидкую ртуть, жидкий этиловый спирт и смесь насыщенных паров этилового спирта и ртути. В этой гетерогенной системе химические составы и физические свойства всех фаз различны.
Гомогенная система и каждая фаза гетерогенной системы могут состоять из одного или нескольких чистых веществ.
Гомогенную систему или фазу гетерогенной системы, состоящую из нескольких чистых веществ, называют раствором или смесью.
Все чистые вещества и растворы могут находиться в трех агрегатных состояниях: газообразном, жидком и твердом.
Втермодинамике состояние системы принято описывать в терминах макроскопических характеристик состояния вещества, таких, как объем, давление, температура, число молей химических компонентов. Эти характеристики называют параметрами состояния. Функции переменных состояния, такие как, например, внутренняя энергия, называют функциями состояния.
Втермодинамике внутренняя энергия, энтальпия, теплоемкость называются калорическими свойствами вещества, а удельный объем, давление, температура
—термическими свойствами.
Используемые в термодинамике переменные удобно разделить на два вида. Параметры состояния, значепия которых определяются суммой параметров состояния составляющих частей условно разделенной системы, называются экстенсивными параметрами состояния. Общеизвестными примерами экстенсивных параметров состояния могут служить объем V, масса m и количество вещества n. Если рассматривается, в частности, гомогенная система, то при разделении ее на части объем делится пропорционально массе или количеству вещества, причем это справедливо не только для объема, но и для всех других экстенсивных величин. Следовательно, экстенсивные параметры состояния определяют также размер рассматриваемой системы; особенно удобна для этих целей масса вещества.
5
Параметры состояния, значения которых не зависят от размеров системы, называются интенсивными параметрами состояния. Интенсивными параметрами состояния являются, например, температура, давление, плотность. Они описывают локальное свойство, независящее от размера системы. Удельные, т.е. отнесенные к массе вещества, экстенсивные свойства приобретают смысл интенсивных свойств. Так, удельный объем, удельная теплоемкость и т.п. могут рассматриваться как интенсивные свойства. Интенсивные свойства, определяющие состояние тела или группы тел (термодинамической системы), называют термодинамическими параметрами состояния тела (системы).
Понятие об интенсивных и экстенсивных величинах ввел в 1813 г. Гегель в работе «Наука логики». Он обратил внимание на принципиально другой способ измерения этих величин. Измерения экстенсивной величины — это сравнение ее с другой, однородной с ней величиной. Например, можно взять сосуд и придать ему смысл единицы объема. С помощью этого сосуда можно наполнить большой резервуар жидкостью и непосредственно подсчитать количество единиц объема, содержащихся в резервуаре. Для интенсивной величины принципиально нельзя предложить меру сравнения, а процедура ее измерения состоит в использовании функциональной связи между изменением экстенсивной величины и самой интенсивной величиной. Так, в жидкостном термометре измеряют не температуру (интенсивную величину), а объем жидкости (экстенсивную величину), т.е. величину, которая зависит от температуры.
Наиболее удобными и поэтому наиболее распространенными параметрами состояния являются абсолютная температура, абсолютное давление и удельный объем (или плотность) тела.
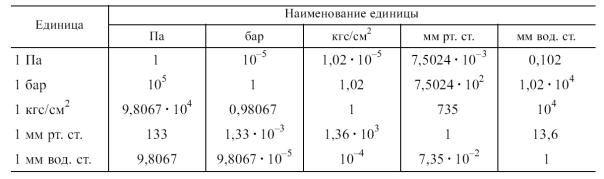
Абсолютное давление представляет собой силу, действующую по нормали к поверхности тела и отнесенную к единице площади этой поверхности. Для измерения давления основной единицей является паскаль (Па), применяются также бар, так называемая техническая атмосфера или просто атмосфера (1 кгс/см2), миллиметр ртутного или водяного столба. Соотношения между различными единицами измерения давления приведены в табл. 1.1.
Таблица 1.1. Соотношения между различными единицами измерения давления
Удельный объем вещества представляет собой объем, занимаемый единицей массы вещества. Удельный объем v связан с массой тела G и его объемом V
6
следующим очевидным соотношением v = V/G. Удельный объем вещества обычно измеряется в м3/кг или в см3/г.
Плотность ρ = G/V = 1/v измеряется обычно в кг/м3 или г/cм3. Иногда мы будем употреблять понятие удельного веса вещества. Под удельным весом γ понимают вес вещества в единице его объема. В соответствии со вторым законом Ньютона удельный вес и плотность вещества связаны между собой соотношением γ = ρg = g/v, где g — ускорение свободного падения.
Состояние равновесия — это такое состояние, к которому при данных внешних условиях стремится термодинамическая система. Если внешние условия неизменны, то состояние равновесия удерживается в системе сколь угодно долго. В равновесном состоянии при постоянных внешних условиях остаются постоянными во времени все параметры системы и в системе отсутствуют потоки (например, потоки энергии или вещества). Следует различать состояния устойчивого, неустойчивого и относительно устойчивого равновесия.
Состояние устойчивого равновесия (стабильное состояние) характерно тем, что если каким-либо внешним воздействием вывести из него рассматриваемую систему, а затем снять это внешнее воздействие, то система сама возвратится в исходное состояние равновесия.
Если систему, находящуюся в состоянии неустойчивого равновесия (лабильное состояние), из него вывести, то она уже не возвратится в исходное состояние, а перейдет в состояние устойчивого равновесия. Даже очень малые внешние воздействия выводят систему из лабильного состояния.
Наконец, состояние относительно устойчивого равновесия (метастабильное состояние) — это состояние, в котором система может находиться в течение длительного времени, причем слабые внешние воздействия (возмущения), вызывающие небольшие отклонения системы от метастабильного состояния, не приводят к переходу в другое состояние; после того как такое внешнее воздействие снято, система возвратится в исходное метастабильное состояние. Вместе с тем достаточно сильное воздействие выведет систему из метастабильного состояния и она перейдет в новое состояние устойчивого равновесия. Таким образом, метастабильное состояние занимает промежуточное место по отношению к стабильному и лабильному состояниям.
Любая изолированная система независимо от своего начального состояния в конечном итоге приходит в равновесное состояние. Если две изолированные системы А и В приведены в контакт друг с другом, то полная система А + В в конечном итоге переходит в состояние теплового равновесия. В этом случае говорят, что системы А и В находятся в состоянии теплового равновесия друг с другом. Каждая из систем А и В в отдельности также находится в состоянии теплового равновесия. Это равновесие не нарушится, если устранить контакт между системами, а затем через некоторое время восстановить его. Следовательно, если установление контакта между двумя системами А и В, которые до
7
этого были изолированными, не приводит ни к каким изменениям, то можно считать, что эти системы находятся в тепловом равновесии друг с другом.
Если системы А и В находятся в тепловом равновесии и системы В и С находятся в тепловом равновесии, то системы А и С также находятся в тепловом равновесии между собой:
A ~ B, B ~ C → A ~ C .
Этот эмпирический закон называется нулевым законом термодинамики (закон транзитивности теплового равновесия): две системы, находящиеся порознь в термическом равновесии с третьей системой, находятся также в термическом равновесии между собой.
Нулевой закон термодинамики позволяет ввести количественную характеристику термического состояния системы — температуру ϑ = f ( p, v) . Температура является интенсивным параметром состояния термодинамической системы, так как внутри гомогенной системы при термическом равновесии она имеет одно и то же значение независимо от размеров (количества вещества) системы.
Типовая система, для которой по определенной закономерности устанавливается функция состояния ϑ, называется термометром. Так как выбор закономерности и типовой системы, вообще говоря, произволен, то ϑ называют эмпирической температурой.
Чтобы измерить по эмпирической шкале температуру какой-либо системы, устанавливают термическое равновесие между рассматриваемой системой и термометром. При этом считают, что изменяется только состояние термометра, а состояние системы, температура которой измеряется, остается неизменным в пределах точности измерений.
Термометр представляет собой систему, обладающую легко и точно измеряемыми свойствами, которые однозначно изменяются в зависимости от температуры. Кроме широко известных жидкостных термометров, где термометрической характеристикой служит высота l столба жидкости в капилляре, часто применяются также газовые термометры, термометры сопротивления и термопары.
В газовом термометре в качестве термометрического свойства используется либо давление (если объем определенного количества газа неизменен), либо объем (если давление газа поддерживается постоянным). Измерение температуры термометром сопротивления основано на зависимости электрического сопротивления металлов от температуры. Термопара состоит из двух разнородных, спаянных на концах металлических проводов, образующих электрическую цепь. Если спаи находятся при различных температурах, то в цепи возникает термоэлектрическое напряжение, являющееся мерой разности температур между спаями термопары.
С помощью термометра можно установить эмпирическую температуру, придавая наблюдаемым величинам термометрического свойства определенные
8

числовые значения температуры. Например, для жидкостпого термометра эмпирическую температуру можно определить из соотношения
ϑ = ϑ0 + ϑ1 − ϑ0 (l − l0 ) l1 − l0
путем фиксации двух базовых (реперных) точек, для которых измеренным длинам l0 и l1 столба жидкости соответствуют температуры ϑ0 и ϑ1. В принципе аналогично можно поступать и с другими термометрами. При этом получаются различные, произвольно определяемые температурные функции.
В настоящее время применяют различные температурные шкалы — Цельсия, Фаренгейта, Реомюра, Ренкина (табл. 1.2); наиболее употребительной является международная стоградусная температурная шкала (шкала Цельсия), в которой интервал температур от точки плавления льда до точки кипения воды при атмосферном давлении разбит на сто равных частей (градусов).
Таблица 1.2. Соотношения между различными температурными шкалами
Вообще, именно с изобретением и усовершенствованием термометра — первого измерительного теплового прибора — были связаны первые шаги в экспериментальном изучении тепловых явлений в конце XVI—начале XVII вв. И именно это изобретение можно рассматривать как начало развития термодинамики.
Трудно сейчас с достоверностью сказать, кому первому пришла в голову замечательная идея использовать известное еще Герону Александрийскому и Филону из Византии свойство воздуха расширяться при нагревании для устройства измерительного прибора, показывавшего «градус» тепла нагретого тела.
Висторико-физической литературе это изобретение связывают обычно с именами двух ученых — итальянца Галилео Галилея и голландца Корнелия Дреббеля.
В1592 г. Галилей впервые во время своих лекций демонстрировал прибор, который можно считать прообразом термометра. Прибор этот состоял из стеклянной трубки, верхний конец которой заканчивался шариком. Шарик слегка нагревался (например, от тепла руки), а затем трубка открытым концом помещалась в сосуд
9

с водой. При охлаждении шарика вода поднималась по трубке и устанавливалась выше уровня воды в сосуде. При нагревании шарика воздух в трубке расширялся и уровень воды в ней опускался. Таким образом, по положению уровня воды в трубке, по крайней мере качественно, можно было судить об изменении температуры тела (рис 1.1).
Таким образом, Галилея можно считать первым ученым, не только высказавшим мысль о том, что изменение температуры тела тесно связано с изменением его физических свойств (в данном случае объема), но и практически реализовавшим ее в форме прибора — термоскопа. Значительно позже эта мысль Галилея, осо-
знанная во всей своей широте, оказала огромное влияние на развитие не только термометрии, но и других разделов учения о теплоте. Термоскоп Галилея был впервые описан английским философом Ф. Бэконом в 1620 г. Изготовленные собственноручно великим итальянцем термоскопы хранятся в настоящее время в музеях Флоренции и Падуи.
Что касается изобретения Дреббеля, то, по свидетельству некоторых авторов, писавших об истории термометрии, свой прибор он сконструировал независимо от Галилея в 1604 г. и описал его в труде «Краткий трактат о природе элементов». Прибор Дреббеля представлял, по существу, также термоскоп несколько иной конструкции.
Первые попытки усовершенствования термометра были связаны с установлением постоянных точек шкалы. В течение XVII в. различными учеными были предложены разнообразные варианты этих точек. Так, О. Герике предложил принять за одну из них среднюю температуру во время первых заморозков. Однако произвольный характер такого выбора был совершенно очевиден. Э. Галлей, X. Гюйгенс, некоторые другие ученые, которым было известно постоянство точек замерзания и кипения воды, предложили их в качестве постоянных точек термометра. Гюйгенс в 1655 г. обратил внимание, что удобно в качестве постоянной точки термометра взять точку кипения воды: «Тогда не будет необходимости посылать термометры из одного места в другое, чтобы сравнить наблюденную степень теплоты»,— писал он по этому поводу. Аналогичное предложение позже (1693) было сделано и Ренальдини. Были и другие предложения, но начиная с конца XVII — начала XVIII вв. все чаще при конструировании термометров в качестве постоянных точек берутся точки замерзания и кипения воды или же одна из них.
10
