
- •Энергетика
- •Кинетика
- •Открытая
- •Энтальпия (теплота) образования вещества fН298
- •Следствие из закона Гесса:
- •Влияние температуры на ΔrН:
- •С(графит) 0 8,54
- •Акрист Ааморф s 0
- •Зависимость ΔrS от температуры:
- •С(графит) 5,74 8,54
- •Энтальпийный и энтропийный факторы изобарно-изотермического процесса
- •Критерий самопроизвольного протекания процесса:
- •С(графит) 298 – 2300к
Тепловой
эффект образования 1 моль вещества из
простых веществ, устойчивых при 298 К и
давлении 101 кПа
Энтальпия (теплота) образования вещества fН298
fН простых веществ, устойчивых при 298 К и давлении 101 кПа принимают равной 0
( О2-газ, Br2-жидкость, Р-белый , Snбелое, Sромб.)
Если вещества в стандартном состоянии - fНo298 –стандартная энтальпия образования вещества (табличные данные)
H2(г)+2O2(г)+S(к)=H2SO4(ж);
rН°298 = ΔfН0298 (H2SO4) = -811,3 кДж/моль
½H2(г) + ½N2(г) + 1½O2(г) = 1HNO3(ж) + ΔfН0298 (HNO3)
rН°298 = ΔfН0298 (HNO3) = -174,3 кДж/моль
ΔсгН0298 – тепловой эффект сгорания 1 моль вещества в кислороде до высших оксидов, устойчивых в стандартном состоянии.
Следствие из закона Гесса:
энтальпия
химической реакции равна сумме энтальпий
образования продуктов реакции за
вычетом суммы энтальпий образования
исходных веществ с учетом стехиометрических
коэффициентов
ΔrН0
= ∑νiΔfНi0
продуктов
- ∑νjΔfНj
0исх
веществ
Зависимость ΔrН0 от температуры -
уравнение Кирхгофа:
Т
1. ∆rH0T = ∆rH0298 + ∫ ∆rС0pdT (р = const)
298
∆rСpо = Δa + ΔbT +Δc′T-2+ΔcT2 -
изменение стандартной теплоемкости системы в ходе реакции в изобарном процессе.
а, b, c, c′ - коэффициенты уравнения температурной зависимости теплоемкости (табулированы).
Влияние температуры на ΔrН:
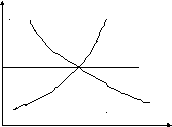 ∆rН
∆rН
∆rСp0 ∆rСp0
∆rСp=0
Т
2. Если пренебречь зависимостью Ср от Т (Ср=соnst):
∆rН0Т = ∆rН0298 + ∆rС0р(Т - 298)
∆rСpо = ∑νiСрi0 прод - ∑νjСрj 0исх веществ
изменение стандартной теплоемкости системы в ходе реакции: разность молярных изобарных теплоемкостей всех продуктов реакции и молярных изобарных теплоемкостей исходных веществ
3. Если считать ∆rС0р= 0:
∆rH0T = ∆rH0298
Задача
Рассчитать ∆rH0298 и ∆rH01000 реакции
С(к) + СО2(г) = 2СО(г),
считая постоянными теплоемкости реагентов в данном температурном интервале.
Решение
∆rН0Т = ∆rН0298 + ∆rС0р(Т - 298)
По табличным данным:
Вещество: ΔfН0298,кДж/моль С0р298 ,Дж/моль.К
С(графит) 0 8,54
СО2 (г) -393,5 37,41
СО (г) -110,5 29,14
ΔrН0298 = 2ΔfН0298 СОг - ΔfН0298 Ск - ΔfН0298 СО2г =
= 2(-110,5) – 0 – (-393,5) = 172,5 кДж.
ΔrН0298 >0 - реакция эндотермическая.
Изменение теплоемкости системы:
∆rС0р= 2С0р298СОг–С0р298Ск–С0р298СО2г=
= 2.(29,14)–8,54–37,41 =12,33 Дж/К
∆rН01000 = 172,5 + 12,33.10-3.(1000 - 298) = 181,16 кДж
При изменении температуры на 702К увеличение теплового эффекта составляет 5%.
Задача
Рассчитать изменение внутренней энергии системы при изохорно-изотермическом протекании реакции
С(к) + СО2(г) = 2СО(г) при 298К.
Решение.
Qp = QV + ∆νRT, QV = DU, Qp = H, ∆ν = 2 - 1=1
∆rU0298 = ∆rH0298 –∆νRT =
175,2 – 1.8,31.298.10-3 = 172,7 кДж.
Задача.
Определить ∆rH0298 реакции (1)
С(к) + СО2(г) = 2СО(г),
если известно:
(2) 2С(к) + О2(г) = 2СО(г) , ∆rH0298 = -221 кДж
(3) 2СО(г) + О2(г) = 2СО2(г) , ∆rH0298 = -566,1 кДж .
Решение. К термохимическим уравнениям можно применять любые алгебраические действия.
ур.1
=
![]() ½ур.2
– ½ур.3
½ур.2
– ½ур.3
½(2С(к)+ О2(г)) - ½(2СО(г) + О2(г)) =½2СО(г) - ½2СО2(г)
∆rH01 = ½ (∆rH02 - ∆rH03) = ½[-221 – (-566,1)] = 172,5 кДж.
![]()
энергия превращение
Химический процесс - это два одновременно происходящих явления:
1) передача энергии
2) изменение в упорядоченности расположения частиц относительно друг друга (в изолированной системе.
▼Самопроизвольный процесс может протекать только с выделением тепла;
►Движущие силы и критерии протекания самопроизвольных химических процессов
Стремление частиц (молекул, ионов, атомов) к хаотическому движению.
Стремление системы – к переходу от более упорядоченного состояния к менее упорядоченному.
Состояние системы можно охарактеризовать микросостояниями составляющих ее частиц, т.е. их мгновенными координатами и скоростями различных видов движения в различных направлениях.
S-энтропия
: Мера
неупорядоченности состояния системы
Состояние системы характеризуют микросостояниями ее частиц (мгновенными координатами и скоростями в различных направлениях).
Термодинамическая
вероятность W: -
число микросостояний системы, с помощью
которых может быть охарактеризовано
ее состояние
W – огромное число, т.к., напр. в 1 моль – 6,02•1023 частиц, поэтому используют lnW
Чем больше число микросостояний, тем более вероятна реализация состояния
S = k lnW
k –постоянная Больцмана
k = R/N =1,3810-23 Дж/К
3-ий
закон термодинамики
(1911г.
М. Планк): при
абсолютном нуле энтропия идеального
кристалла равна нулю (полная
упорядоченность)
W
= 1, S
= 0 При
плавлении
–S1-увеличивается При
испарении
–S2
–увеличивается S2
S1
