


Растворы – промежуточное положение между смесью и химическим соединением:
А) как смесь – перемены;
Б) как соединение – однородны.
В зависимости от размера частиц растворенного вещества:
Системы «растворитель-растворенное вещество»
г



 омогенные
микрогетерогенные
гетерогенные
омогенные
микрогетерогенные
гетерогенные


 10-10
10-9
10-8
10-7
,м(размер)
10-10
10-9
10-8
10-7
,м(размер)
и
 стинные
коллоидные суспензии, эмульсии
стинные
коллоидные суспензии, эмульсии
растворы механические смеси
В зависимости от агрегатного состояния:












Растворитель (условно) - компонент раствора, концентрация которого выше, чем у других и который не меняет своего фазового состояния при образовании раствора



 В
зависимости от природы растворителя
В
зависимости от природы растворителя


Способы выражения концентрации растворов.

![]() [моль/л,
моль/дм3,
моль/м3]
[моль/л,
моль/дм3,
моль/м3]
2 .
.
![]() [моль/л,
моль/дм3,
моль/м3]
[моль/л,
моль/дм3,
моль/м3]
Пример:
CМ (Н2SО4) = 2 моль/л
Э (Н2SО4) = 1/2 Н2SО4 f(Н2SО4) = ½
СН
=
![]() =
4 моль/л
=
4 моль/л

![]() [г/мл,
г/см3]
[г/мл,
г/см3]
4.Массовая доля вещества, :

![]() (доли
или 100%)
(доли
или 100%)
- плотность раствора [г /мл, г/см3]
Растворение - Gрастворения < 0 самопроизвольный, обратимый процесс.
растворение

 А(к)
А(к)![]() А(р-р)
А(р-р)
кристаллизация
Насыщенный раствор - в данных условиях дальнейшее самопроизвольное растворение невозможно: Gрастворения = 0, растворения = выделения.
Ненасыщенный раствор - самопроизвольное растворение вещества еще возможно:
Gрастворения < 0, растворения выделения.
Пересыщенный раствор – содержание растворенного вещества больше, чем в насыщенном растворе – неустойчивое состояние.

Растворимость зависит от:
-
природы вещества и растворителя,
-
давления газа над раствором (если растворяемое вещество газ),
-
о
 т
температуры: с
температуры растворимость
т
температуры: с
температуры растворимость
 а)
большинства твердых веществ
,
а)
большинства твердых веществ
,
 б)
газообразных веществ
б)
газообразных веществ


Ср Cp
CO2
O2 N2
N2
t,0C давление

Растворение - физико-химический процесс.
Ранее – физическая теория образования растворов: механическое диспергирование за счет сил диффузии.
Д.И.Менделеев – физико-химическая теория растворов (гидратная (сольватная) теория растворов).
: взаимодействие растворенного вещества и растворителя
Растворение NaClк в н2о:
























































































































































Диполи
молекул Н2О Гидратированные
ионы




























Три стадии процесса растворения:
1) процесс ионизации -разрушение связей:
 NaClк
Na+(г)
+ Cl-(г)
;
Нион
>
0; Sион
>
0
NaClк
Na+(г)
+ Cl-(г)
;
Нион
>
0; Sион
>
0
2 )процесс
сольватации
(гидратации)-
взаимодействие
растворителя с растворяющимся веществом
с образованием - сольватов (гидратов):
N
Na+(г)
+ aq
Na+
aq
(р-р)
)процесс
сольватации
(гидратации)-
взаимодействие
растворителя с растворяющимся веществом
с образованием - сольватов (гидратов):
N
Na+(г)
+ aq
Na+
aq
(р-р)
 Cl-(г)
+ aq
Cl-
aq
(р-р)
Cl-(г)
+ aq
Cl-
aq
(р-р)
Нсольв < 0; Sсольв 0
3) распределение (диффузия) по объему сольватов (гидратов):
Ндифф > 0 , Sдифф > 0 – (величины существенно меньше 1 и 2 ст.)
НР = Нион + Нсольв + Ндифф;
SР = Sион + Sсольв + Sдифф;
Н0298NaCl = 335кДж Нион - доминирует
S0298NaCl = 142 кДж/К большое значение - хорошая растворимость
G0298раств= -8,8 кДж/моль NaCl
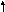 т.к.
Нр
> 0
с Т
раст-ть увеличивается.
т.к.
Нр
> 0
с Т
раст-ть увеличивается.
Растворимость LiFк Li+(р-р) +F-(р-р)
Н0298LiF > 0 - Нион - доминирует
S0298LiF = -33 кДж/К G0298раств 0
LiF -малорастворимая соль
-
eсли в H2O растворяются г или ж
Нион < Нсольв Нр < 0.
-
Если растворяются к
Нион Нсольв Нр > 0

Cвойства растворов зависят от:
-
числа растворенных частиц (концентрации);
2) энергии взаимодействия молекул растворенного вещества друг с другом;
3) энергии взаимодействия молекул растворенного вещества и растворителя.
Если п.2,3 – малы – раствор идеальный его свойства зависят только от концентрации
(разбавленные растворы неэлектролитов – сахар в воде)


 C
концентрации раствора
отклонения от законов идеальных растворов
из-за взаимодействиями между частицами
раствора.
C
концентрации раствора
отклонения от законов идеальных растворов
из-за взаимодействиями между частицами
раствора.
Вместо концентрации (с) - активность (а).
а
=
с
![]()
- коэффициент активности, учитывает все виды взаимодействия частиц в растворе.
- вычисляют по экспериментальным данным
(температурам кипения, замерзания и др.)
- безразмерная величина.






Э лектролитическая
диссоциация:
лектролитическая
диссоциация:
(впервые Сванте Аррениус – 1886г)
 NaClк
+ H2O
Na+aq
+ Cl-aq
NaClк
+ H2O
Na+aq
+ Cl-aq
гидратированные ионы
 NaClк
H2O
Na+
+ Cl-
Ндисс
0
–эндотерм.пр.
NaClк
H2O
Na+
+ Cl-
Ндисс
0
–эндотерм.пр.
Э лектролиты:
лектролиты:
с тепень
диссоциации :
тепень
диссоциации :
=
сдисс /
со
со- исходная концентрация электролита
- зависит от:
1) природы растворенного вещества:
(СН3СООН) (НСl)
2)
природы растворителя:
![]()
ч
 ем
F
легче рвется связь под действием
полярных молекул растворителя.
ем
F
легче рвется связь под действием
полярных молекул растворителя.
 (Н2О)
= 81
(Н2О)
= 81
3 )
температуры:
с
Т
)
температуры:
с
Т
4
 )
концентрации раствора:
с
концентрации
)
концентрации раствора:
с
концентрации
5) введения одноименного иона:
СН3СООН СН3СОО- + Н+
 СН3СООNH4
СН3СОО-
+ NH4+
СН3СООNH4
СН3СОО-
+ NH4+
 равновесие
смещается влево, т.е.
.
равновесие
смещается влево, т.е.
.
3% - слабые электролиты – плохо распадаются на ионы;
3% 30% - средние электролиты;
30% - сильные электролиты – практически нацело распадаются на ионы.

Процесс диссоциации - обратим Диссоциация слабой кислоты: НА Н+ + А
константа
диссоциации:
![]()
= 1 (взаимодействие слабое) с = а =а
![]() ;
[H+]
– равновесная концентрация
;
[H+]
– равновесная концентрация
Диссоциации слабого основания: RОН R+ + ОН-
![]()
Диссоциация комплексного иона:
[Cu(NH3)4]2+ Cu2+ + 4NH3

КД зависит от:
-
природы диссоциирующего вещества и растворителя;
-
температуры.

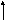 С
Т
КД
, т.к. Ндисс
0.
С
Т
КД
, т.к. Ндисс
0.
КД - не зависит от концентрации раствора
К25д - таблица
КД 10-10 –очень слабые электролиты
КД = (10-5 – 10-9) – слабые электролиты
КД = (10-2-10-4) – средней силы электролиты
КД 10-1 – сильные электролиты
