
- •Реакционная способность химической системы при заданных условиях Термодинамический фактор Кинетический фактор
- •Влияние концентрации на скорость реакции
- •Молекулярность:
- •Реакции 1-ого порядка
- •Реакции 2-ого порядка
- •Период полупревращения для реакций 2-ого порядка
- •Методы определения порядка реакции Химические реакции - через элементарные стадии, поэтому n определяют экспериментально.
- •Правило Вант-Гоффа
- •При увеличении температуры на 100 скорость реакции возрастает в 2 – 5 раз
- •Неблагоприятная ориентация благоприятная ориентация
- •Определение Еа:
- •Связь энергии активации с rH
- •Катализ:
- •В соответствии с формулой
- •Подставив в это уравнение данные задачи, получим
- •Используя метод стационарных концентраций, определите, каков порядок этой реакции по пероксиду водорода.
Реакции 1-ого порядка
 А
В
CH3OCH3
CH4
+ H2
+
CO
А
В
CH3OCH3
CH4
+ H2
+
CO
Кинетическое уравнение реакции первого порядка
![]() .
.
Разделим переменные и проинтегрируем
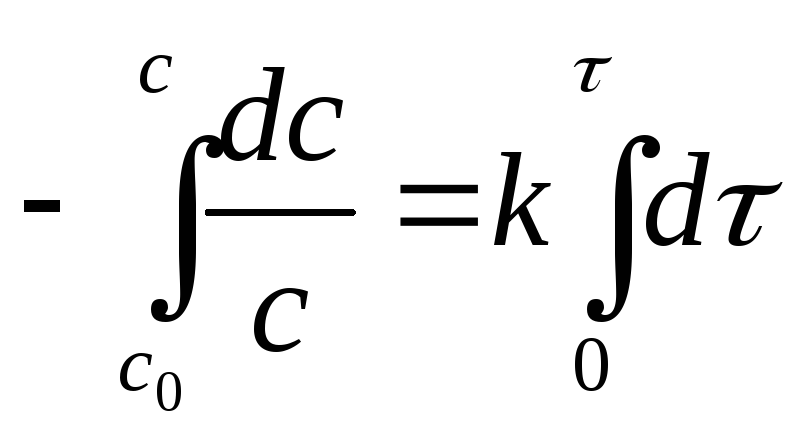
lnC – lnC0 = -k lnC = lnC0 - k
С0 – исходная концентрация
С - концентрация в момент времени
![]()
Кинетическая кривая реакций 1-ого порядка
 lgC
lgC
lgCo
tg
= -![]()
, с
![]() или
или
![]() .
k
=с-1
.
k
=с-1
![]() .
.
период полупревращения τ1/2:
время,
за которое прореагировала половина
исходного количества вещества
C
= 0,5C0
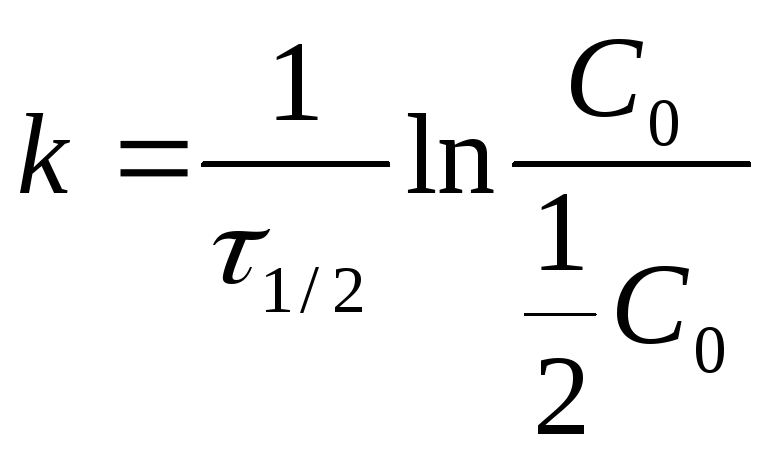
![]() - не зависит от Со
- не зависит от Со
Реакции 2-ого порядка
A + B → продукты или 2А продукты
![]()
пусть C0A = C0B
![]()
разделим переменные и проинтегрируем:
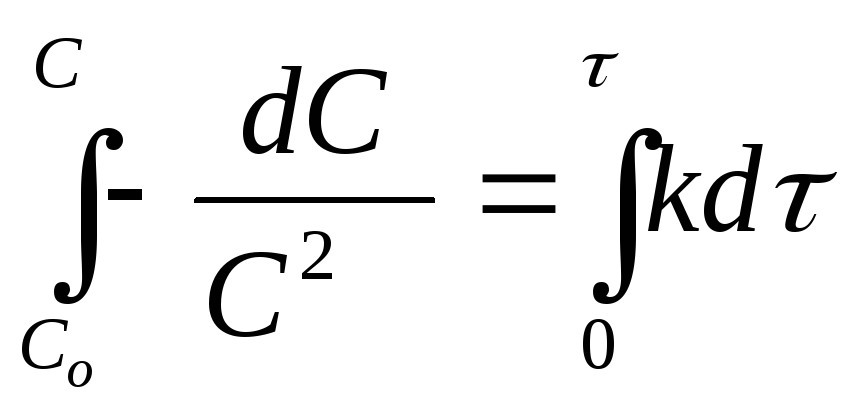
![]()
![]() лмоль-1с-1
лмоль-1с-1
Кинетическая кривая реакций 2-ого порядка
![]()
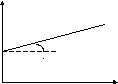 1/C
1/C
tg = k
1/C0
Период полупревращения для реакций 2-ого порядка
C = ½ C0
![]()
![]()
½ - обратно пропорционально начальной С0
Реакции 0-ого – порядка: С = С0 - k ; 1/2 = С0 /2k
Реакции
3-его порядка:
![]() ;
;![]()
Методы определения порядка реакции Химические реакции - через элементарные стадии, поэтому n определяют экспериментально.
Эксперимент: измеряют Среагир.веществ = f ()
Обрабатывают полученные данные кинетических исследований на основании решения кинетического уравнения : – dC/d = kCn:
1) подставляют в константу скорости реакций 1, 2 и т.д. порядков.
Критерий - постоянство k.
2) строят графики:
В зависимости от порядка реакции линейными являются графики в различных координатах
Таблица
|
Порядок реакции |
Кинетическое уравнение |
Координаты, в которых график зависимости С() линеен |
|
0 |
– dC/d = k |
С - |
|
1 |
– dC/d = kC |
ln С - |
|
2 |
– dC/d = kC2 |
1/C - |
|
n |
– dC/d = kCn |
1/Cn-1 - |
Константу скорости можно определить как аналитически (см. выше), так и графически – по величине наклона этих прямых на графиках в соответствующих координатах.

Правило Вант-Гоффа
При увеличении температуры на 100 скорость реакции возрастает в 2 – 5 раз
γ = (2-5) - температурный коэффициент
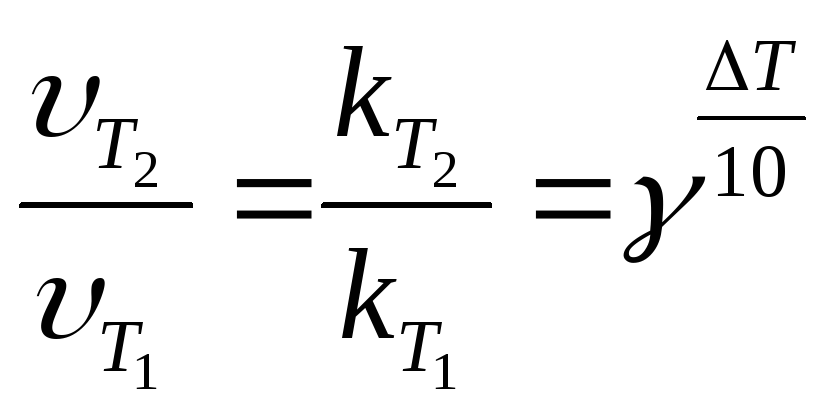
(для приблизительных расчётов).
 экзотерм.
эндотерм.
v
экзотерм.
эндотерм.
v
rН0
rН0
Т
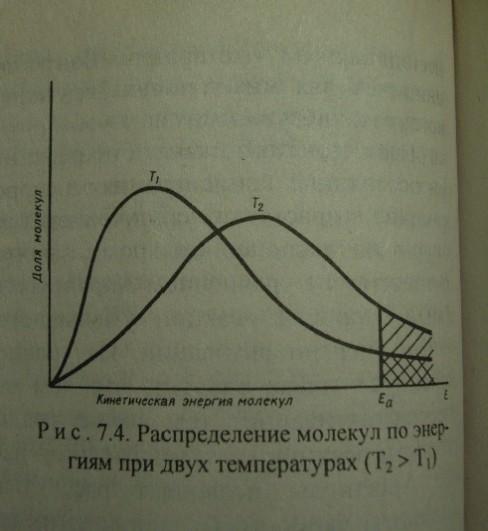
К реакции приводит столкновение лишь тех молекул, энергия которых больше определённой величины Ea.
Энергия
активации Ea
(кДж/моль): разность
между средней энергией молекул,
способных к активным столкновениям, и
средней энергией всех молекул
молекул.
По распределению Максвелла-Больцмана:
число
активных молекул Na:
![]()
если Т = 300К, Еа = 100483 Дж/моль
![]()
на 1018 молекул - только 4 молекулы активные
Еа определяется природой реагирующих молекул
Е
 а
не является f(T)
– с Т
доля активных молекул
а
не является f(T)
– с Т
доля активных молекул
Источник активации: тепловая или электрическая энергия, hv, радиоактивность, рентген.

![]()
k0 – предэкспоненциальный множитель, не зависит от Т физич. смысл: k0 = k, если Еа = 0
Кроме Еа для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения - стерический фактор.

