
кратко коллоидная
.doc
Дисперсность
– величина, обратная линейному размеру
частицы (м-1):
![]()
Поверхностная энергия GS
![]() - полная поверхностная
энергия системы.
- полная поверхностная
энергия системы.
![]()
Седиментация – это движение частиц под действием силы тяжести.
Закон Стокса:
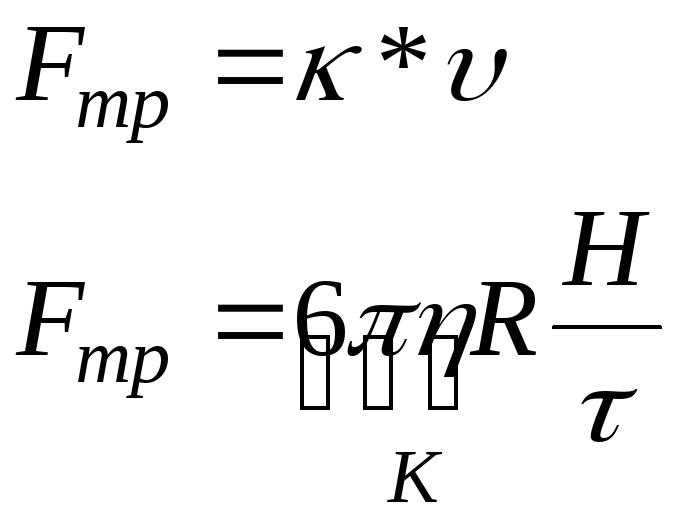
![]() - основная
формула седиментационого анализа
- основная
формула седиментационого анализа
Диффузия – это процесс, направленный на выравнивание концентраций в первоначально неоднородной среде.
![]() -
1-й закон
Фика;
-
1-й закон
Фика;
![]()
- уравнение Эйнштейна (коэффициент диффузии)
проекция
среднеквадратичного сдвига:
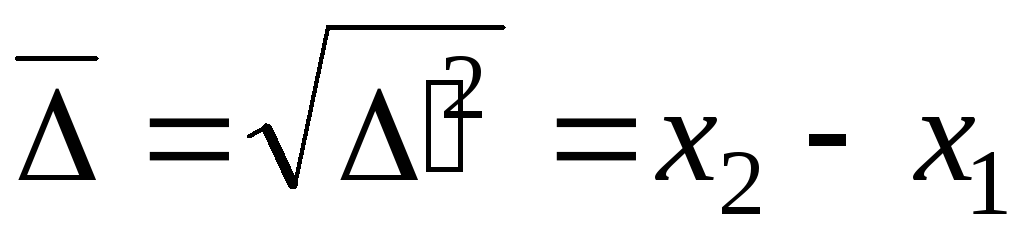
![]()
- уравнение для среднеквадратичного сдвига
D ~ 10-11 – 10-14 м2/с, [D]=[м2/с]
Коэффициент диффузии – это поток вещества, переносимый через цилиндр с единичной площадью поперечного сечения в единицу времени.
уравнению
Гиббса-Дюгема
![]()
![]() - гипсометрический
закон, барометрическая формула.
- гипсометрический
закон, барометрическая формула.
Осмосом называется движение растворителя (Дисперсионной среды) к коллоидному раствору через полупроницаемую мембрану.
уравнению
Вант-Гоффа:
![]()
Анизотропия
световых волн:

Закон Релея:
 .
.
![]() - Закон
Бугера-Ламберта-Бера
- Закон
Бугера-Ламберта-Бера
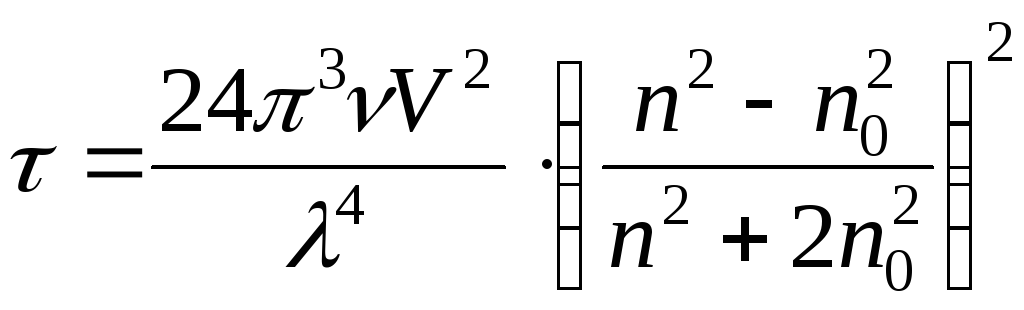 - мутность системы
[м-1]
- мутность системы
[м-1]
Мутность – это величина, обратная расстоянию, на котором интенсивность падающего света ослабляется в е раз.
Поверхностное натяжение – это работа образования единицы поверхности в обратимых изотермических условиях.
Опыт Дюпре:
![]()
Поверхностное натяжение – это сила, действующая к тангенциальной поверхности и отнесенная к единице длины периметра, ограничивающего эту поверхность.
Обобщенное уравнение I и II законов термодинамики:
![]()
![]() - Уравнение
Гиббса-Гельмгольца
- Уравнение
Гиббса-Гельмгольца
![]() - уравнение
Лапласа.
- уравнение
Лапласа.
![]() - формула Жюрена.
- формула Жюрена.
![]() - принцип
Кюри-Гиббса
- принцип
Кюри-Гиббса
![]() - уравнение
Томсана-Кельвина (капиллярной конденсации).
- уравнение
Томсана-Кельвина (капиллярной конденсации).
Метод Гиббса:
![]()
Метод поверхностного
слоя:
![]()
За толщину слоя принимают расстояние по обе стороны от границы раздела фаз, за пределами которого поверхностные свойства перестают отличаться от объемных.
Смачивание – это явление взаимодействия жидкости с твердым или жидким телом при наличии границы раздела трех фаз.
![]()
![]() - Уравнение
Юнга.
- Уравнение
Юнга.
Работа растекания – это энергия, которая выделяется при покрытии поверхности тонким слоем жидкости или это сила, действующая к поверхности вдоль всей поверхности контакта.
![]() - работа Кагезии
- работа Кагезии
![]() - работа Адгезии
- работа Адгезии
Кагезия – это взаимодействие между частицами одной фазы. Это работа, которую необходимо затратить на разрыв фазы, отнесенная к единице поверхности разрыва.
Работа адгезии
затрачивается на образование двух новых
поверхностей
![]() и
и
![]() и выигрывается за счет исчезновения
поверхности твердое тело-жидкость.
и выигрывается за счет исчезновения
поверхности твердое тело-жидкость.
![]()
Теплота смачивания (НСМ) – это количество энергии, которое выделяется при смачивании единицы поверхности.
Коэффициент
шероховатости
– отношение поверхности истинной к
поверхности геометрической.
![]() ,
,
![]()
Методы измерения поверхностного натяжения.
|
Статическое Методы, основанные на изучении статического равновесия
|
Полустатические
n nX – для измеряемой 2. Метод Дю-Нуи
3.
Метод избыточных давлений.
|
Динамические методы: метод колеблющихся струй.
АДСОРБЦИЯ.
![]() - принцип Кюри
- принцип Кюри
Адсорбцией называется процесс перераспределения компонента между объемной фазой и поверхностным слоем.
-
А – полная адсорбция – это количество адсорбата в поверхностном слое, отнесенное к единице массы или площади адсорбента. Может измеряться в моль/м2, моль/кг, г/кг и т.д.
-
Г – «гамма» - избыточная адсорбция (гипсовская) – это избыток адсорбата в поверхностном слое по сравнению с таким же объемом фазы, отнесенной к единице поверхности или массы адсорбента.
![]() - уравнение
Леннарда-Джонса
- уравнение
Леннарда-Джонса
![]()
![]()
![]() - адсорбционное
уравнение Гиббса.
- адсорбционное
уравнение Гиббса.
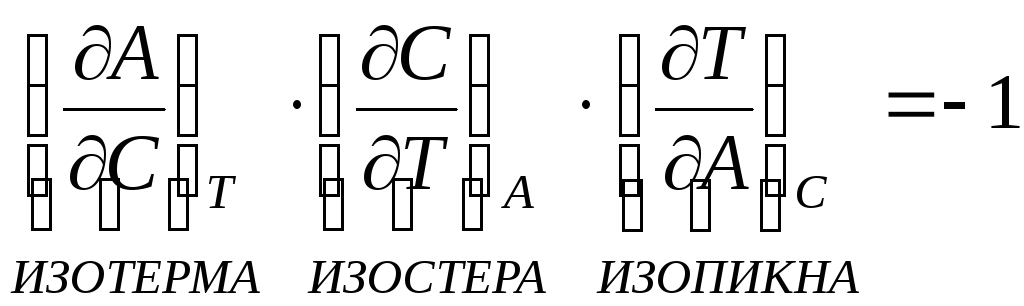
 - интегральное
изменение энергии Гиббса.
- интегральное
изменение энергии Гиббса.
![]() - дифференциальное
изменение энтропии
- дифференциальное
изменение энтропии
![]() - дифференциальная
энтальпия адсорбции
- дифференциальная
энтальпия адсорбции
![]() - изостерическая
теплота адсорбции
- изостерическая
теплота адсорбции
![]() - теплота
конденсации
- теплота
конденсации
![]() - чистая
теплота адсорбции
- чистая
теплота адсорбции
Qa
– интегральная теплота адсорбции,
![]()
Qra
– интегральная чистая теплота адсорбции,
![]()
![]() - уравнение
Генри
- уравнение
Генри
![]() - уравнение Лангмюра.
- уравнение Лангмюра.
Адсорбция смеси
газов на однородной поверхности

Адсорбция смеси газов на неоднородной поверхности
![]()
Теория БЭТ
Основные положения:
-
При попадании молекулы адсорбата на занятое место образуется кратный комплект.
-
По мере приближения p к ps уменьшается число свободных адсорбционных мест. Первоначально увеличивается, а затем уменьшается число мест, занятых единичными, двойными и т.д. комплектами.
-
При p =ps адсорбция переходит в конденсацию.
-
Горизонтальные взаимодействия отсутствуют.
-
Для первого слоя выполняется изотерма Лангмюра.
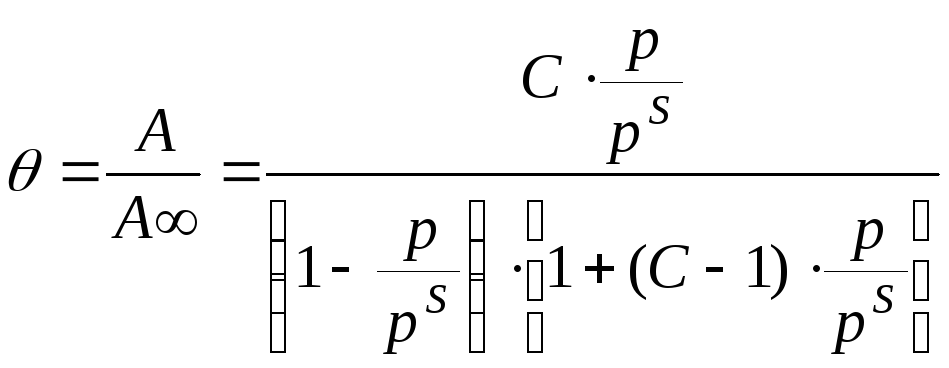
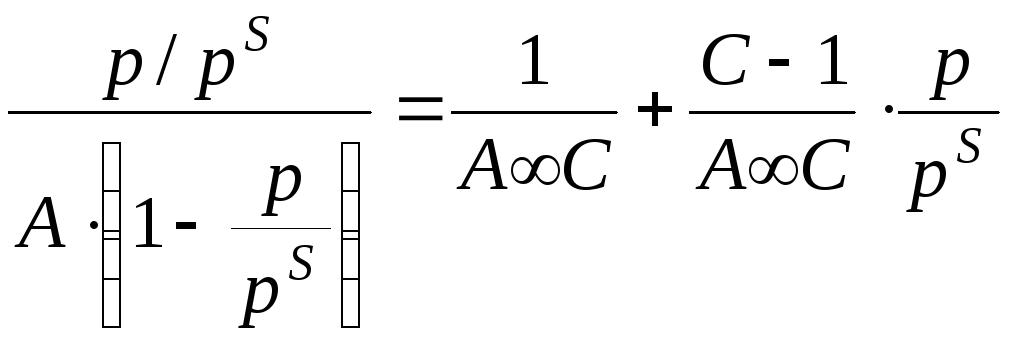
Основной недостаток теории – пренебрежение горизонтальными взаимодействиями в пользу вертикальных.
Учет взаимодействий адсорбат-адсорбат.
А дсорбент
не полярен.
дсорбент
не полярен.
Графику 1 соответствуют слабые взаимодействия адсорбат-адсорбат, сильное адсорбат-адсорбент.
Графику 2 соответствуют сильное взаимодействие адсорбат-адсорбат, сильное адсорбат-адсорбент.
Графику 3 соответствуют сильное взаимодействие адсорбат-адсорбат, слабое адсорбат-адсорбент.
![]() - уравнение Фрункина,
Фаулера, Гугенгейма.
- уравнение Фрункина,
Фаулера, Гугенгейма.
k – аттракционная постоянная.
Потенциальная теория Поляни
Адсорбция – это результат притяжения адсорбата к поверхности адсорбента за счет действия адсорбционного потенциала, который не зависит от присутствия других молекул и зависит от расстояния между поверхностью и молекулой адсорбата.
![]() ,
,
![]() - адсорбционный потенциал.
- адсорбционный потенциал.
Поскольку поверхность
неоднородная, расстояние заменяют на
адсорбционный объём
![]() .
Адсорбционный
объём – это
объём, заключенный между поверхностью
и точкой, соответствующей данному
значению
.
Адсорбционный
объём – это
объём, заключенный между поверхностью
и точкой, соответствующей данному
значению![]() .
.
Адсорбционный потенциал – это работа перенесения 1 моль адсорбата вне данного адсорбционного объёма в данную точку адсорбционного объёма (или работа переноса 1 моль насыщенного пара адсорбата, находящегося в равновесии с жидким адсорбатом в отсутствии адсорбента в равновесную с адсорбентом паровую фазу).
![]()
уравнением
Томпсона – Кельвина.
![]()
Адсорбция на
границе твердое тело – жидкость
![]()
Уравнение изотермы
адсорбции с константой обмена
![]()
Поверхностной активностью g называется способность веществ снижать поверхностное натяжение в системе.
![]()
![]() - правило Траубо
Дюкло
- правило Траубо
Дюкло
![]() - уравнение
Шишковского.
- уравнение
Шишковского.
Мицелла – называется агрегат молекул дифильных ПАВ, углеводородные радикалы которых образуют ядро, а полярные группы обращены в водную фазу.
Масса мицеллы – мицелляльная масса.
Число молекул – число агрегации.
Для гомологического ряда существует эмпирическое уравнение:
![]() a
– энергия растворения функциональной
группы.
a
– энергия растворения функциональной
группы.
b – инкремент адсорбционного потенциала, работа адсорбции на одно метиленовое звено.
Наличие в мицеллах углеводородного ядра создает возможность для растворения в водных растворах ПАВ соединений, которые не растворимы в воде, это явление называется солюбилизацией (то, что растворяется – солюбилизат, ПАВ – солюбилизатор).
![]()
![]() -
двухмерное
давление.
-
двухмерное
давление.
Пленка с обеих сторон ограниченная одинаковыми фазами называется двусторонней. В таких пленках наблюдается постоянное движение маточного раствора.
Пленки толщиной меньше 5 нм называются черными пленками.
![]() - аналог уравнения
Шишковского
- аналог уравнения
Шишковского
Электрокинетические явления. Двойной электрический слой (ДЭС).
Электроосмосом называется движение дисперсионной среды относительно неподвижной дисперсной фазы под действием электрического тока.
Электрофорез – это движение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием электрического тока.
модуль сдвига
![]()
модуль вязкого
трения
![]()
![]() - уравнение
Гелемгольца-Смалуковского
- уравнение
Гелемгольца-Смалуковского
уравнение Больцмана
![]()
Объемная плотность заряда
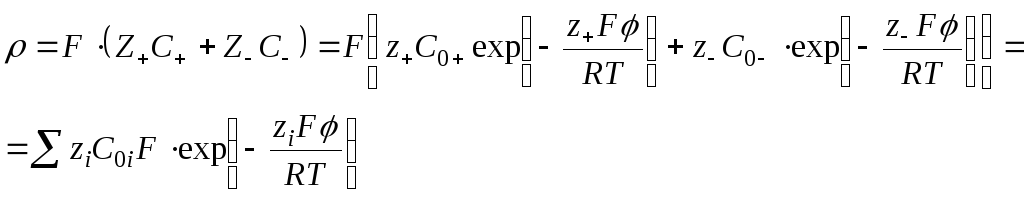 \
\
Уравнение Пуассона
![]()
![]() -
толщина ДЭС – это расстояние, на котором
потенциал ДЭС уменьшается в e
раз.
-
толщина ДЭС – это расстояние, на котором
потенциал ДЭС уменьшается в e
раз.
![]() - потенциал
экспоненциально уменьшается.
- потенциал
экспоненциально уменьшается.
![]()
Ёмкость двойного
слоя
![]()
Теория Штерна. Строение коллоидной мицеллы.
Двойной электрический
слой состоит из двух частей: плотной и
диффузной. Плотный слой образуется в
результате взаимодействия потенциалобразующих
ионов со специфически адсорбирующимися.
Эти ионы, как правило, частично или
полностью дегидратированы и могут иметь
как одинаковый, так и противоположный
к потенциалопределяющим ионам заряд.
Это зависит от соотношения энергии
электростатического взаимодействия
![]() и потенциала специфической адсорбции
и потенциала специфической адсорбции
![]() .
Ионы плотного слоя закреплены. Другая
часть ионов расположена в диффузном
слое, эти ионы свободны и могут перемещаться
вглубь раствора, т.е. из области большей
концентрации в область меньшей. Общая
плотность заряда складывается из двух
частей.
.
Ионы плотного слоя закреплены. Другая
часть ионов расположена в диффузном
слое, эти ионы свободны и могут перемещаться
вглубь раствора, т.е. из области большей
концентрации в область меньшей. Общая
плотность заряда складывается из двух
частей.
![]()
![]() - заряд слоя
Гельмгольца
- заряд слоя
Гельмгольца
![]() - Заряд диффузного
слоя
- Заряд диффузного
слоя
![]()
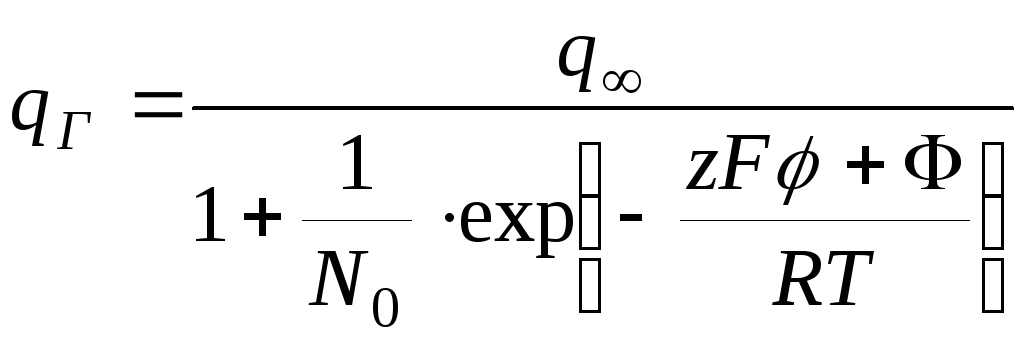 ,
где
,
где
![]() - мольная доля противоионов в растворе
- мольная доля противоионов в растворе
Линия разрыва называется границей скольжения.
Потенциал,
возникающий на границе скольжения в
результате отрыва части диффузного
слоя, называется электрокинетическим
потенциалом
(Дзэта потенциал
![]() ).
).
Частица дисперсной фазы, с окружающим её слоем противоионов и двойным электрическим слоем называется мицеллой.
Уравнение
Гелемгольца-Смолуховского
![]()
![]()
![]() (для электроосмоса).
(для электроосмоса).
Для потенциала
течения:
![]()
![]() - 1-е уравнение
Липпмана.
- 1-е уравнение
Липпмана.
![]() - 2-е уравнение
Липпмана.
- 2-е уравнение
Липпмана.
![]() - уравнение Нернста
- уравнение Нернста
![]()
 - уравнение
электрокапиллярной кривой (ЭКК).
- уравнение
электрокапиллярной кривой (ЭКК).
Коагуляция – это процесс слипания частиц, приводящий к потере агрегативной устойчивости.
![]() – правило
Шульце-Гарди
– правило
Шульце-Гарди
Плёнка – это часть системы, находящаяся между двумя межфазными поверхностями.
Расклинивающее давление возникает при резком уменьшении толщины плёнки в результате взаимодействия сближающихся поверхностных слоев.
![]()
Теория устойчивости. ДЛФО (Дерягин, Ландау, Фервей, Овербек).
Согласно теории ДЛФО в расклинивающем давлении выделяют две составляющие:
-
Электростатическая ПЭ (положительная, она обусловлена силами электростатического отталкивания). Соответствует уменьшению энергии Гиббса при возрастании толщины пленки.
-
Молекулярная ПМ (отрицательная, обусловлена действием сил притяжения). Обусловлена сжатием пленки за счет химических поверхностных сил, радиус действия сил десятые доли нм с энергией порядка 400 кДж/моль.
Полная энергия
взаимодействия:
![]()
![]() - уравнение Лапласа
- уравнение Лапласа
![]() - для слабо заряженных
поверхностей
- для слабо заряженных
поверхностей
Для сильно заряженных поверхностей:
![]()
![]()
М олекулярная
составляющая – взаимодействие двух
атомов:
олекулярная
составляющая – взаимодействие двух
атомов:
![]()
 ~
~![]()
Взаимодействие атома с поверхностью:
![]()
![]()
Поверхности
слабозаряженные:
![]() ,Для
сильнозаряженных поверхностей
,Для
сильнозаряженных поверхностей
![]()
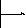
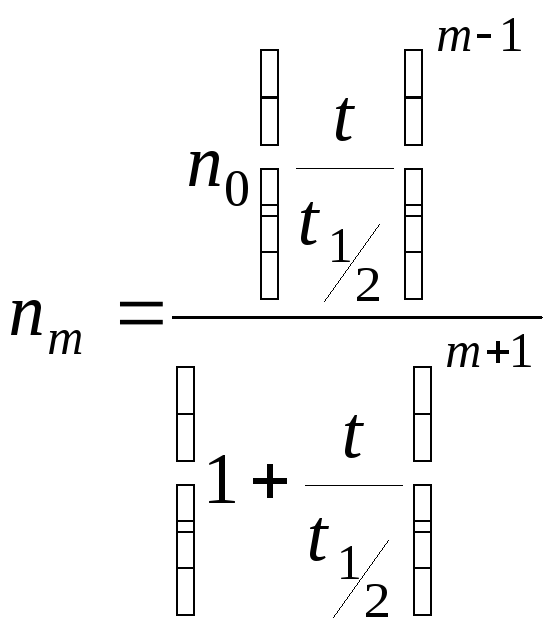
Теория быстрой коагуляции Смолуховского.

Зависимость скорости коагуляции от концентрации электролита.
I – скорость коагуляции мала,
II – скорость коагуляции практически пропорциональна концентрации электролита.
III – область быстрой коагуляции, скорость практически не зависит от концентрации.
Основные положения:
-
Исходный золь монодисперсный, сходные частицы имеют сферическую форму.
-
Все столкновения частиц результативны.
-
При столкновении двух первичных частиц образуется вторичная. Вторичная + первичная = третичная. Первичное, вторичное, третичное – кратность.
![]() ,
,
![]() ,
,
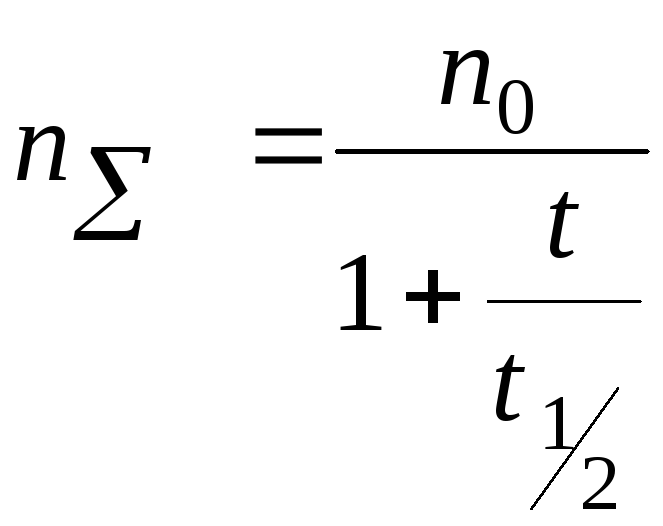 ,
,
![]()
![]()
![]()
Системы, которые
образуются самопроизвольно называются
лиофильными,
характеризуются низкими значениями
![]() и стабильные.
и стабильные.
Системы лиофобные не образуются самопроизвольно, т/д неустойчивы и требуют дополнительной стабилизации чаще всего за счет введения в систему ПАВ.
![]()
![]() Стадия образования
зародышей (
Стадия образования
зародышей (![]() )=Образование
центров кристаллизации (I)
+ Стадия доставки вещества к этим
центрам(U).
)=Образование
центров кристаллизации (I)
+ Стадия доставки вещества к этим
центрам(U).
![]() Стадия роста
зародыша
Стадия роста
зародыша
![]() = образование центров двухмерной
конденсации (I’)
+ доставка вещества к этим центрам (U)
= образование центров двухмерной
конденсации (I’)
+ доставка вещества к этим центрам (U)


 0
– число капель для стандартной жидкости
0
– число капель для стандартной жидкости