
Билет 10
1) Методы разделения аминокислот, полипептидов, белков
Самый распространенный и универсальный метод разделения – метод хроматографии, принцип разработан русским химиком Цветом.
Существует 4 основных типа:
адсобрбционная;
распределительная;
ионообменная;
хроматография по сродству (аффинная хроматография).
При адсорбционной хроматографии разделение компонентов смеси основано на их различной полярности, в качестве адсорбента используют активированный уголь, Al2O3,Si2O3. Адсорбент в виде суспензии помещают в колонку. Образец в небольшом количестве растворителя тоже помещается в колонку. Белки адсорбируются в определенном слое адсорбента. Для разделения белков производят элюирование, элюент – полярный растворитель, буферные растворы, которые будут по-разному действовать на разные белки.
Ч астным
случаем такой адсорбционной хроматографии
является тонкослойная хроматография.
астным
случаем такой адсорбционной хроматографии
является тонкослойная хроматография.
Распределительная хроматография наиболее часто используется в биохимии. Твердая фаза адсорбент служит только основой для стационарной жидкой фазы (крахмал – твердая фаза, вода – жидкая). Образец растворяют в органическом растворителе и пропускают через колонку. Различные белки, имея различное сродство к воде и органическим растворителям, растворяются в колонке и передвигаются ко дну колонки с разной скоростью.
Ионообменная хроматография.
Здесь используют ионообменные смолы –
катиониты (катионный обмен) и аниониты
(анионный обмен). Полистиролсульфокислоты
или их соли.
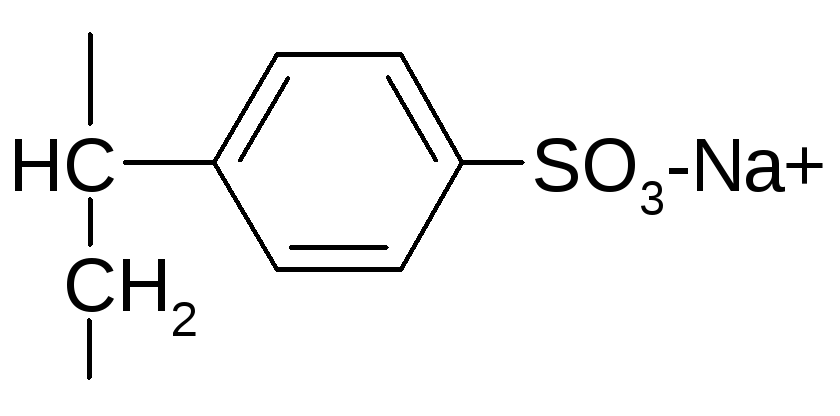
Белки, которые имеют положительный заряд, они будут способны к катионному обмену, а другие белки, которые не имеют заряда, они будут свободно проходить через эту колонку. Анионный обмен – наоборот. Солевыми насыщенными растворами проводят снятие белков с адсорбента.
Аффинная хроматографияоснована на принципе избирательного взаимодействия белка со специфическими веществами, называемымилигандами, которые закреплены на носителе. Например, смесь белков содержит амиллазу, при прохождении через крахмальную прослойку, амилаза будет адсорбироваться на крахмале, а другие белки будут проходить мимо.
В последнее время широкое применение получила гель-фильтрацияилиметод молекулярных сит. С помощью этого метода можно рассортировать белки по их размерам, по величине. Для этого смесь белков пропускают через колонку, заполненную очень мелкими пористыми гранулами высокогидратированного полимера (дексатраны – полисахариды бактерии, состоят из молекул глюкозы, полимерная цепочка которых имеет очень разветвлённое строение). (связи 1-4, 1-6). Маленькие молекулы будут проходить через поры, а большие нет, т.о. происходит разделение белков по молекулярной массе. Этот метод в настоящее время очень широко используется в фармакологии, биохимических производствах.
Электрофорез.
О пределяющую
роль в этом методе играют знак и величина
электрического заряда на данной белковой
молекуле.
пределяющую
роль в этом методе играют знак и величина
электрического заряда на данной белковой
молекуле.
Б


 еретсяU-образная трубка и
электроды. В трубку помещается раствор
компонентов белков. В зависимости от
величины заряда разные белки с разной
скоростью будут подходить к электродам.
С помощью особого оптического устройства
результаты электрофореза могут быть
записаны графически – электрофореграмма
(1 пик – 1 белок, 2 пика – 2 белка).
еретсяU-образная трубка и
электроды. В трубку помещается раствор
компонентов белков. В зависимости от
величины заряда разные белки с разной
скоростью будут подходить к электродам.
С помощью особого оптического устройства
результаты электрофореза могут быть
записаны графически – электрофореграмма
(1 пик – 1 белок, 2 пика – 2 белка).
Для того, чтобы разделить белки на отдельные компоненты используют зональный электрофорез, который производится не в растворе, а в удлиненной колонке или кювете, заполненные гелем, пропитанным исследуемым раствором. Проводят разделение белков в зависимости от их заряда. С помощью элюирующего раствора их вымывают в коллектор отбора фракции.
Очень часто для того, чтобы определить какую-то аномалию белка используют метод отпечатков пальцев(филгерприн).
Н а
хроматографической бумаге проводят по
вертикали хроматографию и разделяют,
а горизонтально проводят электрофорез.
После проведения электрофореза каждое
пятно будет на своём месте.
а
хроматографической бумаге проводят по
вертикали хроматографию и разделяют,
а горизонтально проводят электрофорез.
После проведения электрофореза каждое
пятно будет на своём месте.
Чтобы узнать, какие аминокислоты содержаться в белке, надо провести гидролиз (щелочной, кислотный, ферментативный). Далее анализируют: какие и сколько.
