
Домашние задачи по ЭХА
.docДомашние задачи по ЭХА
1. Для определения концентрации HF используют зависимость удельной электропроводности χ от содержания кислоты в растворе:
|
СHF (моль/л) |
0,0040 |
0,0070 |
0,015 |
0,030 |
0,060 |
0,121 |
0,243 |
|
χ·104 (Ом-1·см-1) |
2,5 |
3,8 |
5,0 |
8,0 |
12,3 |
21,0 |
36,3 |
Постройте градуировочный график в координатах lgχ – lgCHF и определите концентрацию фтористоводородной кислоты в растворе, в котором χ·104 = 14,4 Ом-1·см-1.
Ответ: СHF = 0,066 моль/л.
2. При титровании 50,0 мл раствора, содержащего NaOH и NH4OH 0,01 моль/л раствором HCl получили следующие данные.
|
VHCl (мл) |
0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
7,0 |
8,0 |
9,0 |
10 |
|
Электропроводность ω·103 (Ом-1) |
6,30 |
5,41 |
4,52 |
3,62 |
3,71 |
4,79 |
5,85 |
6,93 |
9,00 |
12,08 |
15,13 |
Постройте кривую титрования, определите ТЭ и рассчитайте концентрацию (в г/л) NaOH и NH4OH в исследуемом растворе.
Ответ: СNaOH
= 0,0280 г/л;
![]() =
0,0281 г/л.
=
0,0281 г/л.
3. При электролиза раствора нитрата свинца на аноде выделилось 0,2345 г PbO2. Определите молярную концентрацию эквивалента раствора Pb(NO3)2, если для анализа взяли 30,0 мл раствора.
Ответ: CPb = 0,0653 моль-экв/л.
4. Определите время, теоретически необходимое для полного выделения на катоде кадмия из 20,0 мл раствора CdSO4 с молярной концентрацией эквивалента 0,0622 моль-экв/л, если электролиз проводился при силе тока 0,10 А и выход по току составил 100 %.
Ответ: τ = 20 мин.
5. Для определения йодид-ионов использовали кулонометрический метод, титруя I- ионами MnO4-, которые электрогенерируются в анодном пространстве в сернокислой среде. Точку эквивалентности установили потенциометрически. Вычислите количество I- в растворе (мг), если титрование продолжалось 272 с, а сила тока равнялась 18,0 мА и была постоянной.
Ответ:
![]() =
6,45 мг.
=
6,45 мг.
6. Навеску алюминия 1,2245 г растворили и содержащиеся в виде примеси ионы железа (III) кулонометрически оттитровали электровосстанавливаемыми ионами Sn2+ при постоянной силе тока 4,0 мА. Точка эквивалентности фиксировалась потенциометрическим методом, время электролиза составило80 с. Определите процентное содержание железа в алюминии.
Ответ: ωFe = 1,5∙10-2 %.
7. Для определения содержания примеси свинца в металлическом алюминии навеску последнего 5,1340 г растворили, перенесли в мерную колбу на 50,0 мл и раствор довели до метки. При снятии полярограммы высота волны оказалась равной 9,0 мм. При полярографировании стандартных растворов соли свинца получили следующее результаты:
-
СPb·106, г/мл
0,50
1,0
1,5
2,0
2,5
Высота волны
hx, мм
4,0
8,0
12,0
16,0
20,0
Постройте градуировочный график и определите процентное содержание свинца в анализируемом образце.
Ответ: ωPb = 1,1∙10-3 %.
8. Для определения содержания кадмия в сплаве методом добавок навеску сплава 3,1300 г растворили и после соответствующей обработки объем раствора довели до 250,0 мл. Для снятия полярограммы взяли 18,0 мл этого раствора. Высота волны оказалась равной 19,5 мм. После добавления 2,5 мл 0,0430 моль-экв/л раствора CdSO4 высота волны увеличилась до 22,5 мм. Определите процентное содержание кадмия в сплаве.
Ответ: ωCd = 9,55 %.
9. Рассчитайте концентрации Pb2+ и Ва2+ в растворе, если при титровании 100,0 мл этого раствора 0,0500 моль/л раствором K2Cr2O7 (при Е = 1 В) были получены следующие данные:
-
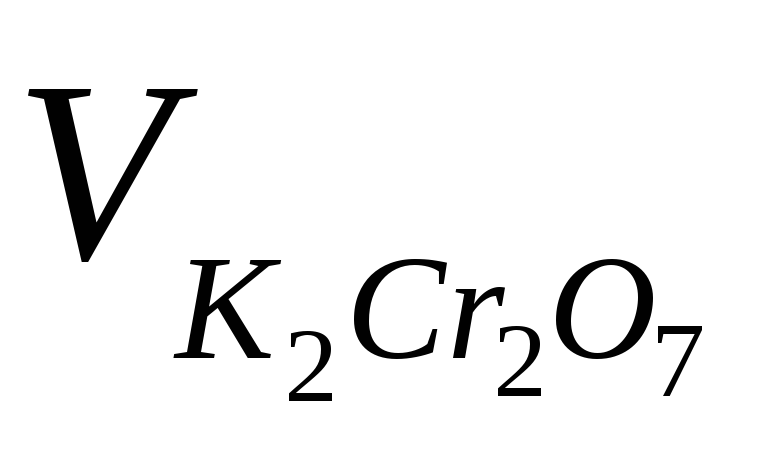 ,
мл
,
мл0
2,0
4,0
6,0
8,0
10,0
11,0
12,0
13,0
I, мкА
100
60
20
10
10
10
35
80
114
Ответ: CPb = 0,0045 моль/л; CВа = 0,0057 моль/л.
10. ЭДС гальванического элемента равна 1,072 В. Рассчитайте β4(ZnX42-), приняв температуру равной 25ºС, а коэффициенты активности равными 1.
Zn | ZnX22- (6,0∙10-2 моль/л), Х- (1,5∙10-1 моль/л) || СВЭ
Ответ: β4(ZnX42-) = 4,6∙1012.
11. Рассчитайте рН раствора, если ЭДС гальванического элемента равен 0,772 В при температуре 20°С.
Pt (H2) | N2H4∙H2O | 1 моль/л KCl, AgCl | Ag
Ответ: рН = 9,21.
12. При титровании 20,0 мл раствора, содержащего VOSO4 и FeSO4 0,1000 моль-экв/л раствором KMnO4 были получены следующие данные:
|
|
0 |
3,0 |
3,5 |
4,0 |
4,5 |
5,0 |
13,0 |
13,5 |
14,0 |
14,5 |
15,0 |
15,5 |
16,0 |
|
Е, мВ |
400 |
470 |
490 |
520 |
690 |
710 |
800 |
810 |
830 |
900 |
1110 |
1130 |
1140 |
Рассчитайте концентрацию VO2+ и Fe2+ в растворе.
Ответ:
![]() = 0,0212 моль-экв/л;
= 0,0212 моль-экв/л;
![]() =
0,0526 моль-экв/л.
=
0,0526 моль-экв/л.
Примечание. Эти задачи сдавать никому не надо. Вы решаете их сами, тренируетесь перед экзаменом. Поэтому в конце каждой задачи даны ответы. Если Вы прорешали задачи и ваши ответы сошлись с моими, то можете считать, что Вы научились решать задачи. Если возникнут вопросы, обращайтесь к Аликиной Е.Н.
