
- •Глава 10. Аналитические реакции пятой группы катионов
- •Реакции ионов кадмия
- •4. Реакция с антипирином (диантипирилметаном)
- •Реакции ионов меди (II)
- •Реакции ионов кобальта (II)
- •4. Реакция с -нитрозо--нафтолом ( реактив Ильинского).
- •5. Реакция с тетратиоцианомеркуриатом аммония
- •Реакции ионов никеля
- •Реакции ионов ртути (II)
- •4. Реакция с иодидом калия.
- •5. Реакция с хлоридом олова (II).
Глава 10. Аналитические реакции пятой группы катионов
К пятой аналитической группе относятся ионы: Cd2+, Cu2+, Co2+, Ni2+, Hg2+. В водных растворах соли меди окрашены в голубой цвет, кобальта – в красно-розовый, никеля – в светло-зеленый. Катионы кадмия и ртути в растворах бесцветны. Групповой реактив – раствор аммиака, взятый в избытке. Гидроксиды катионов V группы растворимы в избытке раствора аммиака с образованием аммиачных комплексов, причем аммиачные комплексы Cu, Co и Ni – окрашены, а Cd и Hg – бесцветны. Катионы V группы склонны к образованию комплексных соединений.
Реакции ионов кадмия
Реакция с водным раствором NH3.
Cd(NO3)2 + 2NH3 ˙ Н2О = Cd(ОН)2 + 2NH4NO3
Выпадает белый аморфный осадок, растворимый в кислотах. При избытке реагента образуется бесцветный комплекс:
Cd(OH)2 + 4NH3 ˙ Н2О = [Cd(NH3)4](OH)2 + 4Н2О
Реакция с гидроксидом натрия.
NaOH осаждает белый осадок гидроксида кадмия, нерастворимый в избытке щелочи, но легко растворяющийся в кислотах, избытке аммиака:
Cd(NO3)2 + 2NaOH =Cd(OH)2 + 2NaNO3
Реакция с сероводородом или сульфидом натрия.
Сероводород осаждает кадмий в кислой среде в виде сульфида кадмия желтого цвета: Cd(NO3)2 + H2S =CdS + 2НNO3
Данная реакция является одной из самых чувствительных на кадмий.
Осадок растворим в минеральных кислотах, нерастворим в щелочах. Проведению реакции мешают многие ионы. Открытие ионов кадмия в присутствии сложной смеси катионов проводят следующим образом: к 3–4 каплям исследуемого раствора добавляют суспензию сульфида свинца и нагревают пробирку почти до кипения в течение двух минут. Осадок отделяют центрифугированием, раствор подкисляют, добавляют раствор сероводородной воды. В присутствии ионов кадмия образуется желтый осадок CdS.
4. Реакция с антипирином (диантипирилметаном)
Диантипирилметан образует с Cd2+ в слабокислой среде в присутствии Br- обильный белый осдок состава (RH)2[CdBr4], где R –ДАМ. Мешают определению ионы ртути, олова и свинца. В этом случае перед добавлением ДАМ к раствору добавляют тиомочевину. Также мешают ионы Fe3+, дающие с реагентами кроваво-красное окрашивание. Их восстанавливают аскорбиновой кислотой или связывают в бесцветный комплекс с помощью фторид-ионов.
Выполнение реакции в присутствии мешающих: к р–ру приливают избыток конц. NH3 и содержимое пробирки центрифугируют. Фильтрат переносят в другую пробирку, добавляют 1 каплю фенолфталеина, 1 М раствор H2SО4 по каплям до обесцвечивания раствора, плюс еще 2 капли. Приливают ~ 0,5 мл раствора KBr, 3–4 капли 5% раствора ДАМ в уксусной кислоте (1:1). Образование белого осадка свидетельствует о присутствии в растворе ионов Cd2+.
Реакции ионов меди (II)
Реакция с водным раствором аммиака.
Концентрированный раствор NH3 при постепенном добавлении к раствору соли меди сначала осаждает зеленовато-голубой осадок основной соли меди, которая при дальнейшем добавлении аммиака растворяется в избытке реагента с образованием аммиачного комплекса интенсивно сине-фиолетового цвета:
2Cu(NO3)2 + 2NH3 ˙ Н2О = Cu2(OH)2(NO3)2 + 2NH4NO3
(Cu2(OH)2(NO3)2 + 6NH3 + 2NH4NO3 = 2[Cu (NH3)4](NO3)2 + 2Н2O
Под действием кислот окраска комплекса разрушается.
Выполнение реакции: к 2–3 каплям исследуемого раствора прибавляют 10–12 капель концентрированного раствора NH3 до рН > 9. В присутствии ионов меди образуется раствор сине-фиолетового цвета. В случае сомнения лучше провести центрифугирование пробирки. Этой реакцией можно открыть ионы меди в присутствии любых других ионов. Лишь ионы никеля дают бледно-фиолетовую окраску. Важно, чтобы концентрация раствора NH3 была высокой.
Реакция с гидроксидом натрия.
NaOH осаждает голубой осадок Cu(OH)2, чернеющий при нагревании из–за превращения в CuO:
Cu(NO3)2+ 2NaOH = Cu(OH)2 + 2NaNO3
Cu(OH)2 обладает слабыми амфотерными свойствами. Растворяясь в избытке концентрированного раствора щелочи, он образует соответствующие куприты: Cu(ОН)2 + 2КОН = К2CuO2 + 2Н2O
Реакция с сероводородом.
Сероводород образует черный осадок сульфида меди, нерастворимый в разбавленных соляной и серной кислотах (отличие от кадмия), растворимый в разбавленной НNO3 при нагревании:
Cu(NO3)2 + H2S = CuS + 2НNO3
3CuS + 8НNO3 = 3Cu(NO3)2 + 3S + 2NO + 4Н2O
Реакция с желтой кровяной солью.
Ферроцианид калия дает с медью при рН ~ 7 красно-бурый осадок, нерастворимый в разбавленных кислотах, но растворимый в аммиаке:
2Cu(NO3)2 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 4KNO3
Вариант 1. К 5–7 каплям нейтрального или слабокислого раствора соли Cu2+ добавляют 3–4 капли реактива и наблюдают выделение красно-бурого осадка. При малых концентрациях ионов Cu2+ осадок не образуется, но раствор окрашивается в розовый цвет. Данная реакция является более чувствительной, чем реакция с раствором NH3. Мешают определению ионы Fe3+, Co2+ и Ni2+, дающие с реагентом цветные осадки. Поэтому их либо отделяют, либо связывают в устойчивые комплексные соединения. Вариант 2. На фильтровальную бумажку наносят каплю конц. NH3, каплю анализируемого раствора, еще 2–3 капли NH3 в центр пятна и дают раствору впитаться. Затем по периферии пятна проводят вначале капилляром с СН3СООН, а затем капилляром с K4[Fe(CN)6]. В присутствии Cu2+ появляется красно-коричневое кольцо Cu2[Fe(CN)6].
Реакция с тиосульфатом натрия.
Тиосульфат натрия, прибавленный к подкисленному раствору соли меди, обесцвечивает раствор, образуя комплексную соль.
При нагревании полученного раствора образуется бурый осадок Cu2S:
2Cu(NO3)2 + 2Na2S2O3 + 2Н2O = Cu2S + S + 2H2SO4 + 4NaNO3
Данную реакцию можно использовать для отделения меди от кадмия, который осадка с тиосульфатом натрия не образует.
Реакция с Fe, Zn, Al.
Железо, цинк, алюминий и другие металлы, нормальные окислительно-восстановительные потенциалы которых меньше потенциала системы Cu2+/Cu (0,34 В), восстанавливают ионы меди (II) до металла:
Cu(NO3)2 + Fe =Fe(NO3)2 + Cu
Выполнение реакции: на хорошо очищенную Fe, Zn или Al пластинку наносят каплю подкисленного серной кислотой раствора, содержащего ионы меди. Через несколько секунд образуется красноватое пятно металлической меди. Мешает проведению реакции присутствие азотной кислоты, которая растворяет медь. Её удаляют выпариванием с серной кислотой.
Реакция с иодидом калия.
2CuSO4 + 4 KI = Cu2I2 + I2 + 2K2SO4
Выделившийся I2 окрашивает раствор в буро-коричневый цвет.
Оптимальные условия проведения реакции рН = 2–3. Добавление крахмала делает реакцию более чувствительной. Реакции мешают ионы железа (III).
Реакция с глицерином.
Глицерин в сильнощелочной среде образует темно-синий глицерат меди:

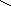 Cu(NO3)2
+
CH2OH–CHOH–CH2OH
+ 2NaOH = CH2O
– CHO–CH2OH
+
Cu(NO3)2
+
CH2OH–CHOH–CH2OH
+ 2NaOH = CH2O
– CHO–CH2OH
+
Cu/2
+ 2NaNO3 + 2H2O
Гидроксид кадмия Cd(OH)2 при этом остается в осадке, что может быть использовано также для разделения меди и кадмия.
Выполнение реакции: к 3–4 каплям раствора, содержащего Cu2+, добавляют 5–6 капель 4 М раствора щелочи и 2–3 капли глицерина. Появление интенсивно-синей окраски указывает на присутствие ионов меди.
Реакция с глицином.
Глицин (аминоуксусная кислота – H2NCH2COOH) образует с Cu2+ раствор интенсивно-синего цвета.
Выполнение реакции: к 5–6 каплям исследуемого нейтрального раствора прибавляют ~0,5 мл 5%-го раствора глицина. В присутствии Cu2+ голубая окраска меняется на интенсивно синюю. В присутствии Fe3+ окраска становится зеленой. При необходимости его можно перевести в фторидный комплекс. Остальные катионы реакции не мешают, однако она малочувствительна. Концентрацию раствора соли меди желательно увеличить путем выпаривания раствора в фарфоровой чашке. После её остывания к остатку добавляют 2–3 капли глицина, появляется синее окрашивание.
