
- •Глава 10. Аналитические реакции пятой группы катионов
- •Реакции ионов кадмия
- •4. Реакция с антипирином (диантипирилметаном)
- •Реакции ионов меди (II)
- •Реакции ионов кобальта (II)
- •4. Реакция с -нитрозо--нафтолом ( реактив Ильинского).
- •5. Реакция с тетратиоцианомеркуриатом аммония
- •Реакции ионов никеля
- •Реакции ионов ртути (II)
- •4. Реакция с иодидом калия.
- •5. Реакция с хлоридом олова (II).
5. Реакция с тетратиоцианомеркуриатом аммония
CoС12 + (NH4)2[Hg(NCS)4] = Co[Hg(NCS)4] + 2NH4Cl
синий
Выполнение реакции: на предметное стекло наносят 1 каплю раствора соли Co2+, слегка подсушивают и добавляют 1 каплю реактива. Через 1–2 мин под микроскопом наблюдают кристаллы в виде синих листочков.
Реакции ионов никеля
Реакция с водным раствором аммиака.
Аммиак, прибавленный в небольшом количестве, образует соответствующую основную соль никеля:
NiCI2 + NH3 ·Н2О = NiOHCl + NH4Cl,
которая растворяется при дальнейшем добавлении раствора NH3 вследствие образования аммиаката никеля синего цвета:
Ni(OH)Cl + 5 NH3 ·Н2О + NH4Cl = [Ni(NH3)6]С12 + 6H2O
Реакция со щелочами.
Едкая щелочь образует зеленый осадок основной соли, который в дальнейшем переходит в гидроксид никеля того же цвета. Осадок растворяется в кислотах, солях аммония, аммиаке, но нерастворим в избытке щелочи:
NiCI2 + NaOH = Ni(OH)Cl + NaCl
Ni(OH)Cl + NaOH = Ni(ОН)2 + NaCl
Ni(OH)2 в отличие от Со(ОН)2 не окисляется пероксидом водорода. Его можно окислить хлором или бромом в щелочной среде:
2Ni(OH)2 + С12+ 2NaOH = 2Ni(ОН)3 + 2NaCl
черн.
N i2+
–
i2+
–
![]()
Ni3+
2
Ni3+
2
Cl20
+ 2![]()
2Cl–
1
2Cl–
1
Реакция с сульфидом аммония.
Сульфид аммония осаждает черный осадок сульфида никеля:
NiCl2 + (NH4)2S = NiS + 2NH4Cl,
который растворяется в разбавленных кислотах; при стоянии NiS переходит в нерастворимую модификацию и растворяется лишь в царской водке и реактиве Комаровского:
 3NiS +
6НС1
+ 2НNО3
= 3NiCl2
+ 3S
+ 2NO
+ 4H2O
3NiS +
6НС1
+ 2НNО3
= 3NiCl2
+ 3S
+ 2NO
+ 4H2O
S 2–
–
2–
–
![]()
S0
3
S0
3
N5+
+ 3![]()
N2+
2
N2+
2
NiS + H2O2 + 2CH3COOH = Ni(CH3COO)2 + S + 2H2O
 S2–
–
S2–
–
![]()
S0 1
S0 1
O22–
+ 2![]()
2O2– 1
2O2– 1
Реакция с диметилглиоксимом (ДМГ) C4H8N2O2 (реактивом Чугаева).
Реактив Чугаева в аммиачной среде образует ало–красный осадок внутрикомплексной соли диметилглиоксимата никеля:
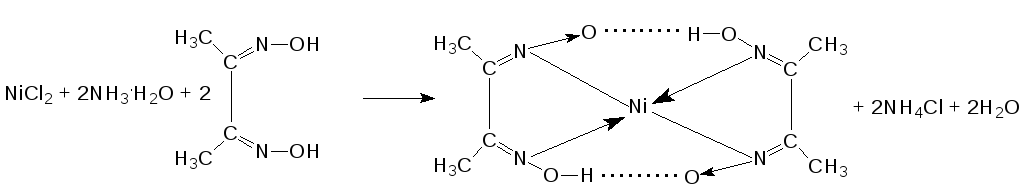
Условия проведения реакции:
а) рН ~ 8–9, что соответствует слабо-аммиачной среде. В кислой среде наблюдается растворение осадка, в щелочной выпадает осадок Ni(OH)2;
б) мешают реакции большие количества ионов Fe2+, Fe 3+, Cu2+, Co 2+.
Выполнение реакции: реакцию обычно проводят капельным путем.
На фильтровальную бумагу наносят одну каплю раствора соли никеля, держат её над склянкой с раствором аммиака, добавляют одну каплю 1%-го спиртового раствора реактива, появляется ало–красное окрашивание.
При наличии посторонних ионов, на полоску фильтровальной бумажки наносят одну каплю 2 М раствора Na2HPO4, в центр пятна одну каплю исследуемого раствора (при наличии в растворе иона Fe2+, кроме того каплю Н2О2). После этого добавляют еще каплю Na2HPO4 и каплю спиртового раствора диметилглиоксима. Затем пятно обрабатывают парами аммиака, держа его над бутылью с ним в течение 2–3 минут. При этом нерастворимые фосфаты мешающих ионов остаются в центре пятна, тогда как фосфат никеля, растворимый в растворе аммиака, переносится на периферию пятна. В присутствии в анализируемом растворе никеля всё пятно (если никеля много) или его перифирическая часть окрашивается в розово-красный цвет. По вышеописанной методике можно определять никель в присутствии большинства мешающих ионов.
