
35. Жесткость воды
..docxЖесткость воды – один из технологических показателей, принятый для характеристики состава и качества природных вод. Обусловливает повышенное содержание в воде растворенных солей кальция и магния. Жесткость воды выражается суммой миллиэквивалентов ионов Са и Mg или суммой миллимолей этих ионов, содержащихся в 1 л воды. Кальций и магний присутствуют в воде в виде соединений, в основном солей. По виду соли жесткость классифицируют:1. Карбонатная(временная)-обусловлена присутствием гидрокарбонатов(они растворимы) Са(НСO3), Mg(HCO3) 2. Некарбонатная( постоянная)-обусловлена присутствием других солей Са и Mg, в основном сульфатов и хлоридов. 3. Общая жесткость. Часто считают общую жесткость, т.е. общее содержание Са и Mg.
Минусы жесткой воды:Образование накипи, ионы Са и Mg могут вступать в хим. Реакции, поэтому жесткая вода неприменима в промышленности, плохо мылится мыло.
Плюсы жесткой воды: Человек не должен пить ни очень жесткую воду, ни очень мягкую, ионы Са в воде тормозят коррозию бетона, но повышенное содержание хлоридов и сульфатов ускоряют коррозию.
Способы устранения жесткости:
1 группа способов – термодинамические(нагрев воды) – удаляют только карбонатную жесткость. Са(НСО3)2→t→СаСО3↓+Н2О+СО2
2 группа – реагентные способы – удаляется любая жесткость. К воде добавляется реагент, т.е. вещество, которое образует с ионами Са и Mg или осадки или комплексные соединения. а) Гидроксид Са в виде известковой воды или известкового молока. Са(НСО3)2+Са(ОН)2→2СаСО3↓+2Н2О. Добавление соды. б)Na2CO3+CaCl2→CaCO3↓+2NaCl – удаляется любая жесткость. в) Фосфаты Na, а сейчас полифосфаты Na. Они связывают Са и Mg в комплексное соединение.
3 способ –
фильтрация: воду пропускают через
фильтры, жесткость удаляется на
ионно-обменной смоле. R-Na2+Ca→R-Ca+2Na.
R-очень сложный органический
радикал. Ж=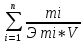 .
.
